Татьяна Борисовна
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад открытого урока по химии на тему Типы химических реакций
Содержание
- 1. Презентация открытого урока по химии на тему Типы химических реакций
- 2. повторить и обобщить знания учащихся о химических
- 3. Слайд 3
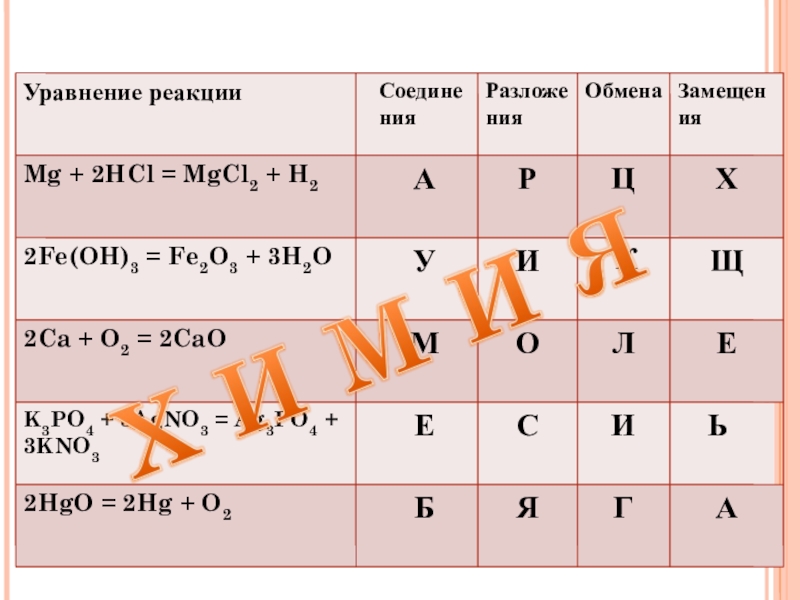
- 4. ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ_____________________а) Р
- 5. 2) _________________________а) HgO → Hg + O2б)
- 6. 3) __________________________а) AI + CuCI2 → AICI3
- 7. 1. 2NaCl → 2Na + Cl22. CaO
- 8. 1.2AI+6HCI→2AICI3 + 3H22. 2NO + O2 →
- 9. Реакции обмена идут до конца:,Если выделится газ
- 10. Слайд 10
- 11. 10.12.11
- 12. 4) ____________________________1) MgCO3 + HCI → MgCI2
повторить и обобщить знания учащихся о химических реакциях, признаках и типах химических реакций; закрепить навыки составления химических уравнений и расстановки коэффициентов; развивать память, устойчивое внимание, самостоятельное мышление, умение слушать и слышать другого человека.
Слайд 1« Типы химических реакций.
Реакции обмена.»
Учитель химии МБОУ СОШ №140
города Новосибирска
Сыромятникова
Слайд 2повторить и обобщить знания учащихся о химических реакциях, признаках и типах
химических реакций;
закрепить навыки составления химических уравнений и расстановки коэффициентов;
развивать память, устойчивое внимание, самостоятельное мышление, умение слушать и слышать другого человека.
закрепить навыки составления химических уравнений и расстановки коэффициентов;
развивать память, устойчивое внимание, самостоятельное мышление, умение слушать и слышать другого человека.
Слайд 4 ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
_____________________
а) Р + O2 → Р2O5
б)
Mg + O2 → MgO
в) Na2O + H2O → NaOH
в) Na2O + H2O → NaOH
С О Е Д И Н Е Н И Я
Слайд 52) _________________________
а) HgO → Hg + O2
б) Ag2O → Ag +
O2
в) Fe(OH)2 → FeO + H2O
в) Fe(OH)2 → FeO + H2O
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
Р А З Л О Ж Е Н И Я
Слайд 63) __________________________
а) AI + CuCI2 → AICI3 + Cu
б) Fe
+ NaNO3 → Fe(NO3)2 + Na
в) Zn + HCl → ZnCl2 + H2↑
г) Сu + H2SO4 → CuSO4 + H2↑
в) Zn + HCl → ZnCl2 + H2↑
г) Сu + H2SO4 → CuSO4 + H2↑
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
З А М Е Щ Е Н И Я
Слайд 9Реакции обмена идут до конца:,
Если выделится газ - Это раз;
И получится
вода -Это два;
А еще — нерастворимый осаждается продукт…
"Есть осадок" - говорим мы.
Это третий важный пункт.
Химик правила обмена не забудет никогда:
В результате - непременно
Будет газ или вода,
Выпадет осадок -
Вот тогда - порядок!
А еще — нерастворимый осаждается продукт…
"Есть осадок" - говорим мы.
Это третий важный пункт.
Химик правила обмена не забудет никогда:
В результате - непременно
Будет газ или вода,
Выпадет осадок -
Вот тогда - порядок!
Слайд 124) ____________________________
1) MgCO3 + HCI → MgCI2 + H2O + CO2↑
2)
BaCI2 + AgNO3 → Ba(NO3)2 + AgCI
3) Ca(OH)2 + K2CO3 → CaCO3 + KOH
4) NaOH + CuSO4 → Na2SO4 + Cu(OH)2
3) Ca(OH)2 + K2CO3 → CaCO3 + KOH
4) NaOH + CuSO4 → Na2SO4 + Cu(OH)2
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
О Б М Е Н А