- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Окислительно-восстановительные реакции 11 класс
Содержание
- 1. Презентация Окислительно-восстановительные реакции 11 класс
- 2. План урока1.Повторение теории ОВР2.Составление уравнений ОВР методом
- 3. Значение с.о.к элементам с постоянной положительной степенью
- 4. Например, рассчитаем степень окисления хрома в дихромате
- 5. ФОРМУЛА ВЕЩЕСТВА-
- 6. Самостоятельная работа № 1 по инструктивной карте:пользуясь
- 7. Слайд 7
- 8. Самостоятельная работа № 2 по инструктивной
- 9. СОСТАВЛЕНИЕ ОВР методом электронного баланса1.
- 10. Самостоятельная работа № 3 по инструктивной карте:методом
- 11. окислители восстановители окислители - восстановители в
- 12. Самостоятельная работа № 4 по инструктивной карте:в
- 13. Слайд 13
- 14. Слайд 14
- 15. Слайд 15
- 16. Слайд 16
- 17. На характер протекания ОВР влияет:1.Концентрация веществ2. Среда раствора3.Температура
- 18. Важнейшие окислители и продукты их восстановления
- 19. Слайд 19
- 20. Слайд 20
- 21. Слайд 21
- 22. Продукты восстановления KMnO4 (MnO4-):в кислой среде –
- 23. Температура.Продукты взаимодействия хлора с раствором щелочи будут
- 24. Значение окислительно-восстановительных реакций в жизни человека. В
- 25. Значение окислительно-восстановительных реакций в природе. Извержение вулкана,
- 26. Значение окислительно-восстановительных реакций в медицине
- 27. Значение окислительно-восстановительных реакций в исскустве
- 28. Значение окислительно-восстановительных реакций В технике
- 29. Вывод: окислительно—восстановительные процессы
- 30. Закрепление Укажите ОВР:
- 31. Тест: В кислой среде KMnO4 восстанавливается
- 32. домашнее задание Используя схемы,
План урока1.Повторение теории ОВР2.Составление уравнений ОВР методом электронного баланса3.ОВ способность элементов4.Важнейшие окислители и восстановители5.Типы ОВР6.Характер протекания ОВР7. Значение ОВР.
Слайд 2План урока
1.Повторение теории ОВР
2.Составление уравнений ОВР методом электронного баланса
3.ОВ способность элементов
4.Важнейшие
окислители и восстановители
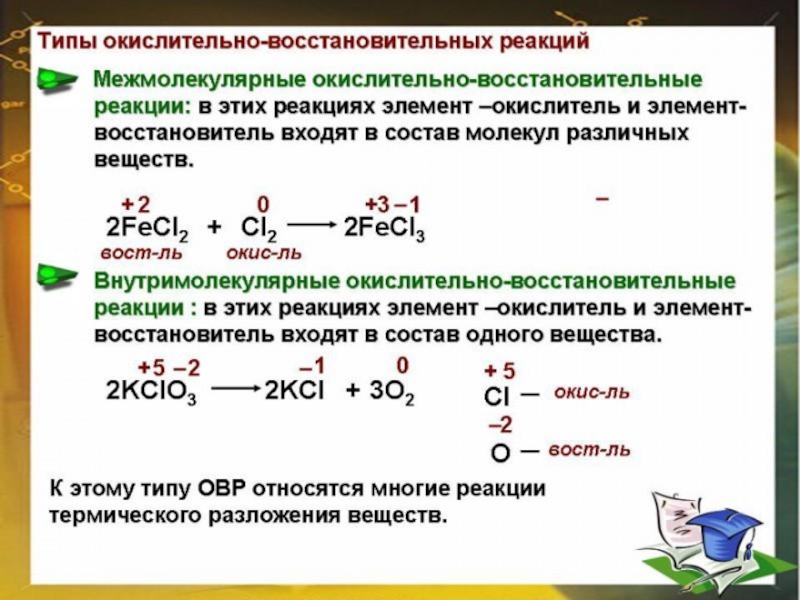
5.Типы ОВР
6.Характер протекания ОВР
7. Значение ОВР.
5.Типы ОВР
6.Характер протекания ОВР
7. Значение ОВР.
Слайд 3Значение с.о.
к элементам с постоянной положительной степенью окисления относят щелочные металлы:
Li+1, Na+1, K+1, Rb+1, Cs+1, Fr+1, следующие элементы II группы периодической системы: Ве+2, Mg+2, Ca+2, Sr+2, Ва+2, Ra+2, Zn+2, а также элемент III А группы - А1+3 и некоторые другие.
Из неметаллов постоянную отрицательную степень окисления (-1) имеет F.
В простых веществах, образованных атомами металлов или неметаллов, степени окисления элементов равны нулю, например: Na°, Al°, Fe°, Н20, О20, F20, Cl20, Br20.
Для водорода характерны степени окисления: +1 (Н20), -1 (NaH).
Для кислорода характерны степени окисления: -2 (Н20), -1 (Н2О2), +2 (OF2).
Из неметаллов постоянную отрицательную степень окисления (-1) имеет F.
В простых веществах, образованных атомами металлов или неметаллов, степени окисления элементов равны нулю, например: Na°, Al°, Fe°, Н20, О20, F20, Cl20, Br20.
Для водорода характерны степени окисления: +1 (Н20), -1 (NaH).
Для кислорода характерны степени окисления: -2 (Н20), -1 (Н2О2), +2 (OF2).
Слайд 4Например, рассчитаем степень окисления хрома в дихромате калия K2Cr2O7.
Степень окисления калия
+1, кислорода -2.
Подсчитаем число отрицательных зарядов: 7 • (-2) = -14
Число положительных зарядов должно быть + 14. На калий приходится два положительных заряда, следовательно, на хром – 12.
Так как в формуле два атома хрома, 12 делим на два: 12 : 2 = 6.
+ 6 – это степень окисления хрома.
Проверка: алгебраическая сумма положительных и отрицательных степеней окисления элементов равна нулю, молекула электронейтральна
Подсчитаем число отрицательных зарядов: 7 • (-2) = -14
Число положительных зарядов должно быть + 14. На калий приходится два положительных заряда, следовательно, на хром – 12.
Так как в формуле два атома хрома, 12 делим на два: 12 : 2 = 6.
+ 6 – это степень окисления хрома.
Проверка: алгебраическая сумма положительных и отрицательных степеней окисления элементов равна нулю, молекула электронейтральна
Слайд 6Самостоятельная работа № 1 по инструктивной карте:
пользуясь приведенными сведениями, рассчитайте степени
окисления элементов в соединениях:
MnO2, H2SO4, K2SO3, H2S, KMnO4
MnO2, H2SO4, K2SO3, H2S, KMnO4
Слайд 8
Самостоятельная работа № 2 по инструктивной карте:
Выберите из уравнений реакций только
окислительно-восстановительные:
Br2 + KI → I2 + KBr
SO3 + 2NaOН = Na2SO4 + Н2О
H2SO4 + Zn = ZnSO4 + H2
СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Ответ:1,3
SO3 + 2NaOН = Na2SO4 + Н2О
H2SO4 + Zn = ZnSO4 + H2
СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Ответ:1,3
Слайд 9СОСТАВЛЕНИЕ ОВР методом электронного баланса
1. Определим степени окисления элементов
в уравнении реакции.
2. Подчеркнем символы элементов, изменяющие степени
окисления.
3. Составим электронный баланс
( уравнения процессов окисления – восстановления).
Находим множители для уравнений процессов
окисления-восстановления.
4. Найденные множители запишем перед формулами продуктов
окислителя и восстановителя, то есть в правую часть уравнения
реакции.
5. Расставим коэффициенты в уравнении реакции:
А) продукты окисления-восстановления
Б) металлы
В) неметаллы
Г) водород
Д) кислород.
2. Подчеркнем символы элементов, изменяющие степени
окисления.
3. Составим электронный баланс
( уравнения процессов окисления – восстановления).
Находим множители для уравнений процессов
окисления-восстановления.
4. Найденные множители запишем перед формулами продуктов
окислителя и восстановителя, то есть в правую часть уравнения
реакции.
5. Расставим коэффициенты в уравнении реакции:
А) продукты окисления-восстановления
Б) металлы
В) неметаллы
Г) водород
Д) кислород.
Слайд 10Самостоятельная работа № 3 по инструктивной карте:
методом электронного баланса найдите и
поставьте коэффициенты в следующей схеме окислительно –восстановительной реакции:
MnO2 + H2SO4 → MnSO4 + O2 + H2O (2MnO2 + 2H2SO4 → 2MnSO4 + O2 +2H2O)
MnO2 + H2SO4 → MnSO4 + O2 + H2O (2MnO2 + 2H2SO4 → 2MnSO4 + O2 +2H2O)
Слайд 11
окислители
восстановители
окислители - восстановители
в HN+5O3 азот в состоянии + 5 может быть
только окислителем и принимать электроны.
в N-3Н3 азот в состоянии -3 может отдавать электроны, т.е. является восстановителем.
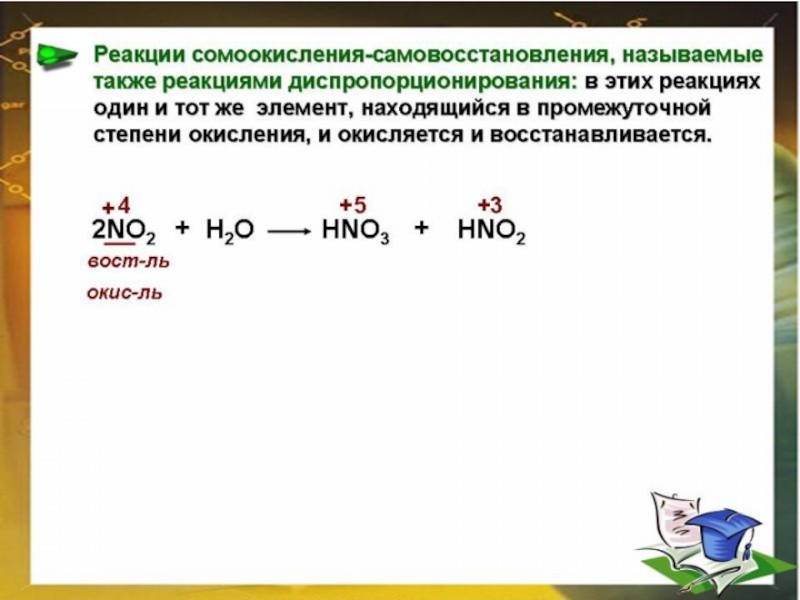
Элементы в промежуточных положительных степенях окисления могут, как отдавать, так и принимать электроны и, следовательно, способны вести себя как окислители или восстановители в зависимости от условий. Например, N+3, S+4 . Попадая в среду с сильным окислителем, ведут себя как восстановители. И, наоборот, в восстановительной среде они ведут себя как окислители.
в N-3Н3 азот в состоянии -3 может отдавать электроны, т.е. является восстановителем.
Элементы в промежуточных положительных степенях окисления могут, как отдавать, так и принимать электроны и, следовательно, способны вести себя как окислители или восстановители в зависимости от условий. Например, N+3, S+4 . Попадая в среду с сильным окислителем, ведут себя как восстановители. И, наоборот, в восстановительной среде они ведут себя как окислители.
Слайд 12Самостоятельная работа № 4 по инструктивной карте:
в какой из приведенных схем
уравнений реакций MnO2 проявляет свойства окислителя, а в какой – свойства восстановителя:
2MnO2 + O2 + 4KOH = 2K2MnO4 + 2H2O (MnO2 – восстановитель)
MnO2 + 4HCI = MnCI2 + CI2 + 2H2O (MnO2 – окислитель)
)
2MnO2 + O2 + 4KOH = 2K2MnO4 + 2H2O (MnO2 – восстановитель)
MnO2 + 4HCI = MnCI2 + CI2 + 2H2O (MnO2 – окислитель)
)
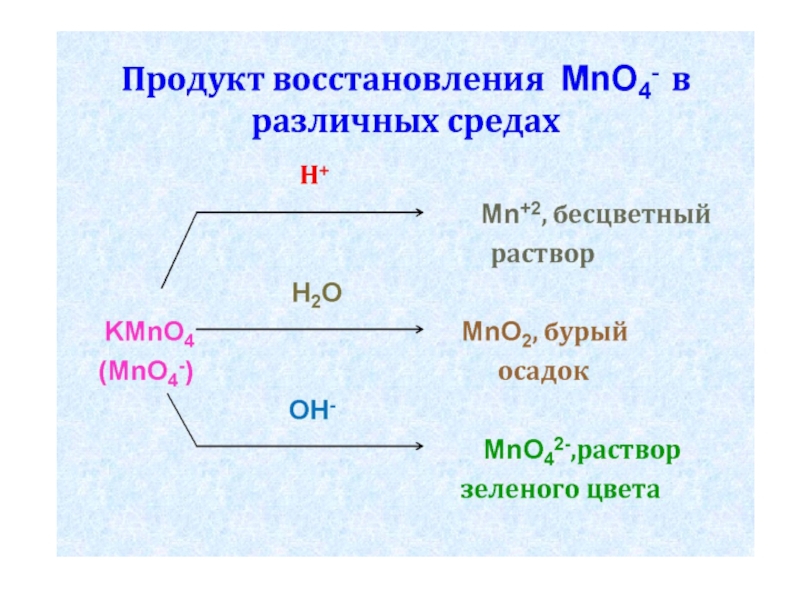
Слайд 22Продукты восстановления KMnO4 (MnO4-):
в кислой среде – Mn+2 (соль), бесцветный раствор;
в нейтральной среде – MnO2, бурый осадок;
в щелочной среде - MnO42- , раствор зеленого цвета.
К схемам реакций:
KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O
KMnO4 + Na 2SO 3 + H2O → MnO2↓ + Na2SO4 + KOH
KMnO4 + Na 2SO3 + КOH → Na2SO4 + K2MnO4 + H2O
Д.З.Подберите коэффициенты методом электронного баланса. Укажите окислитель и восстановитель
Слайд 23Температура.
Продукты взаимодействия хлора с раствором щелочи будут различны в зависимости от
t:
С холодным раствором щелочи образуется хлорид и гипохлорит:
Cl2 + 2KOH → KCl + KClO + H2O
С горячем раствором щелочи образуется хлорид и хлорат :
3Cl2 +6KOH →5KCl + KClO3 +3 H2O
С холодным раствором щелочи образуется хлорид и гипохлорит:
Cl2 + 2KOH → KCl + KClO + H2O
С горячем раствором щелочи образуется хлорид и хлорат :
3Cl2 +6KOH →5KCl + KClO3 +3 H2O
Слайд 24Значение окислительно-восстановительных реакций в жизни человека.
В быту: , горение газа в
плите:
СН4+ 2О2 = СО2 + 2Н2О
отбеливание ткани или бумаги перекисью водорода: 2Н2О2 = 2Н2О + О2 .
стирка и выведение пятен на одежде :
2HClO = 2HCl + O2
Процесс дезинфекции ванн и других предметов также основан на этом принципе: Са(ClO)2 + СО2 + Н2О = СаСО3 + 2 HClO
СН4+ 2О2 = СО2 + 2Н2О
отбеливание ткани или бумаги перекисью водорода: 2Н2О2 = 2Н2О + О2 .
стирка и выведение пятен на одежде :
2HClO = 2HCl + O2
Процесс дезинфекции ванн и других предметов также основан на этом принципе: Са(ClO)2 + СО2 + Н2О = СаСО3 + 2 HClO
Слайд 25Значение окислительно-восстановительных реакций в природе.
Извержение вулкана,
2H2S + O2 = 2H2O+
2S
образование озона вовремя грозы, окисление азота при образовании молнии,
N2+ O2 = 2 NO 2NO + O2—2NO2
процессы фотосинтеза и дыхания,
6CO2 + 6H2O = C6H12O6 + 6O2
образование озона вовремя грозы, окисление азота при образовании молнии,
N2+ O2 = 2 NO 2NO + O2—2NO2
процессы фотосинтеза и дыхания,
6CO2 + 6H2O = C6H12O6 + 6O2
Слайд 26
Значение окислительно-восстановительных реакций в медицине
.
Отвердевание пломбы, отбеливание зубов и даже простое
обеззараживание ран раствором перманганата калия– все это окислительно– восстановительные реакции.
2KMnO4 =K2MnO4 + MnO2+ O2
2KMnO4 =K2MnO4 + MnO2+ O2
Слайд 27
Значение окислительно-восстановительных реакций в исскустве
.
Со временем краски, которыми написаны картины стареют
и чернеют. На картинных рамах, появляется зеленый налет из-за окисления меди.
Тогда реставраторы используют окислительно– восстановительные свойства пероксида водорода и возвращают первоначальный вид произведениям искусства.
PbS + 4Н2О2 = 4Н2О + PbSO4
Тогда реставраторы используют окислительно– восстановительные свойства пероксида водорода и возвращают первоначальный вид произведениям искусства.
PbS + 4Н2О2 = 4Н2О + PbSO4
Слайд 28
Значение окислительно-восстановительных реакций В технике
.
Сгорание топлива в двигателе самолетов, автомобилей, моторных
лодок и т.д.-это окислительно- восстановительный процесс.
2С8Н18 + 25О2 = 16СО2 + 18Н2О
Работа обыкновенной батарейки, аккумулятора ничто иное как окислительно-восстановительная реакция
.Fe+ CuSO4 = FeSO4 + Cu
2С8Н18 + 25О2 = 16СО2 + 18Н2О
Работа обыкновенной батарейки, аккумулятора ничто иное как окислительно-восстановительная реакция
.Fe+ CuSO4 = FeSO4 + Cu
Слайд 29
Вывод: окислительно—восстановительные процессы лежат в основе жизнеобеспечения всех живых организмов
и значительно облегчают жизнь человека в современном мире.
Слайд 30Закрепление
Укажите ОВР: а) PH₃
+ 2O₂ = H₃PO₄
б) KOH + HCl = KCl + H₂O
в) CO₂ + CaO = CaCO₃
г) P₂O₅ + H₂O = 2HPO₃
ОТВЕТ: А
Укажите какие процессы происходят:
а) N⁰₂ - 4e→ 2N⁺²
б) S⁺⁶ + 2e→ S⁺⁴
в) Fe⁰ - 3e→ Fe⁺³
г) P⁺³ + 2e→ P⁺⁵
ОТВЕТ: а, в - окисление; б, г - восстановление
б) KOH + HCl = KCl + H₂O
в) CO₂ + CaO = CaCO₃
г) P₂O₅ + H₂O = 2HPO₃
ОТВЕТ: А
Укажите какие процессы происходят:
а) N⁰₂ - 4e→ 2N⁺²
б) S⁺⁶ + 2e→ S⁺⁴
в) Fe⁰ - 3e→ Fe⁺³
г) P⁺³ + 2e→ P⁺⁵
ОТВЕТ: а, в - окисление; б, г - восстановление
Слайд 31 Тест:
В кислой среде KMnO4 восстанавливается до:
соль Mn+2
MnO2
K2MnO4
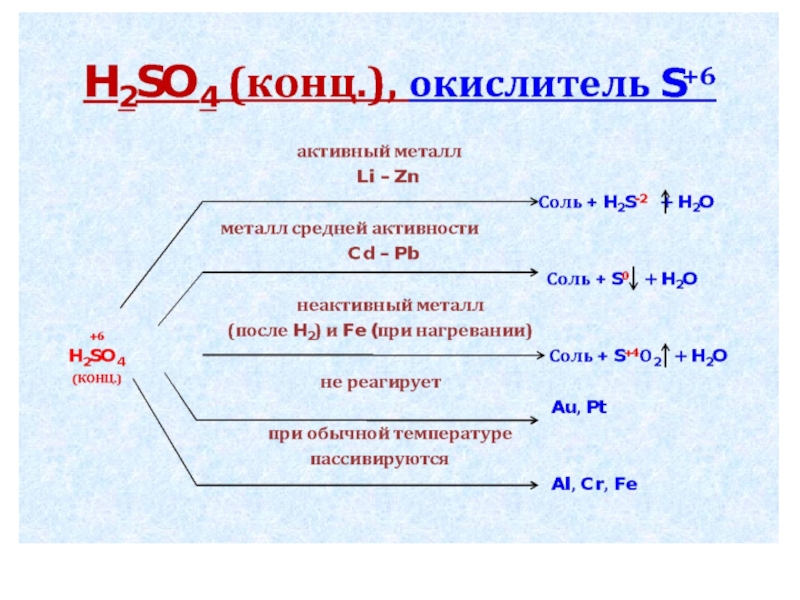
Концентрированная H2SO4 при обычной температуре пассивирует:
Zn
Сu
AI
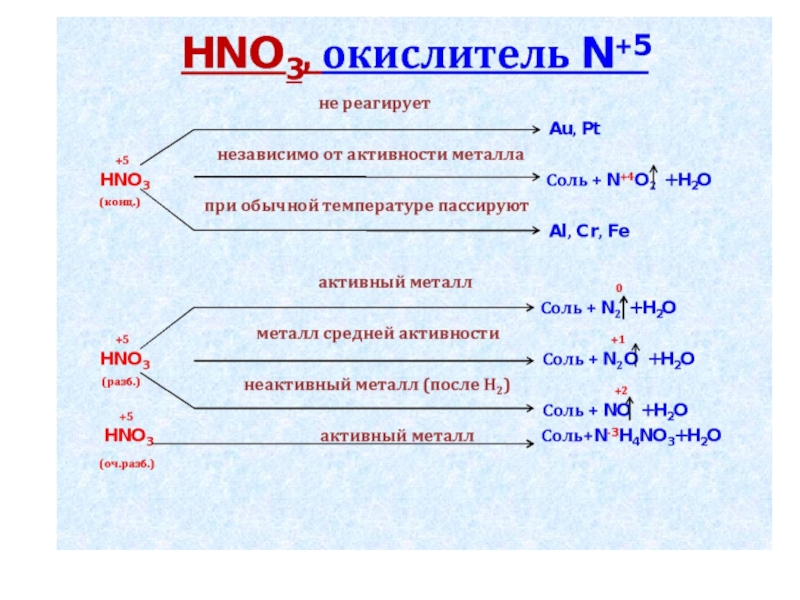
Концентрированная HNO3 не реагирует с металлом:
Ca
Au
Mg
Разбавленная HNO3 с активными металлами восстанавливается до:
NO
N2
N2O
Какой продукт восстановления KMnO4 пропущен: 2KMnO4 + 3K2SO 3 + H2O = + 3K2SO4 + 2KOH
MnO2
2MnSO4
K2MnO4
(взаимопроверка тестов в парах)
Слайд 32
домашнее задание
Используя схемы, данные на уроке, закончите уравнения реакций и расставьте
в них коэффициенты методом электронного баланса:
AI + H2SO4 (конц.) →
Ag + HNO3 (конц.) →
KBr + KMnO4 + H2SO4 → …….. + Br2 + K2SO4 + H2O
AI + H2SO4 (конц.) →
Ag + HNO3 (конц.) →
KBr + KMnO4 + H2SO4 → …….. + Br2 + K2SO4 + H2O