- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Кислородосодержащие соединения азота
Содержание
- 1. Презентация Кислородосодержащие соединения азота
- 2. Виды оксидов азотаN2O
- 3. Оксид азота (I) N2O N2O – оксид
- 4. Оксид азота (II)NO – оксид азота (II)
- 5. Оксид азота (III)N2O3 (азотистый ангидрид)– оксид азота
- 6. Оксид азота (IV)NO2 – оксид азота (IV)
- 7. Оксид азота (V)N2O5 – оксид азота (V),
- 8. НАЗОВИТЕ КИСЛОТЫ, ОБРАЗУЕМЫЕ АЗОТОМ И СРАВНИТЕ ИХ СВОЙСТВА
- 9. Азотная кислота. HNO3 Азотная кислота –
- 10. Задание. Составьте уравнения реакций по схемам.HNO3 + Mg(OH)2—HNO3 + MgO—HNO3 + Na2CO3—HNO3 + K2SiO3 —
- 11. Проверьте уравнения2HNO3 + Mg(OH)2 → Mg(NO3)2+2H2O2HNO3 +
- 12. Особенности взаимодействия азотной кислоты с металлами.Выделяются разнообразные
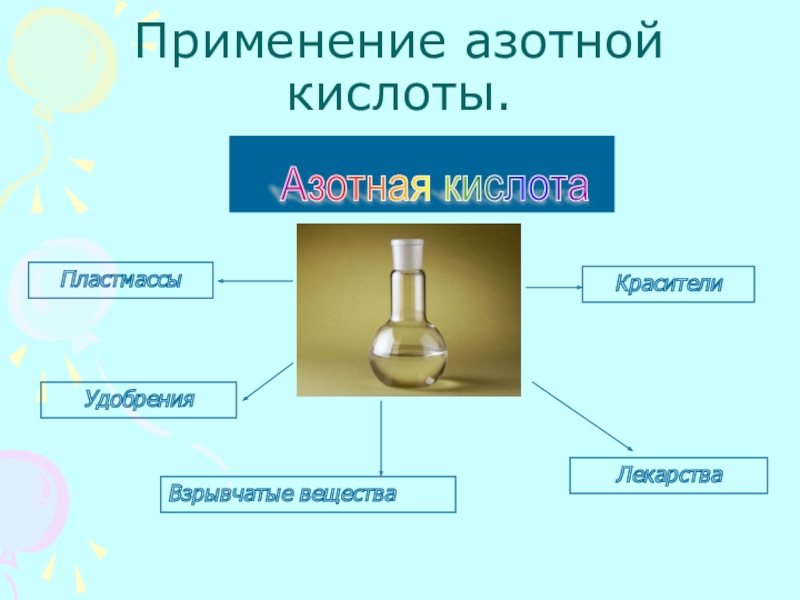
- 13. Применение азотной кислоты.Азотная кислота УдобренияВзрывчатые веществаКрасителиЛекарстваПластмассы
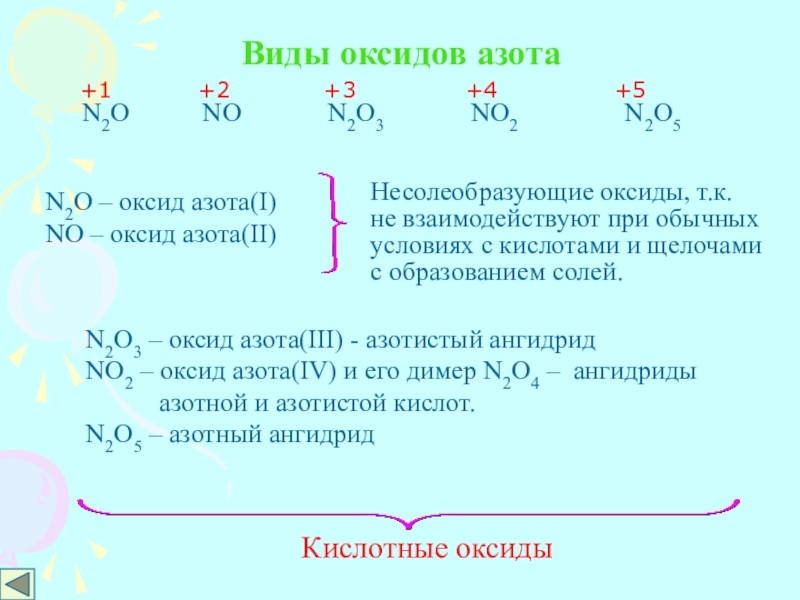
Слайд 2Виды оксидов азота
N2O NO
+1 +2 +3 +4 +5
N2O – оксид азота(I)
NO – оксид азота(II)
Несолеобразующие оксиды, т.к.
не взаимодействуют при обычных
условиях с кислотами и щелочами
с образованием солей.
N2O3 – оксид азота(III) - азотистый ангидрид
NO2 – окcид азота(IV) и его димер N2O4 – ангидриды
азотной и азотистой кислот.
N2O5 – азотный ангидрид
Кислотные оксиды
Слайд 3Оксид азота (I) N2O
N2O – оксид азота (I), закись азота или
Физические свойства: газ, без цвета и запаха. Проявляет окислительные свойства, легко разлагается. Несолеобразующий оксид.
Химические свойства.
1. Разлагается при 7000С с образованием кислорода:
2N2O = 2N2 + O2
Поэтому поддерживает горение и является окислителем.
2. С водородом:
N2O + H2 = N2 + H2O
Слайд 4Оксид азота (II)
NO – оксид азота (II) бесцветный газ, термически устойчивый,
Химические свойства.
Очень реакционноспособное вещество. Может проявлять и окислительные и восстановительные свойства.
1. При обычной температуре окисляется кислородом
воздуха: 22NO + O2 = 2NO2
2. Восстановитель:
NO + NO2 = N2O3
2NO + Cl2 = 2NOCl (нитрозилхлорид)
3. Окислитель:
2NO + 2SO2 = 2SO3 + N2
2NO + 2Н2 = N2 + 2Н2О (2000С)
2NO + 2Cu = N2 + 2CuO (5000С)
2NO + 2H2S = N2 + 2S + 2Н2О (3000С)
Слайд 5Оксид азота (III)
N2O3 (азотистый ангидрид)– оксид азота (III) жидкость темно-синего цвета,
Слайд 6Оксид азота (IV)
NO2 – оксид азота (IV) или диоксид азота, бурый
Проявляет все свойства кислотных оксидов
NO2 + H2O =
Слайд 7Оксид азота (V)
N2O5 – оксид азота (V), азотный ангидрид, белое твердое
Продуктом реакции между кислотным
оксидом и водой является кислота
Слайд 9Азотная кислота.
HNO3
Азотная кислота – бесцветная гигроскопичная жидкость, имеет резкий
4HNO3=4NO2+2H2O+O2
Слайд 10Задание. Составьте уравнения реакций по схемам.
HNO3 + Mg(OH)2—
HNO3 + MgO—
HNO3 +
HNO3 + K2SiO3 —
Слайд 11Проверьте уравнения
2HNO3 + Mg(OH)2 → Mg(NO3)2+2H2O
2HNO3 + MgO → Mg(NO3)2+2H2O
2HNO3 +
2HNO3 + K2SiO3 → КNO3+ H2SiO3
Слайд 12Особенности взаимодействия азотной кислоты с металлами.
Выделяются разнообразные соединения азота - NO2,
С азотной кислотой реагируют металлы, стоящие до и после водорода в ряду активности.