- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку в 7 классе по теме Оксиды. Классификация. Получение и применение
Содержание
- 1. Презентация к уроку в 7 классе по теме Оксиды. Классификация. Получение и применение
- 2. Составление формулы оксида1.Запишите знак химического элемента с
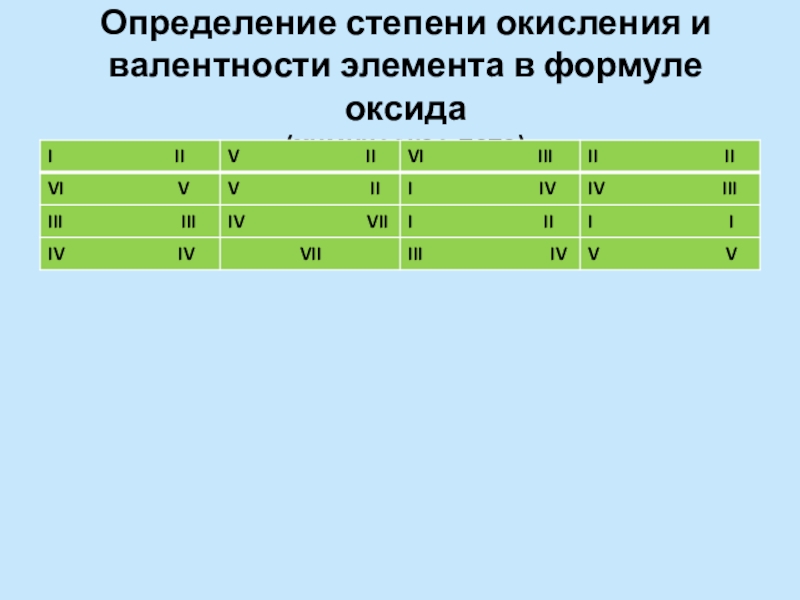
- 3. Определение степени окисления и валентности элемента в формуле оксида (химическое лото)
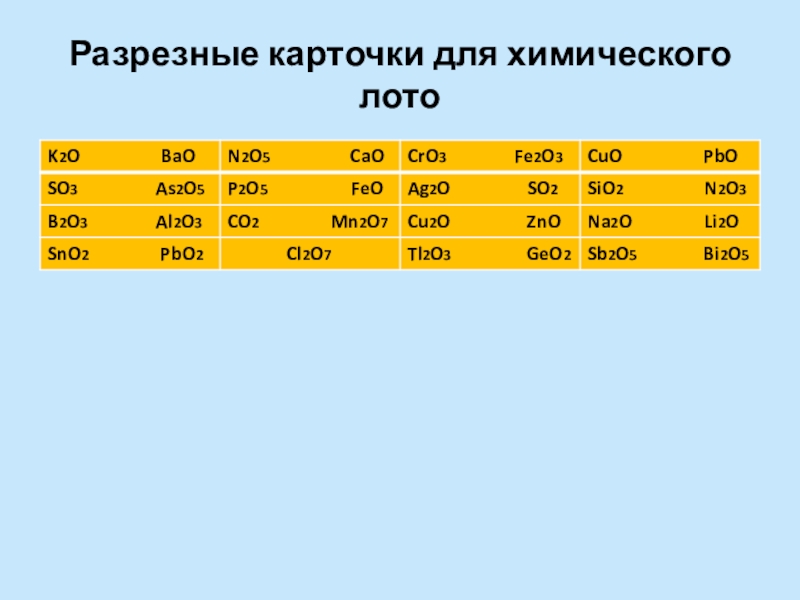
- 4. Разрезные карточки для химического лото
- 5. Слайд 5
- 6. Химические свойстваосновных оксидовCO2 + CaO=ZnO+ H2 SO4
- 7. Получение оксидовZn +O2= ZnOCH4 + O2= CO2
- 8. Применение оксида железа IIIFe2O3 – оксид железа
- 9. Применение оксида железа (II, III)Fe3O4 – оксид
- 10. CaO – оксид кальция (II)– «негашеная» известь, используют в строительстве.
- 11. Применение касситерита (оловянной руды)
- 12. Применение оксида алюминияAl2O3 – оксид алюминия (III) – минерал твердый корунд – как полирующее средство.
- 13. Применение оксида кобальта(III), оксида хрома (III) и
- 14. Применение оксида кремнияSiO2 – оксид кремния (IV)
- 15. Применение оксида серы (IV) SO2 –
- 16. Применение оксида углерода (IV) CO2
- 17. Домашнее задание§ 40 р.т. стр. 132-133
Слайд 2Составление формулы оксида
1.Запишите знак химического элемента с меньшей электроотрицательностью.
2.На втором месте
3.Укажите их степени окисления.
4. Определите наименьшее общее кратное (НОК).
5. Разделите наименьшее общее кратное на степень окисления первого элемента и получите индекс.
6. Разделите наименьшее общее кратное на степень окисления второго элемента и получите индекс.
7. Запишите готовую формулу.
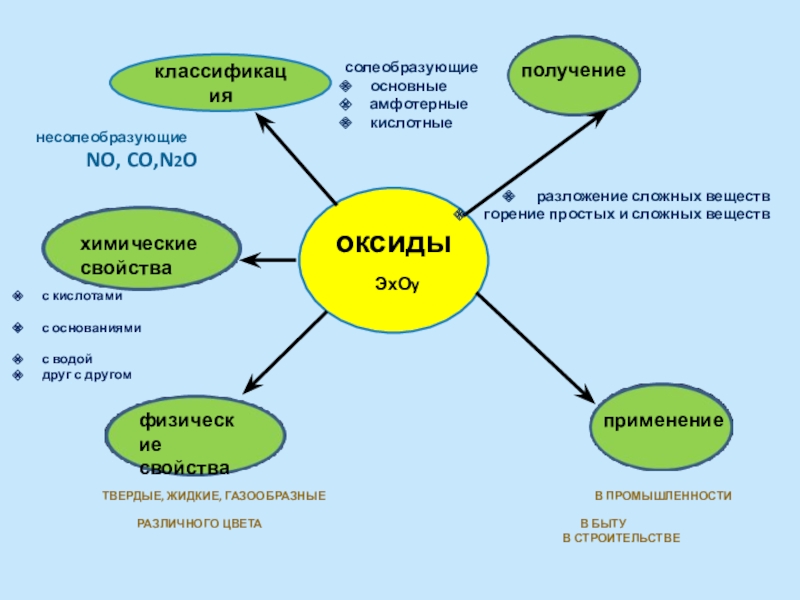
Слайд 5 Твердые, жидкие, газообразные
с кислотами
с основаниями
с водой
друг с другом
оксиды
ЭхОy
классификация
химические свойства
физические
свойства
получение
применение
несолеобразующие
NO, CO,N2O
солеобразующие
основные
амфотерные
кислотные
разложение сложных веществ
горение простых и сложных веществ
Слайд 6Химические свойства
основных оксидов
CO2 + CaO=
ZnO+ H2 SO4 =
Na2O+ H2O=
Закончите уравнения расставьте
кислотных оксидов
CO2 + CaO=
SO3+ H2O=
Ca(OH)2+ CO2=
Закончите уравнения расставьте коэффициенты
Слайд 7Получение оксидов
Zn +O2= ZnO
CH4 + O2= CO2 + H2O
CuS + O2=
S + O2=SO2
Fe(OH)3=Fe2O3 + H2O
CaCO3= CaO + CO2
Расставьте коэффициенты в уравнениях
Слайд 8Применение оксида железа III
Fe2O3 – оксид железа (III) – темно-красного цвета
Слайд 9Применение оксида железа (II, III)
Fe3O4 – оксид железа (II, III) –
Слайд 11Применение касситерита (оловянной руды)
SnO2 – оксид
Слайд 12Применение оксида алюминия
Al2O3 – оксид алюминия (III) – минерал твердый корунд
Слайд 13Применение оксида кобальта(III), оксида хрома (III) и марганца (VII)
Для создания цветных
CO2O3 – синий цвет , Cr2O3 – зеленый цвет, MnO2 – розовый цвет
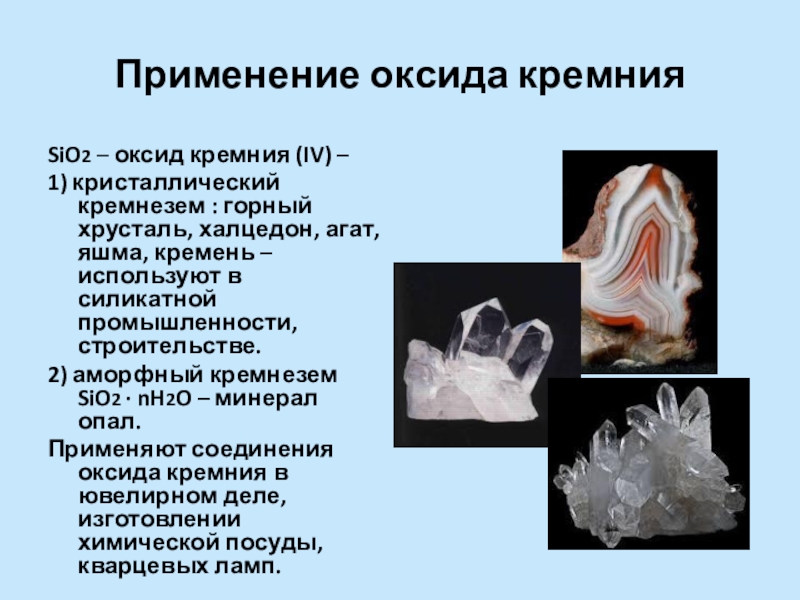
Слайд 14Применение оксида кремния
SiO2 – оксид кремния (IV) –
1) кристаллический кремнезем
2) аморфный кремнезем SiO2 ∙ nH2O – минерал опал.
Применяют соединения оксида кремния в ювелирном деле, изготовлении химической посуды, кварцевых ламп.