- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку Строение электронных оболочек атомов № 1 - 20 (8 класс)
Содержание
- 1. Презентация к уроку Строение электронных оболочек атомов № 1 - 20 (8 класс)
- 2. Вспомните! Чему равно общее количество электронов в
- 3. Запомните!Электроны, расположенные на последней электронной оболочке, называются
- 4. Проверка домашнего задания
- 5. Проверьте себя и поставьте оценку, равную количеству
- 6. «Строение электронных оболочек атомов химических элементов»
- 7. «Строение электронных оболочек атомов химических элементов»
- 8. Цель урока:научиться составлять электронные формулы атомов элементов
- 9. Электронная оболочкаСовокупность всех электронов в атоме, окружающих
- 10. Слайд 10
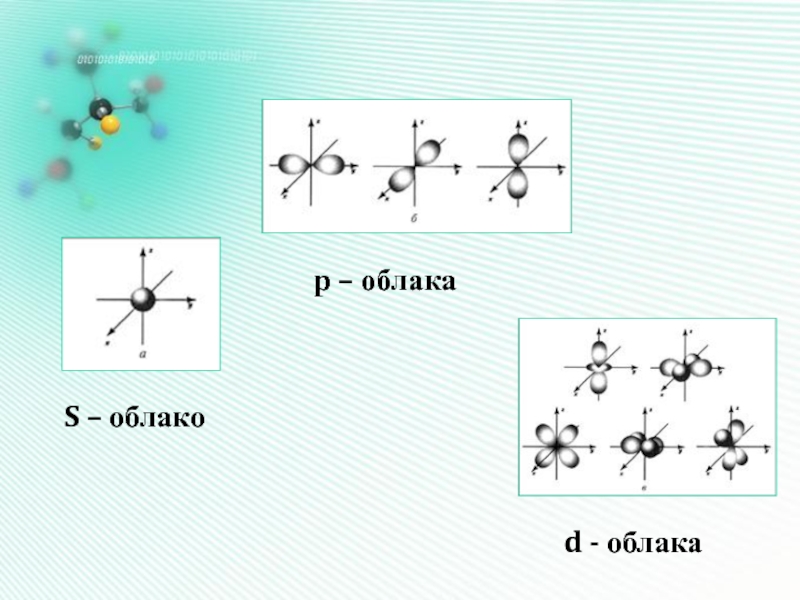
- 11. Форма электронных облаков (орбиталей)Орбиталь – это область наиболее вероят- ного местонахождения электрона в прост- ранстве
- 12. S – облако р – облака d - облака
- 13. Алгоритм составления электронных формулЗаписываем знак химического
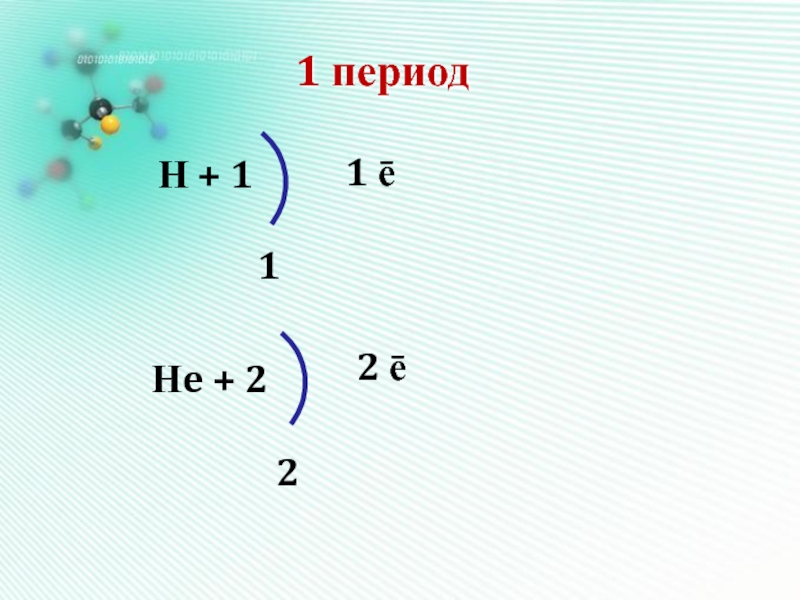
- 14. 1 периодН + 1
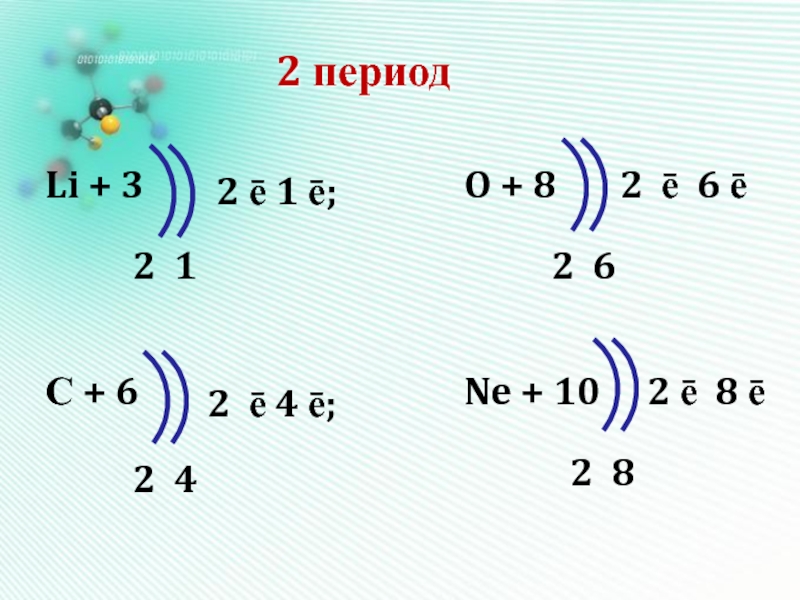
- 15. 2 периодLi + 3С + 6O +
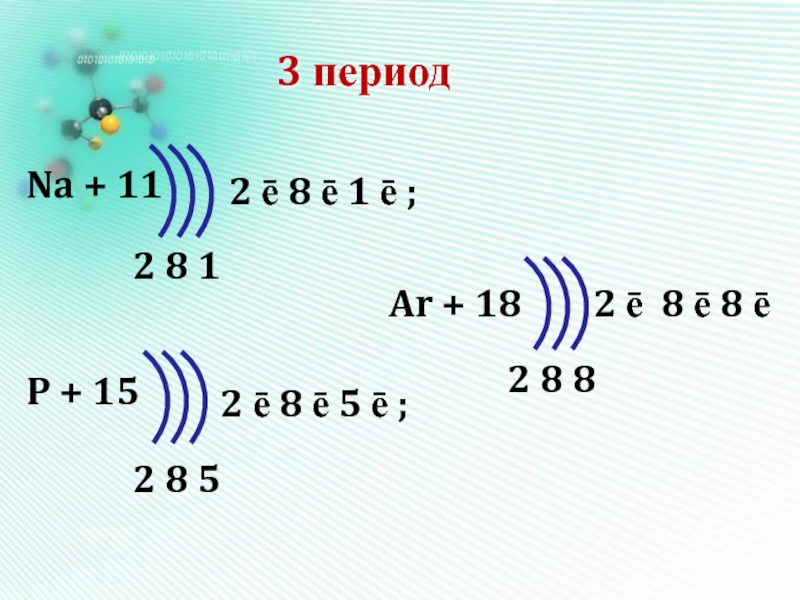
- 16. 3 периодNa + 11P + 15Ar +
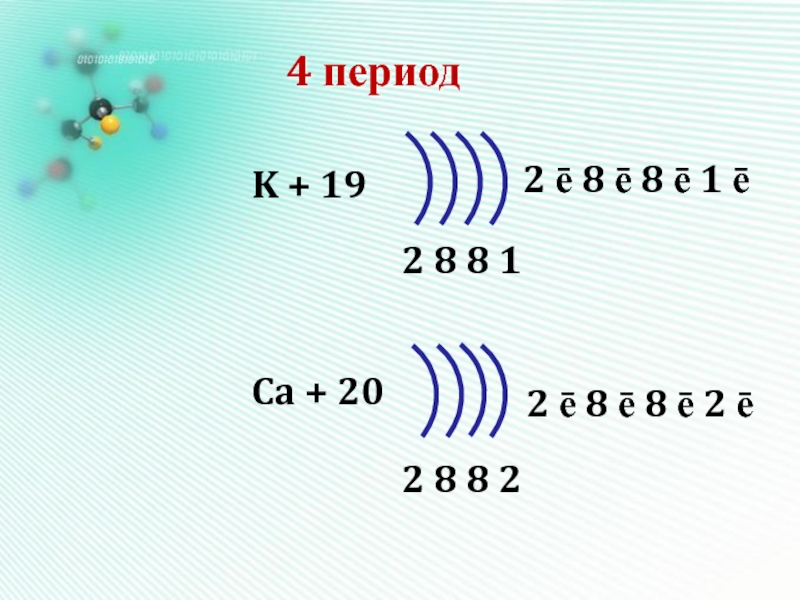
- 17. 4 периодK + 19Ca + 202
- 18. ФизкультминуткаРуки подняли и покачали – Это деревья
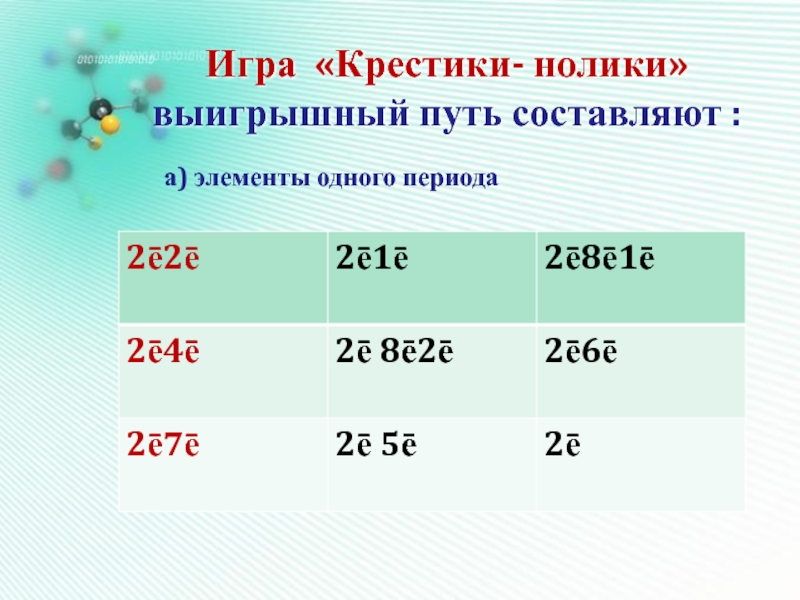
- 19. Игра «Крестики- нолики» выигрышный путь составляют :а) элементы одного периода
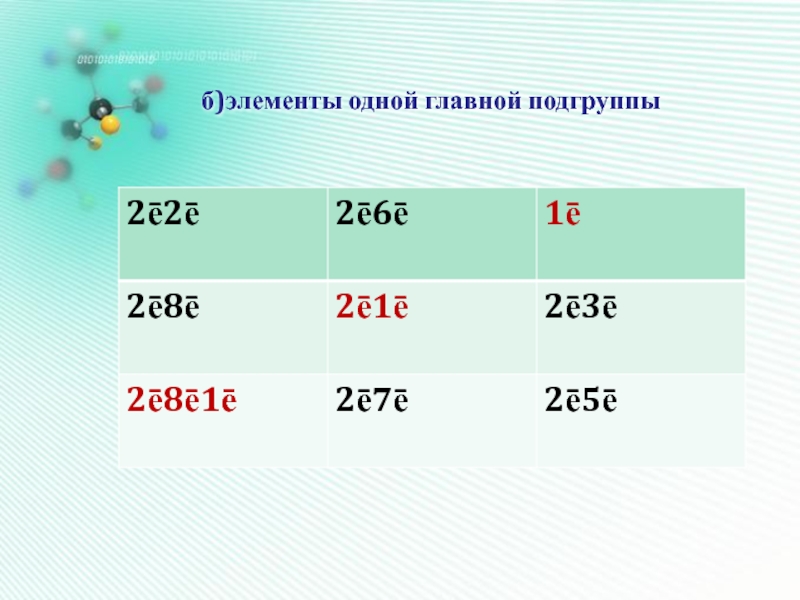
- 20. б)элементы одной главной подгруппы
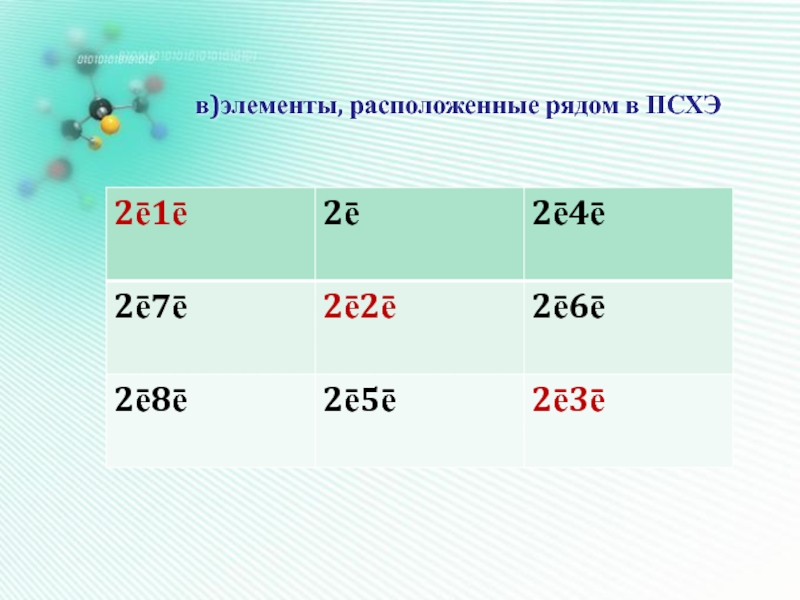
- 21. в)элементы, расположенные рядом в ПСХЭ
- 22. РефлексияЯ все понял, могу объяснить другомуПо данной теме у меня остались вопросыНедостаточно понял тему, сам ошибаюсь
- 23. Ответьте на вопросыКакие данные об особеннос-тях строения
- 24. Выводы Причина сходства элементов заключа-ется в одинаковом
- 25. Домашнее задание §40 стр. 169 – 171.Упражнение
- 26. Молодцы!Вы сегодня хорошо потрудились.Спасибо за урок!
Вспомните! Чему равно общее количество электронов в атоме? Что такое энергетический уровень? Как определить число энергетических уровней? Как определить число электронов на внешнем уровне?
Слайд 2Вспомните!
Чему равно общее количество электронов в атоме?
Что такое энергетический
уровень?
Как определить число энергетических уровней?
Как определить число электронов на внешнем уровне?
Слайд 3Запомните!
Электроны, расположенные на
последней электронной оболочке,
называются внешними
Число внешних электронов
для
химических элементов главных
подгрупп равно номеру группы, в
которой находится элемент
химических элементов главных
подгрупп равно номеру группы, в
которой находится элемент
Слайд 5Проверьте себя и поставьте оценку, равную количеству правильных
ответов:
Задание 1.
Вариант 1.
а) Al б) Li в)Ar
Вариант 2. а) С б) С l в)Н
Задание 2.
Вариант 1. а)В б)Аg
Вариант 2. а) Ga б) O
Вариант 2. а) С б) С l в)Н
Задание 2.
Вариант 1. а)В б)Аg
Вариант 2. а) Ga б) O
Слайд 8Цель урока:
научиться составлять электронные
формулы атомов элементов первых
трех периодов ПСХЭ;
объяснять зависимость и закономер-
ные изменения свойств химических
элементов от электронного строения
их атомов.
Слайд 9Электронная оболочка
Совокупность всех электронов в атоме,
окружающих ядро
Каждый электрон имеет свою
траекторию
движения и запас энергии
Электроны расположены на различном
расстоянии от ядра: чем ближе электрон к
ядру, тем он прочнее с ним связан, его труднее
вырвать из электронной оболочки
По мере удаления от ядра запас энергии
электрона увеличивается, а связь с ядром
становится слабее
движения и запас энергии
Электроны расположены на различном
расстоянии от ядра: чем ближе электрон к
ядру, тем он прочнее с ним связан, его труднее
вырвать из электронной оболочки
По мере удаления от ядра запас энергии
электрона увеличивается, а связь с ядром
становится слабее
Слайд 11Форма электронных
облаков (орбиталей)
Орбиталь – это область наиболее вероят- ного местонахождения
электрона в прост- ранстве
Слайд 13Алгоритм составления
электронных формул
Записываем знак химического элемента и
заряд ядра его
атома – он равен порядковому
номеру элемента.
Определяем количество энергетических
уровней (оно равно номеру периода) и коли-
чество электронов на каждом уровне.
Составляем электронную схему и формулу.
номеру элемента.
Определяем количество энергетических
уровней (оно равно номеру периода) и коли-
чество электронов на каждом уровне.
Составляем электронную схему и формулу.
Слайд 18Физкультминутка
Руки подняли и покачали –
Это деревья в лесу.
Руки согнули, кисти
встряхнули –
Ветер сбивает росу.
В стороны руки, плавно помашем –
Это к нам птицы летят.
Как они тихо садятся, покажем –
Крылья сложили назад.
Ветер сбивает росу.
В стороны руки, плавно помашем –
Это к нам птицы летят.
Как они тихо садятся, покажем –
Крылья сложили назад.
Слайд 22Рефлексия
Я все понял, могу объяснить
другому
По данной теме у меня остались
вопросы
Недостаточно понял тему, сам ошибаюсь
Слайд 23Ответьте на вопросы
Какие данные об особеннос-
тях строения атома отражает
электронная формула?
В
чем заключается причина
сходства элементов, расположен-
ных в одной группе?
сходства элементов, расположен-
ных в одной группе?
Слайд 24Выводы
Причина сходства элементов заключа-
ется в одинаковом строении внешних
энергетических уровней
их атомов
Одинаковое строение внешних энерге-
тических уровней периодически (т.е.
через определенные промежутки – пери-
оды) повторяется, поэтому периодически
повторяются и свойства химических эле-
ментов
Одинаковое строение внешних энерге-
тических уровней периодически (т.е.
через определенные промежутки – пери-
оды) повторяется, поэтому периодически
повторяются и свойства химических эле-
ментов
Слайд 25Домашнее задание
§40 стр. 169 – 171.
Упражнение №1, 2 стр. 171.
Составить
электронные схемы и
формулы строения атомов 2 и 3
периодов.
формулы строения атомов 2 и 3
периодов.