- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
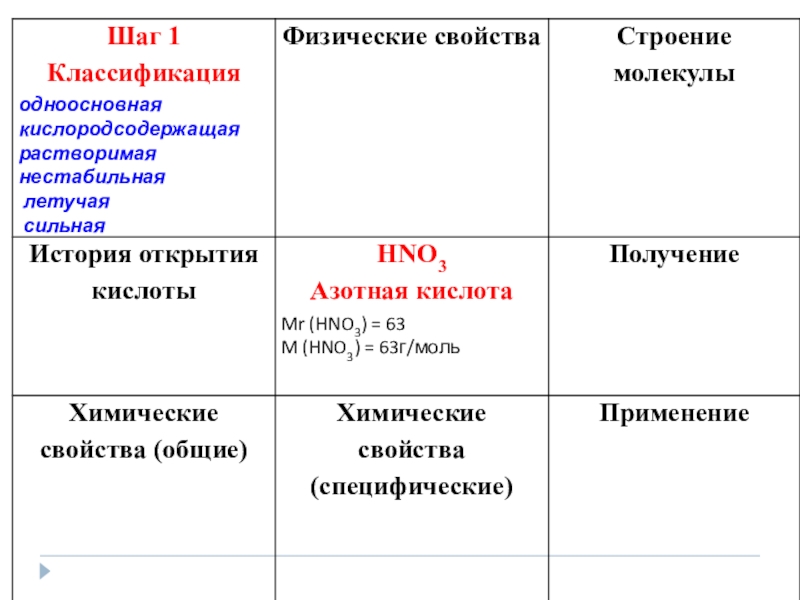
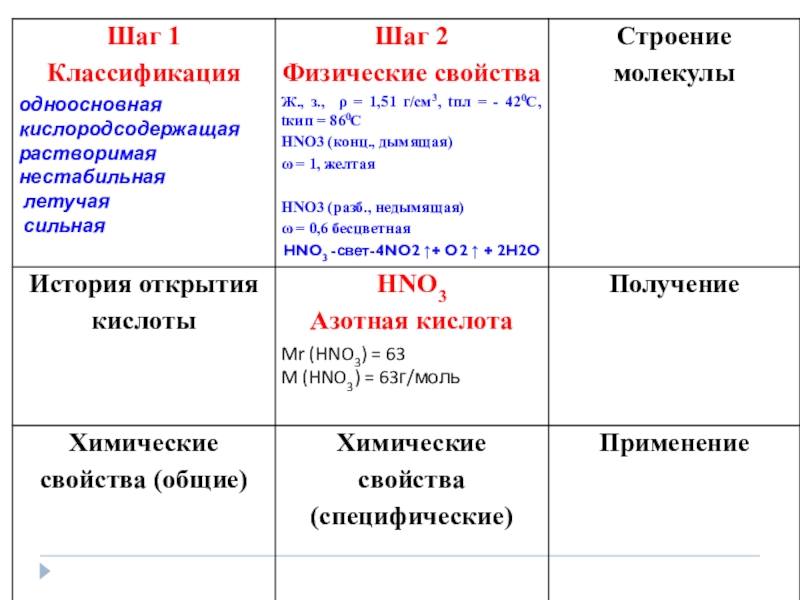
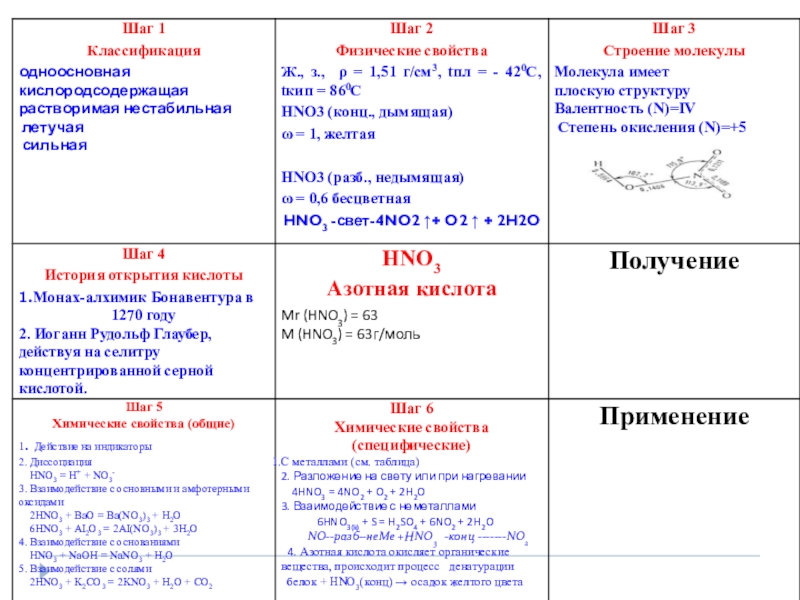
Презентация, доклад к уроку по химии на тему Ее величество Азотная кислота (9 класс) с применением работы системного оператора
Содержание
- 1. Презентация к уроку по химии на тему Ее величество Азотная кислота (9 класс) с применением работы системного оператора
- 2. «Знание только тогда знание, когда оно приобретено
- 3. Выделять СГИ (самую главную информацию);Читать между строк;Писать
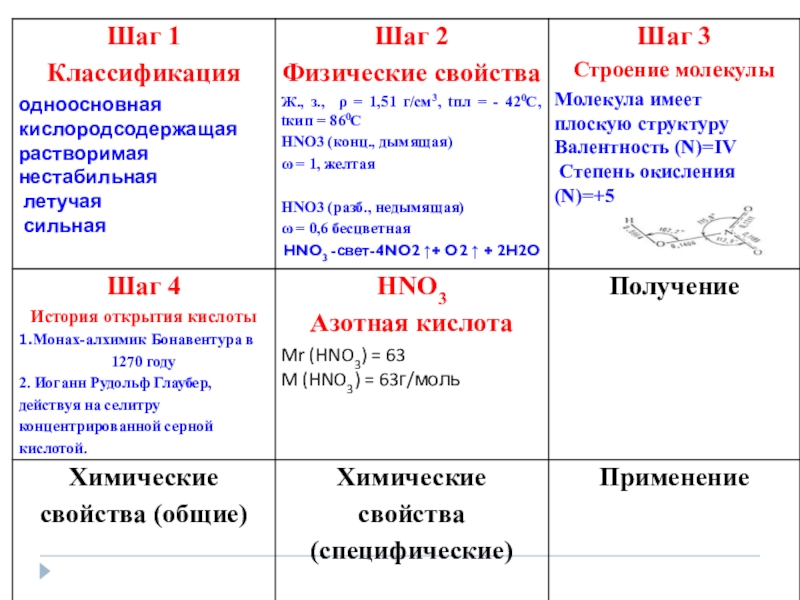
- 4. Слайд 4
- 5. Слайд 5
- 6. Слайд 6
- 7. Слайд 7
- 8. Слайд 8
- 9. Слайд 9
- 10. Слайд 10
- 11. Слайд 11
- 12. Опытным путем доказано, что двойная связь
- 13. Слайд 13
- 14. Слайд 14
- 15. Слайд 15
- 16. Слайд 16
- 17. Человек, вставай! Человек, иди! Человек, мечтай! Человек,
- 18. Слайд 18
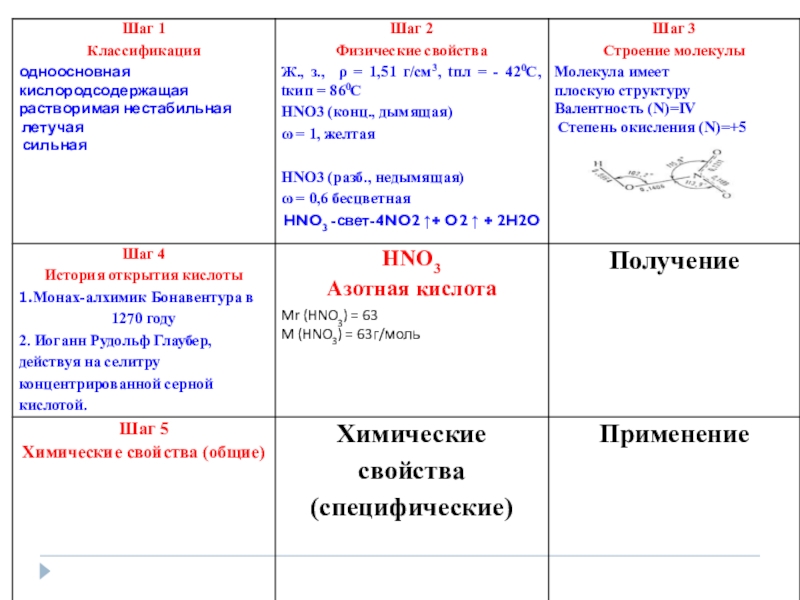
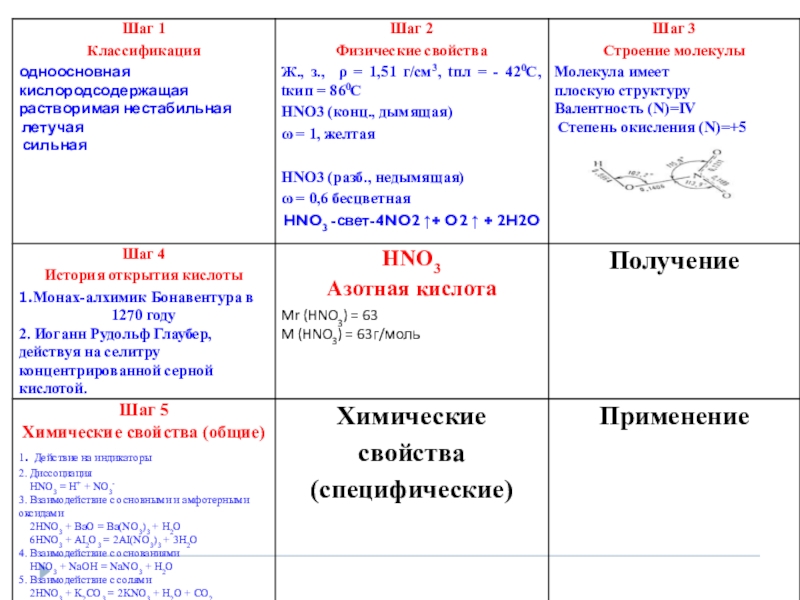
- 19. Общие с другими кислотами: Сильный электролит, хорошо
- 20. •Чтобы не подвергнуть свою жизнь опасности,
- 21. Общие с другими кислотами: 1. Сильный электролит,
- 22. Слайд 22
- 23. Слайд 23
- 24. Слайд 24
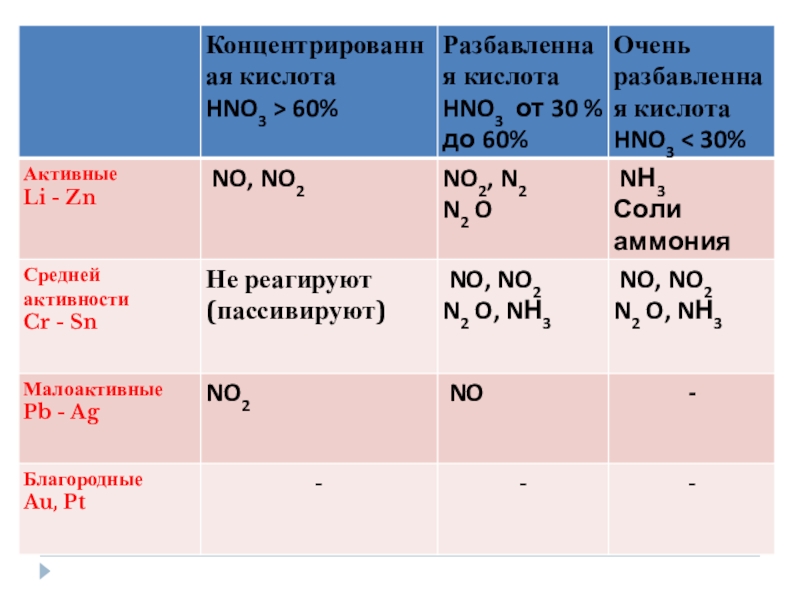
- 25. Взаимодействие с металлами:При взаимодействии с металлами образуются
- 26. Слайд 26
- 27. Слайд 27
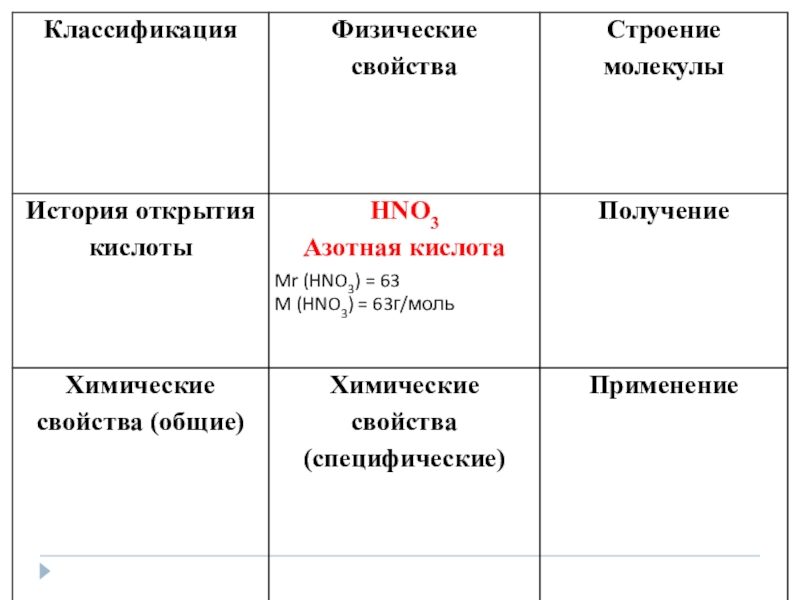
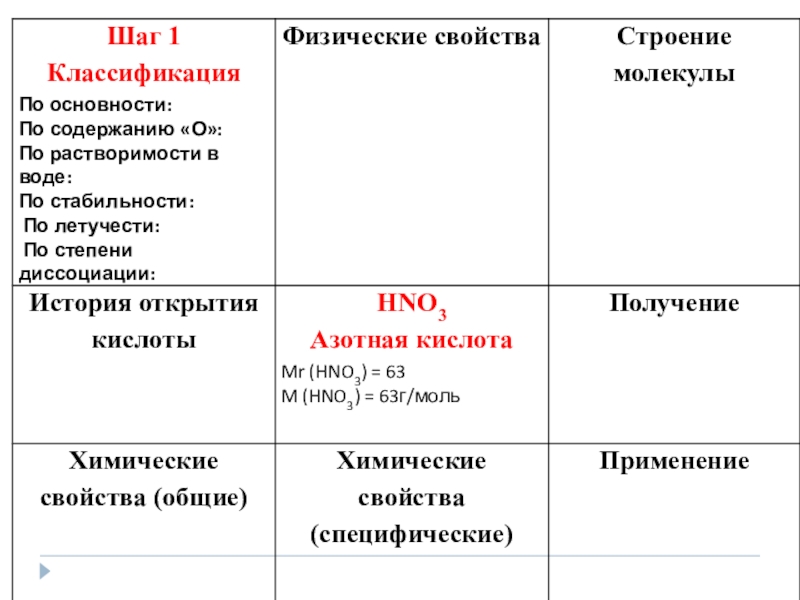
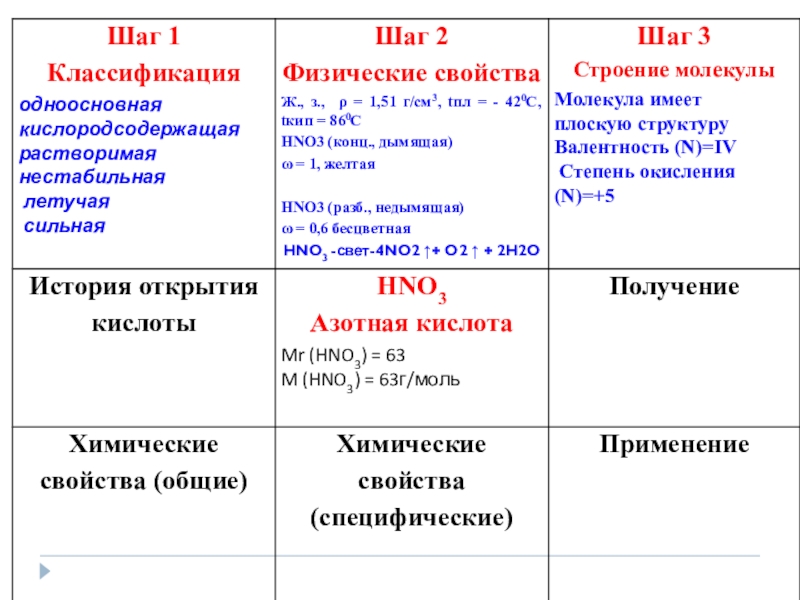
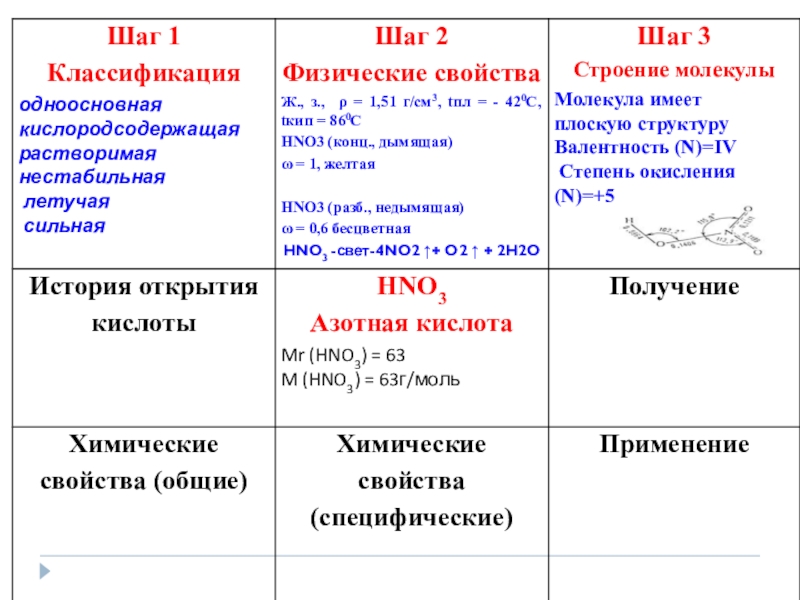
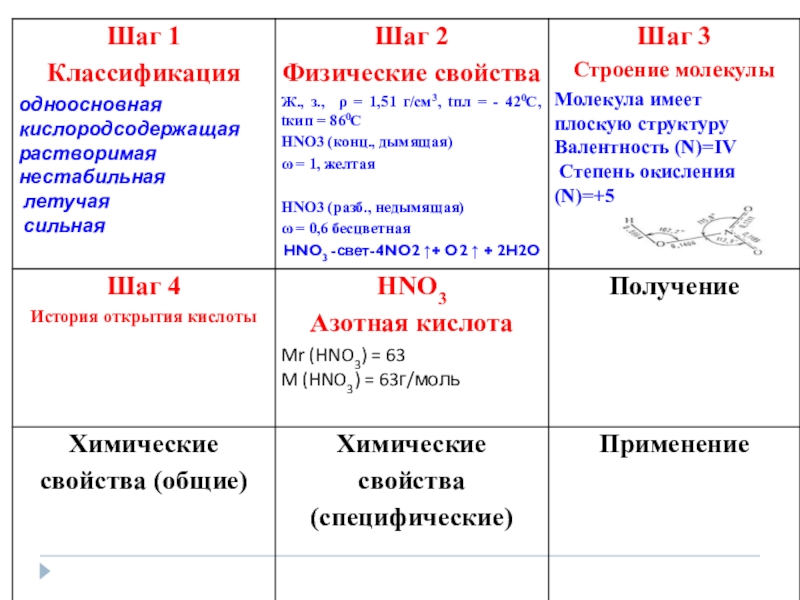
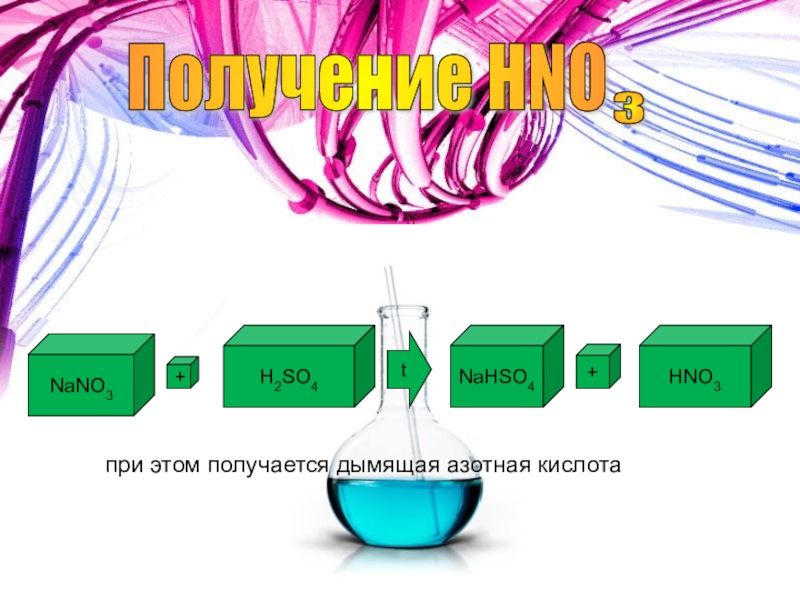
- 28. Получение HNO 3 Лабороторный способ получения:NaNO3 +H2SO4 tNaHSO4 +HNO3 при этом получается дымящая азотная кислота
- 29. Промышленный способ1. Окисления аммиaка в NO в
- 30. Слайд 30
- 31. Её величествоАзотная кислота
- 32. Это вещество было описано арабским химиком в
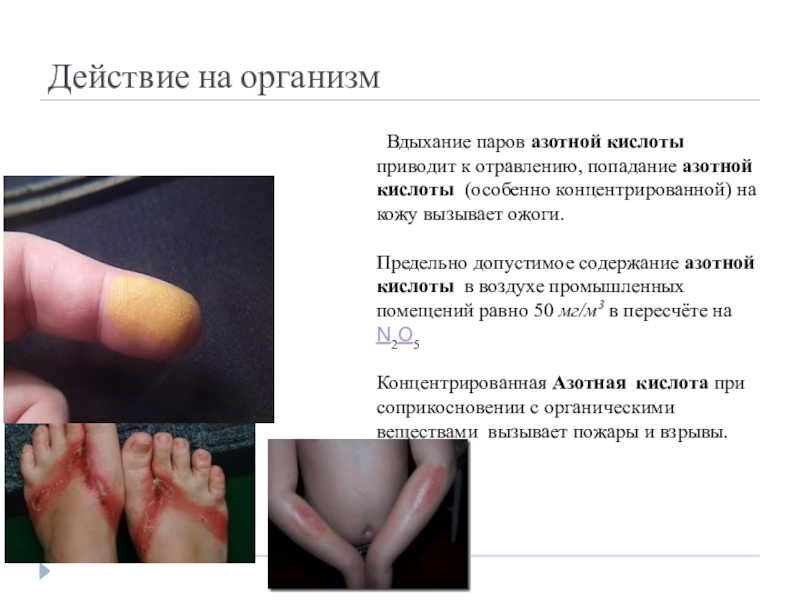
- 33. Действие на организм Вдыхание паров азотной кислоты
- 34. вывод: 1. Азотной кислоте характерны общие
- 35. Спасибо за урок
Слайд 2«Знание только тогда знание, когда оно приобретено усилиями своей мысли, а
Л. Н. Толстой
Слайд 3Выделять СГИ (самую главную информацию);
Читать между строк;
Писать «умные шпаргалки»;
Красиво оформлять свои
Убедительно доказывать;
Ловить подсказки учителя;
Слушать друг друга;
Критически оценивать себя.
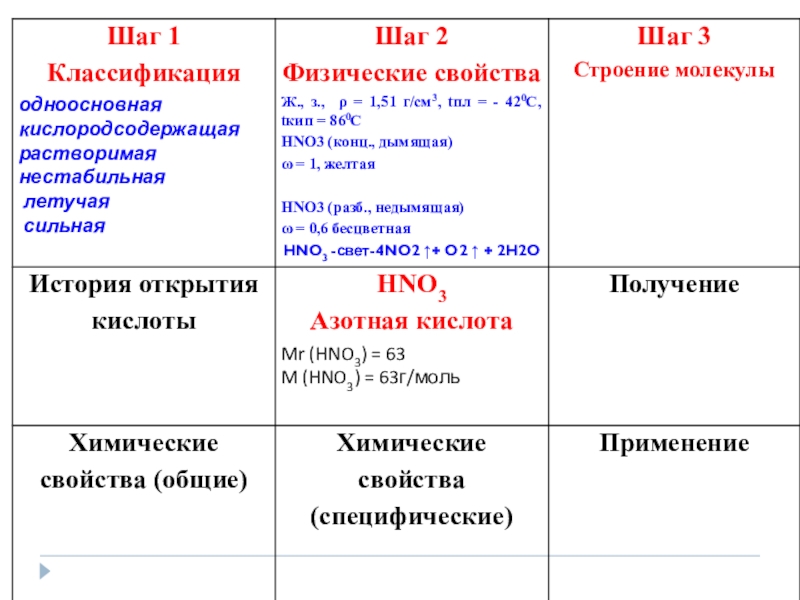
Слайд 12
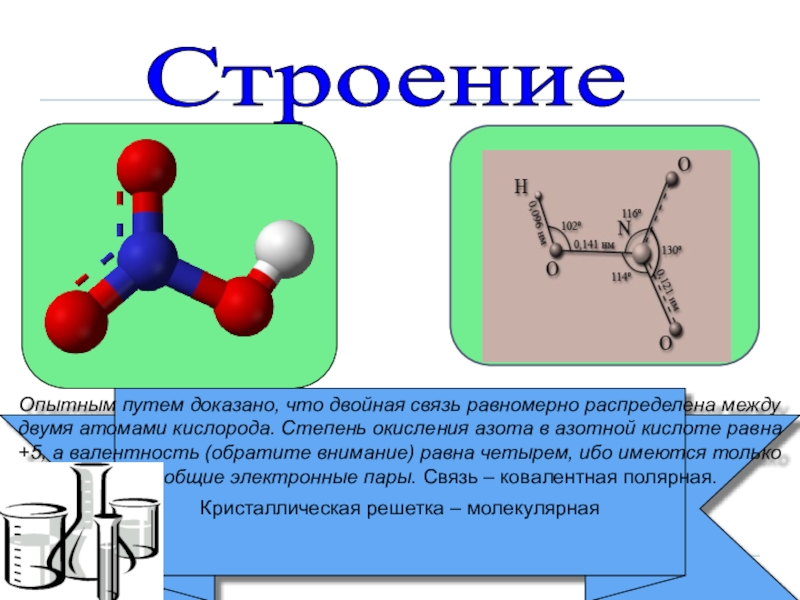
Опытным путем доказано, что двойная связь равномерно распределена между
Кристаллическая решетка – молекулярная
Строение
Слайд 17Человек, вставай! Человек, иди! Человек, мечтай! Человек, живи! Человек, смотри! Человек, ищи! Человек, дыши! Человек, люби! Вставай! Иди! Мечтай
Слайд 19Общие с другими кислотами:
Сильный электролит, хорошо диссоциируют на ионы
Реагирует с
3. Реагирует с основаниями
4. Реагирует с солями более летучих кислот
Слайд 20•Чтобы не подвергнуть свою жизнь опасности,
Надо знать технику безопасности:
•Делать
И при этом очень осторожно.
•Сначала задачу нужно решить теоретически,
Затем выполнить ее практически.
•В химической лаборатории нельзя никогда
Голыми руками брать вещества.
•Насыпать или наливать вещества необходимо аккуратно,
Не высыпать и не выливать вещества обратно.
•С химическими веществами нужно быть скупым-
Их количеством пользоваться небольшим.
•Опыты делать нужно тщательно
Над столом обязательно.
•Нельзя вдыхать пары и газы,
Если ты без противогаза.
•Вещества в лаборатории на вкус не изучаются-
Это строго настрого запрещается.
•Нельзя смешивать или сливать
Все химические вещества подряд.
•С едкими веществами (кислотами и щелочами)
Работать можно, но крайне осторожно.
•Если кислоты или щелочи на ученика попадают,
Их большим количеством воды немедленно смывают.
•Кислоту в воду добавляют-
Только так кислоту разбавляют.
•Если жидкость воспламеняется легко,
Работать с ней нужно от огня далеко.
•С приборами нагревательными
Работать нужно очень внимательно.
•На рабочем месте должен быть порядок и чистота,
Правило это необходимо выполнять всегда.
И об этом не забывать никогда.
Слайд 21Общие с другими кислотами:
1. Сильный электролит, хорошо диссоциируют на ионы
Изменяет окраску индикатора.
2. Реагирует с основными оксидами
СuO+2 HNO3 -> Cu(NO3)2 +H2O
3. Реагирует с основаниями
HNO3 + KOH -> KNO3 + H2O
4. Реагирует с солями более летучих кислот
Na2CO3 + 2HNO3 -> 2NaNO3 +H2CO3
cухая / \
H2O CO2
Слайд 25Взаимодействие с металлами:
При взаимодействии с металлами образуются нитрат, вода и третий
HNO3(р.)+Me(до H2)→нитрат+H2O+NH3(NH4NO3)
HNO3(р.)+Me(после H2)→нитрат+H2O+NO
HNO3(к.)+Me(до H2)→нитрат+H2O+N2O(N2)
HNO3(к.)+Me(после H2)→нитрат+H2O+NO2
Концентрированная HNO3 на Al, Cr, Fe,Au, Pt не действует.
Слайд 28
Получение HNO
3
Лабороторный способ получения:
NaNO3
+
H2SO4
t
NaHSO4
+
HNO3
при этом
Слайд 29Промышленный способ
1. Окисления аммиaка в NO в присутствии платино-родиевого
катализатора:
4NH3 +
3. Поглощения NO2 водой в присутствии кислорода:
4NO2 + 2H2O + O2= 4HNO3
Массовая доля HNO3 составляет около 60%
2. Окисления NO в NO2 на холоду под давлением (10 ат):
2NO + O2 = 2NO2
Слайд 32Это вещество было описано арабским химиком в VIII веке Джабиром ибн
- Благодаря этому веществу русский учёный В.Ф. Петрушевский в 1866 году впервые получил динамит.
Это вещество является компонентом ракетного топлива, его использовали для двигателя первого в мире советского реактивного самолёта БИ – 1
Это вещество – прародитель большинства взрывчатых веществ (например, тротила, или тола)
- Это вещество в смеси с соляной кислотой растворяет платину и золото, признанное «царём» металлов. Сама смесь, состоящая из 1-ого объёма этого вещества и 3-ёх объёмов соляной кислоты, называется «царской водкой».
Слайд 33Действие на организм
Вдыхание паров азотной кислоты приводит к отравлению, попадание
Предельно допустимое содержание азотной кислоты в воздухе промышленных помещений равно 50 мг/м3 в пересчёте на N2O5
Концентрированная Азотная кислота при соприкосновении с органическими веществами вызывает пожары и взрывы.
Слайд 34 вывод:
1. Азотной кислоте характерны общие свойства кислот:
реакция на
гидроксидами, солями более слабых кислот
обусловленные наличием в молекулах иона Н+;
2. Сильные окислительные свойства азотной кислоты
обусловлены строением ее молекулы;
При ее взаимодействии с металлами
никогда не образуется водород,
а образуются нитраты, оксиды азота
или другие его соединения (азот, нитрат аммония)
и вода в зависимости от концентрации кислоты и
активности металла;
3. Сильные окислительные способности HNO3
широко применяются для получения различных важных
продуктов народного хозяйства (удобрения, лекарства, пластики и т.д.)