- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку Периодический закон. Периодическая система химических элементов Д.И.Менделеева
Содержание
- 1. Презентация к уроку Периодический закон. Периодическая система химических элементов Д.И.Менделеева
- 2. Периодический закон Фундаментальный закон природы, открытый Дмитрием Ивановичем
- 3. Предпосылки возникновения закона В 1817 году немецкий
- 4. Предпосылки возникновения закона В 1863 г. Александр Эмиль де
- 5. Предпосылки возникновения закона В 1864 г Джон Ньюлендс заметил,
- 6. Предпосылки возникновения закона Д.И.Менделеев пришел к открытию закона,
- 7. Предпосылки возникновения закона На основе периодического закона Д.И.Менделеев
- 8. Слайд 8
- 9. Периодическая система химических элементов – графическое изображение периодического закона Короткая – «короткопериодная» Длинная – «длиннопериодная»Сверхдлинная
- 10. Структура «короткопериодной» периодической системы элементов Период – горизонтальный ряд
- 11. группамалый периодбольшой периода – главная подгруппаб – побочная подгруппа
- 12. Закономерности изменения свойств химических элементов и образованных
- 13. Закономерности изменения свойств химических элементов и образованных
- 14. Современная формулировка периодического закона« Свойства химических элементов,
- 15. 1. Порядковый номер элемента равен заряду ядра
- 16. Слайд 16
- 17. Спасибо за внимание! Желаю успехов!
Слайд 1Периодический закон и периодическая
система химических элементов
Дмитрия Ивановича Менделеева
Слайд 2Периодический закон
Фундаментальный закон природы, открытый Дмитрием Ивановичем Менделеевым в 1869 году при
Формулировка 1869 г:
«Свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса»
Слайд 3Предпосылки возникновения закона
В 1817 году немецкий ученый Иоганн Дёберейнер располагает
1) Li, Na, K;
2) Ca, Sr, Ba;
3) P, As, Sb;
4) S, Se, Te;
5) Cl, Br, I и т.д.
Закономерность: масса атома среднего элемента равна
среднеарифметическому из масс крайних элементов.
60 элементов расположили в 20 триад (1857 г)
Слайд 4Предпосылки возникновения закона
В 1863 г. Александр Эмиль де Шанкуртуа расположил элементы в порядке
Слайд 5Предпосылки возникновения закона
В 1864 г Джон Ньюлендс заметил, что если расположить элементы
Слайд 6Предпосылки возникновения закона
Д.И.Менделеев пришел к открытию закона, сопоставляя свойства и относительные
Слайд 7Предпосылки возникновения закона
На основе периодического закона Д.И.Менделеев исправил характеристики некоторых известных
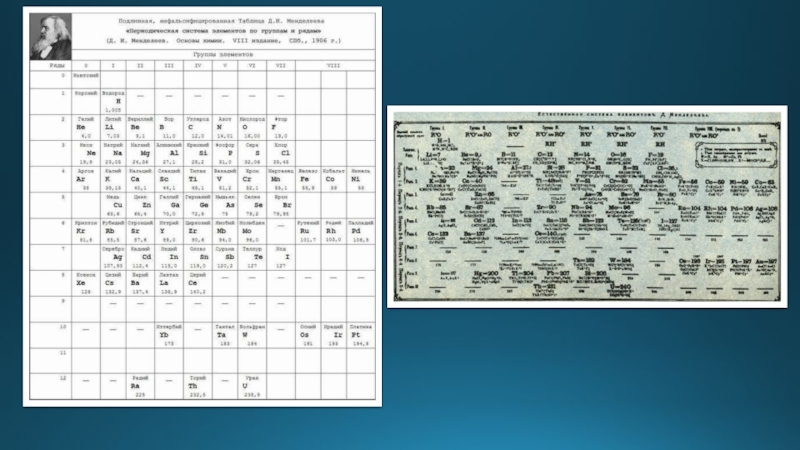
Слайд 9Периодическая система химических элементов – графическое изображение периодического закона
Короткая – «короткопериодная»
Длинная – «длиннопериодная»
Сверхдлинная
Слайд 10Структура «короткопериодной» периодической системы элементов
Период – горизонтальный ряд элементов, начинающийся щелочным металлом
Группа – вертикальный столбик элементов, имеющих хотя бы одну общую валентность. Группы делятся на главную и побочную подгруппы. Главная подгруппа – подгруппа, начинающаяся элементом малого периода, побочная подгруппа - подгруппа, начинающаяся элементом большого Символы элементов, входящих в главные и побочные подгруппы в таблице сдвинуты относительно друг друга, этим подчёркивается их различие.
Слайд 12Закономерности изменения свойств химических элементов и образованных ими простых веществ в
радиус атомов увеличивается;
восстановительные свойства элементов и образованных ими простых соединений усиливаются, окислительные свойства ослабевают;
металлические свойства простых веществ усиливаются, неметаллические ослабевают;
основный характер оксидов и гидроксидов усиливается, кислотный ослабевает;
электроотрицательность уменьшается;
количество электронов на внешнем уровне не изменяется;
заряд ядер атомов увеличивается;
атомные массы элементов увеличиваются;
число электронных слоёв в атоме увеличивается.
Слайд 13Закономерности изменения свойств химических элементов и образованных ими простых веществ в
радиус атомов уменьшается;
восстановительные свойства элементов и образованных ими простых соединений ослабевают, окислительные свойства усиливаются;
металлические свойства простых веществ ослабевают, неметаллические усиливаются;
кислотный характер оксидов и гидроксидов усиливается, основный ослабевает;
электроотрицательность увеличивается;
количество электронов на внешнем уровне увеличивается;
заряд ядер атомов увеличивается;
атомные массы элементов увеличиваются;
число электронных слоёв в атоме не изменяется.
Слайд 14Современная формулировка периодического закона
« Свойства химических элементов, а также формы и
Слайд 15 1. Порядковый номер элемента равен заряду ядра атома, а значит равен
2. Номер периода, в котором находится элемент, показывает количество электронных слоёв в атоме.
3. Номер группы показывает количество электронов на внешнем уровне (для элементов главных подгрупп). У элементов I и II групп электронами заполняется s–подуровень, поэтому они называются s–элементами. У элементов III - VIII групп происходит заполнение р-подуровня, поэтому эти элементы относятся к семейству р-элементов.
У элементов побочных подгрупп происходит заполнение электронами d–подуровня предпоследнего слоя, а у лантанидов и актинидов f- -подуровня предпредпоследнего слоя.
4. Свойства элементов определяются их строением. Элементы, имеющие на последнем слое 1 – 3 электрона являются металлическими, 4 – 8 электронов – неметаллическими.