- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии в 8 классе по теме Важнейшие классы неорганических соединений. Оксиды
Содержание
- 1. Презентация к уроку химии в 8 классе по теме Важнейшие классы неорганических соединений. Оксиды
- 2. Общая классификация веществ по составу
- 3. Простые вещества состоят из атомов
- 4. Слайд 4
- 5. Слайд 5
- 6. Слайд 6
- 7. По какому признаку солеобразующие оксиды делят на
- 8. Химические свойства основных оксидов1) Реагируют с кислотами:CuO
- 9. Химические свойства кислотных оксидов1) Реагируют с растворимыми
- 10. Способы получения оксидов1) Горение простых и сложных
- 11. Домашнее задание:Учить записи в тетрадиРаботать с §40 и ЭП к параграфуВыполнить задания №2, 4 с. 135.
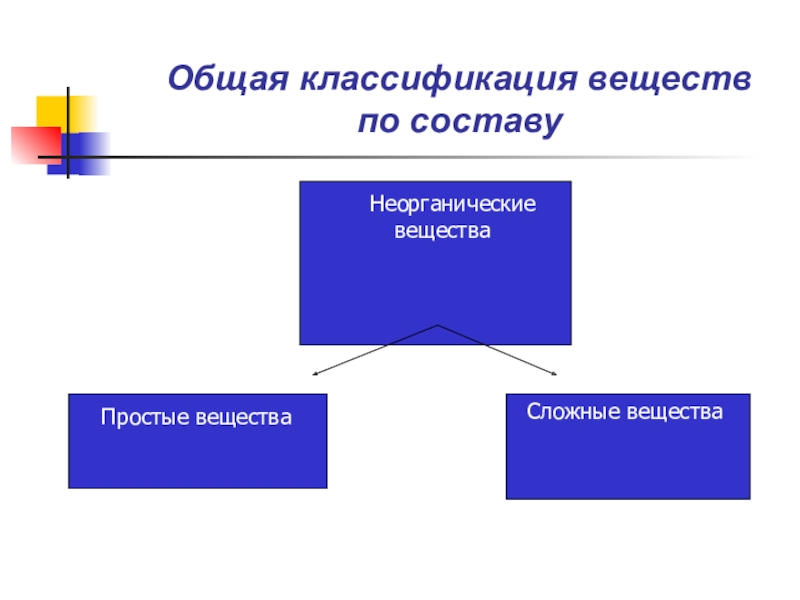
Общая классификация веществ по составу Неорганические вещества Простые веществаСложные вещества
Слайд 2Общая классификация веществ
по составу
Неорганические
вещества
Простые вещества
Сложные вещества
Слайд 3
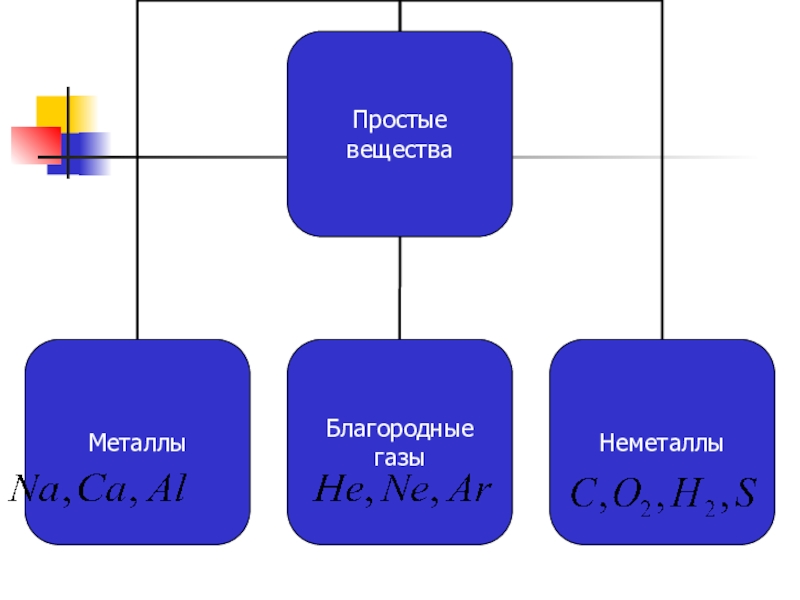
Простые вещества состоят из атомов одного химического элемента (О2,
Н2 и др.)
Сложные вещества состоят из атомов разных элементов, химически связанных друг с другом (СО2, Н2О и др.)
Сложные вещества состоят из атомов разных элементов, химически связанных друг с другом (СО2, Н2О и др.)
Слайд 6
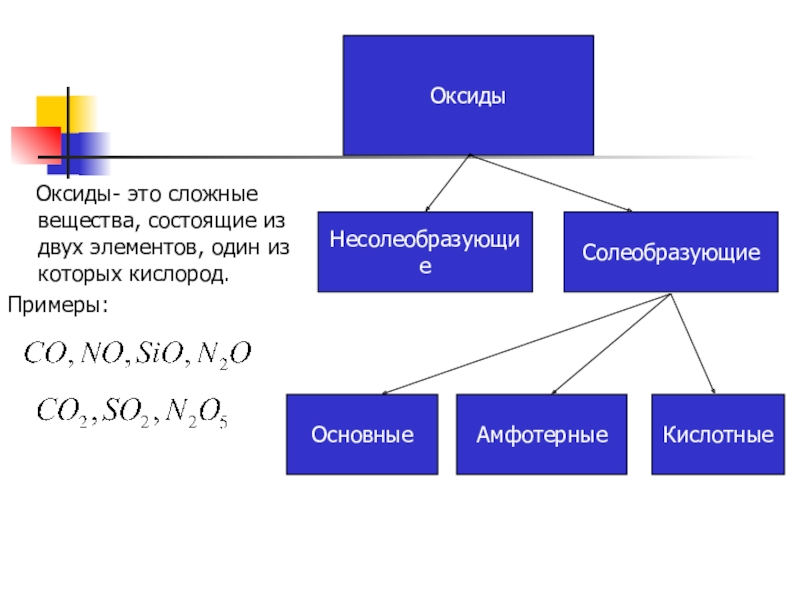
Оксиды- это сложные
вещества, состоящие из двух элементов, один из которых кислород.
Примеры:
Примеры:
Оксиды
Несолеобразующие
Солеобразующие
Основные
Амфотерные
Кислотные
Слайд 7По какому признаку солеобразующие оксиды делят на три вида?
Основной оксид —
основание – соль
Амфотерный оксид — амфотерный гидроксид – соль
Кислотный оксид – кислота – соль
Амфотерный оксид — амфотерный гидроксид – соль
Кислотный оксид – кислота – соль
Слайд 8Химические свойства основных оксидов
1) Реагируют с кислотами:
CuO + H2SO4 = CuSO4
+ H2O
2) Оксиды активных металлов реагируют с водой:
K2O + H2O → KOH
3) Реагируют с кислотными оксидами:
СаО + СО2 = СаСО3
2) Оксиды активных металлов реагируют с водой:
K2O + H2O → KOH
3) Реагируют с кислотными оксидами:
СаО + СО2 = СаСО3
Слайд 9Химические свойства кислотных оксидов
1) Реагируют с растворимыми основаниями:
СО2 + Са(ОН)2 =
СаСО3 + Н2О
2) Реагируют с водой:
SO3 + H2O = H2SO4
3) Реагируют с основными оксидами:
SO3 + CaO = CaSO4
4) Менее летучие кислотные оксиды вытесняют более летучие из их солей:
CaCO3 + SiO2 = CaSiO3 + CO2↑
2) Реагируют с водой:
SO3 + H2O = H2SO4
3) Реагируют с основными оксидами:
SO3 + CaO = CaSO4
4) Менее летучие кислотные оксиды вытесняют более летучие из их солей:
CaCO3 + SiO2 = CaSiO3 + CO2↑
Слайд 10Способы получения оксидов
1) Горение простых и сложных веществ:
С + О2 =
СО2
СН4 + О2 → СО2 + Н2О
2) Разложение сложных веществ:
а) Разложение нерастворимых оснований
Са(ОН)2 = СаО + Н2О
б) Разложение кислот
H2SO4 = H2O + SO3
в) Разложение солей
СаСО3 = СаО + СО2
СН4 + О2 → СО2 + Н2О
2) Разложение сложных веществ:
а) Разложение нерастворимых оснований
Са(ОН)2 = СаО + Н2О
б) Разложение кислот
H2SO4 = H2O + SO3
в) Разложение солей
СаСО3 = СаО + СО2
Слайд 11Домашнее задание:
Учить записи в тетради
Работать с §40 и ЭП к параграфу
Выполнить
задания №2, 4 с. 135.