- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии в 10 классе
Содержание
- 1. Презентация к уроку химии в 10 классе
- 2. ГидролизУрок в 11 классе
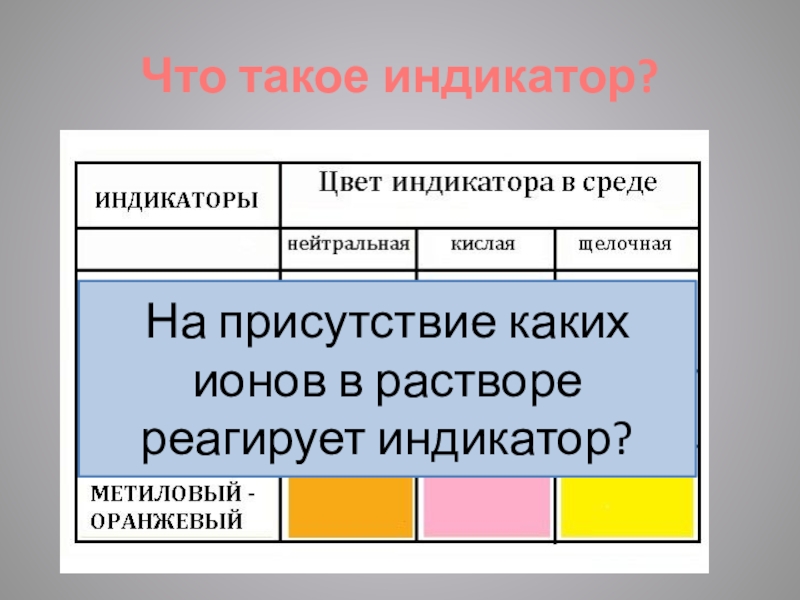
- 3. Что такое индикатор?На присутствие каких ионов в растворе реагирует индикатор?
- 4. В какой цвет окрасятся растворы:Гидроксида натрия Хлорида
- 5. Порассуждаем о теории и практике…Индикаторы указывают среду
- 6. Гидролиз- взаимодействие ионов соли с водой с образованием малодиссоциирующих электролитов.СольОСнО-вание КисЛ-ота
- 7. Типы солей
- 8. 1. Соли, образованные сильной кислотой и слабым
- 9. 2. Соли, образованные сильным основанием и слабой
- 10. 3. Соли, образованные сильным основанием и сильной
- 11. 4. Соли, образованные слабым основанием и слабой
- 12. Соль слабого основания и слабой кислоты нельзя получить реакцией обмена
- 13. Гидролиз органических соединений1) гидролиз алкоголятов – солей
- 14. В какую сторону смещается равновесие, если:Температуру понижать?Температуру повышать? Разбавлять водой?Увеличить концентрацию исходных веществ, продуктов? ←→→←→
- 15. УпражненияКакие из солей: хлорид железа (+3), сульфат
- 16. УпражненияУстановите соответствие между формулой соли и средой
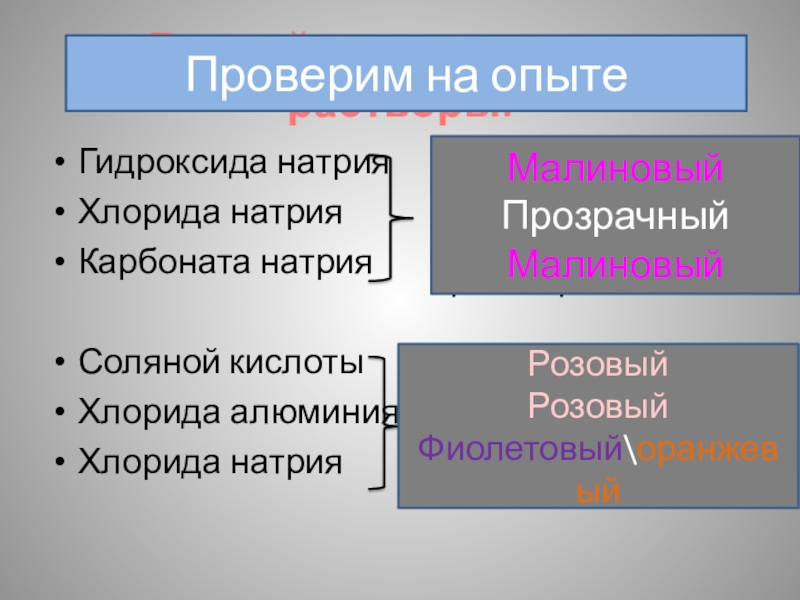
Слайд 4В какой цвет окрасятся растворы:
Гидроксида натрия
Хлорида натрия
Карбоната натрия
Соляной кислоты
Хлорида алюминия
Хлорида
При добавлении к ним фенолфталеина?
При добавлении к ним лакмуса или метилового оранжевого?
Проверим на опыте
Малиновый
Прозрачный
Малиновый
Розовый
Розовый
Фиолетовый\оранжевый
Слайд 5Порассуждаем о теории и практике…
Индикаторы указывают среду раствора.
Среда раствора определяется наличием
Запишем уравнения диссоциации всех названых веществ.
NaOH Na++ OH-
NaCl Na++Cl-
Na2CO3 2Na++CO32-
HCl H++Cl-
AlCl3Al3+ +3Cl-
Цвет изменился в 4 пробирках, а ионы Н+ и ОН- образуются при диссоциации только в двух.
В чём же причина?
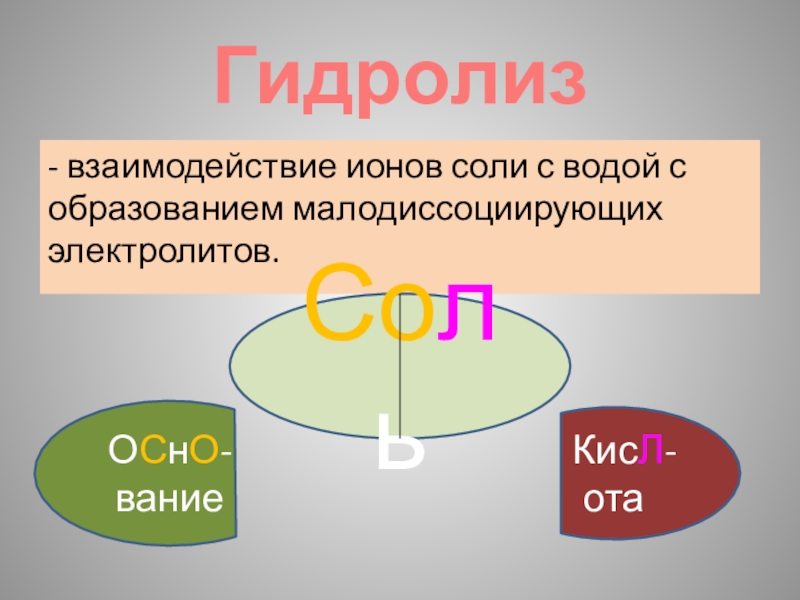
Слайд 6Гидролиз
- взаимодействие ионов соли с водой с образованием малодиссоциирующих электролитов.
Соль
ОСнО-вание
Слайд 81. Соли, образованные сильной кислотой и слабым основанием
В водном растворе происходит
AlCl3 Al 3+ + 3Cl-
H2OOH- + H+
AlCl3
HCl
Al(OH)3
Сильная кислота
Слабое основание
Al 3+ + H2O AlOH2+ +H+
AlCl3 + H2OAlOHCl2+HCl
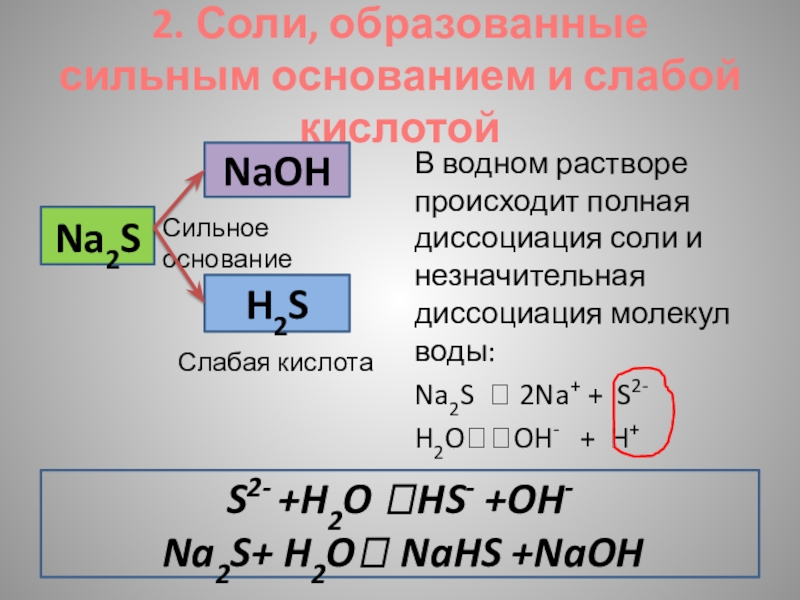
Слайд 92. Соли, образованные сильным основанием и слабой кислотой
В водном растворе происходит
Na2S 2Na+ + S2-
H2OOH- + H+
Na2S
NaOH
H2S
Сильное основание
Слабая кислота
S2- +H2O HS- +OH-
Na2S+ H2O NaHS +NaOH
Слайд 103. Соли, образованные сильным основанием и сильной кислотой
В растворе не происходит
NaCl Na+ + Cl-
H2OOH- + H+
NaCl
NaOH
HCl
Сильное основание
Сильная кислота
Среда раствора остается нейтральной!
Слайд 114. Соли, образованные слабым основанием и слабой кислотой
Соли, этого типа подвергаются
Al2S3 2Al3+ + 3S2-
H2OOH- + H+
Al2S3
Al(OH)3
H2S
Слабое основание
Слабая кислота
Al2S3 +H2OAl(OH)3 +H2S↑
Слайд 13Гидролиз органических соединений
1) гидролиз алкоголятов – солей очень слабой кислоты и
C2H5ONa + H2O ↔C2H5OH + NaOH – Q частичный гидролиз
2) гидролиз фенолятов– (фенол очень слабая кислота, соли легко гидролизуются)
C6H5ONa + H2O↔ C6H5OH + NaOH – Q
3) соли карбоновых кислот легко подвергаются гидролизу, т.к. карбоновые кислоты относятся к слабым электролитам
CH3COONa + H2O ↔CH3COOH + NaOH – Q
Каковы условия смещения равновесия гидролиза?
Слайд 14В какую сторону смещается равновесие, если:
Температуру понижать?
Температуру повышать?
Разбавлять водой?
Увеличить концентрацию
←
→
→
←
→
Слайд 15Упражнения
Какие из солей: хлорид железа (+3), сульфат натрия, карбонат лития, нитрат
Какую окраску приобретет индикатор метиловый оранжевый, если его добавить к растворам:
Сульфата алюминия;
Нитрата калия;
Карбоната натрия? Почему?
Слайд 16Упражнения
Установите соответствие между формулой соли и средой ее водного раствора:
Na2CO3
KCl Б. Кислая
FeCl3 В. Нейтральная
Li2S