- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии по теме Металлы (9 класс)
Содержание
- 1. Презентация к уроку химии по теме Металлы (9 класс)
- 2. Цель урока Обобщить и углубить знания о
- 3. Викторина «Знаете ли вы?»
- 4. 4) Металл, обеспечивающий кроветворение? 5) Металл,
- 5. Допишите предложения…Вариант 1В периодеЗаряд ядра атома … Число
- 6. Допишите предложение….Строение атомаПорядковый номер элемента показывает …Ядро
- 7. Определите способ получения металла и разновидность этого
- 8. «Самый, самый…»Самые мягкиеСамый твердыйСамый легкийСамый тяжелыйСамый легкоплавкийСамый
- 9. «Самый, самый…»Самые мягкие – щелочные металлы,Самый твердый
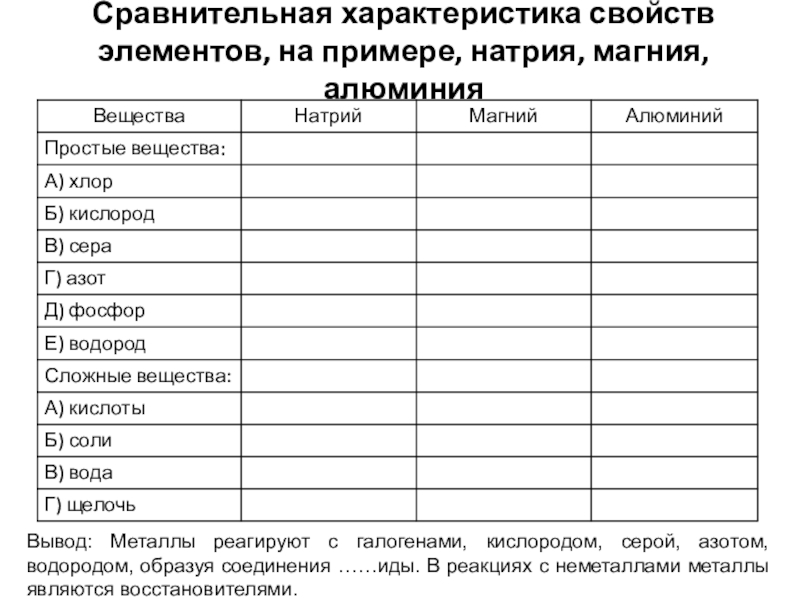
- 10. Сравнительная характеристика свойств элементов, на примере, натрия,
- 11. Домашнее заданиеПараграф 28, № 3-6 письменно на
- 12. «Другого ничего в природе
Цель урока Обобщить и углубить знания о металлах, расположенных в периодической системе элементов Д.И.Менделеева Задача урока Систематизировать знания о металлах. Развивать:- умения находить причинно-следственные связи между строением и свойствами металлов, -мыслительные операции и
Слайд 2Цель урока
Обобщить и углубить знания о металлах, расположенных в периодической
системе элементов Д.И.Менделеева
Задача урока
Систематизировать знания о металлах.
Развивать:
- умения находить причинно-следственные связи между строением и свойствами металлов,
-мыслительные операции и творческие способности.
Воспитывать:
- коммуникативность и умение
-высказывать свою точку зрения.
Задача урока
Систематизировать знания о металлах.
Развивать:
- умения находить причинно-следственные связи между строением и свойствами металлов,
-мыслительные операции и творческие способности.
Воспитывать:
- коммуникативность и умение
-высказывать свою точку зрения.
Слайд 3Викторина
«Знаете ли вы?»
1) Каких
элементов больше в периодической системе элементов Д.И.Менделеева металлов или неметаллов?
2) В какой группе расположены самые активные, щелочные металлы? Назовите их.
3) Какой металл назван в честь России?
3) Какой металл плавится на ладони рук?
2) В какой группе расположены самые активные, щелочные металлы? Назовите их.
3) Какой металл назван в честь России?
3) Какой металл плавится на ладони рук?
Слайд 4
4) Металл, обеспечивающий кроветворение?
5) Металл, усиливающий жесткость воды, входящий
в состав гигантских сосулек, свисающих с потолка пещер (сталагмитов и сталактитов), образующий меловые горы, известняки, мрамор, необходимый для строения костей, повышения мозговой деятельности ?
6) Один из самых широко известных радиоактивных металлов, применяемых на атомных электростанциях?
6) Один из самых широко известных радиоактивных металлов, применяемых на атомных электростанциях?
Слайд 5Допишите предложения…
Вариант 1
В периоде
Заряд ядра атома …
Число внешних слоев в атоме
…
Число электронов во внешнем электронном слое атома …
Радиус атома …
Металлические свойства атомов …
Число электронов во внешнем электронном слое атома …
Радиус атома …
Металлические свойства атомов …
Вариант 2
В главной подгруппе
Заряд ядра атома …
Число внешних слоев в атоме …
Число электронов во внешних электронных слоях атомов …
Радиус атома …
Металлические свойства атомов …
Слайд 6Допишите предложение….
Строение атома
Порядковый номер элемента показывает …
Ядро атома состоит из …
Число электронных слоев атома равно …
Число электронов на внешнем слое атомов элементов главных подгрупп соответствует …
Электрон – частица заряженная …
Слайд 7Определите способ получения металла и разновидность этого способа.
А) восстановление меди из
медной руды куприта (Cu2O)
Cu2O + C = 2Cu + CO (при t)
Б) восстановление хрома из оксида хрома (III)
Cr2O3 + 2Al = 2 Cr + Al2O3 (при t)
В) восстановление вольфрама из оксида вольфрама (VI)
WO3 + 3H2 = W + 3 H2O (при t)
Cu2O + C = 2Cu + CO (при t)
Б) восстановление хрома из оксида хрома (III)
Cr2O3 + 2Al = 2 Cr + Al2O3 (при t)
В) восстановление вольфрама из оксида вольфрама (VI)
WO3 + 3H2 = W + 3 H2O (при t)
Слайд 8«Самый, самый…»
Самые мягкие
Самый твердый
Самый легкий
Самый тяжелый
Самый легкоплавкий
Самый тугоплавкий
Магнитными свойствами обладают
Самый
пластичный
Самые хрупкие
Самые блестящие
Наиболее электропроводные
Самые хрупкие
Самые блестящие
Наиболее электропроводные
Слайд 9«Самый, самый…»
Самые мягкие – щелочные металлы,
Самый твердый – хром,
Самый легкий –
литий (плотность 0,53 г/см),
Самый тяжелый осмий (плотность 22,5 г/см),
Самый легкоплавкий – ртуть (температура плавления –( -38,9С),
Самый тугоплавкий – вольфрам (3420 С),
Магнитными свойствами обладают железо, никель, кобальт,
Самый пластичный – золото, медь, алюминий,
Хрупкие – висмут и марганец,
Самые блестящие – серебро, алюминий, палладий,
Наиболее электропроводные
Самый тяжелый осмий (плотность 22,5 г/см),
Самый легкоплавкий – ртуть (температура плавления –( -38,9С),
Самый тугоплавкий – вольфрам (3420 С),
Магнитными свойствами обладают железо, никель, кобальт,
Самый пластичный – золото, медь, алюминий,
Хрупкие – висмут и марганец,
Самые блестящие – серебро, алюминий, палладий,
Наиболее электропроводные
Слайд 10Сравнительная характеристика свойств элементов, на примере, натрия, магния, алюминия
Вывод: Металлы реагируют
с галогенами, кислородом, серой, азотом, водородом, образуя соединения ……иды. В реакциях с неметаллами металлы являются восстановителями.
Слайд 11Домашнее задание
Параграф 28, № 3-6 письменно на стр.131.
Написать области применения элементов
IA, IIA, IIIA групп главных подгрупп.
Слайд 12
«Другого ничего в природе нет
Ни здесь, ни там, в космических глубинах:
Все от песчинок малых до планет –
Из элементов состоит единых.
Как формула, как график трудовой,
Строй Менделеевской системы строгий.
Вокруг тебя творится, мир живой,
Входи в него, вдыхай, руками трогай».
С.Щипачев «Читая Менделеева»
Все от песчинок малых до планет –
Из элементов состоит единых.
Как формула, как график трудовой,
Строй Менделеевской системы строгий.
Вокруг тебя творится, мир живой,
Входи в него, вдыхай, руками трогай».
С.Щипачев «Читая Менделеева»