- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
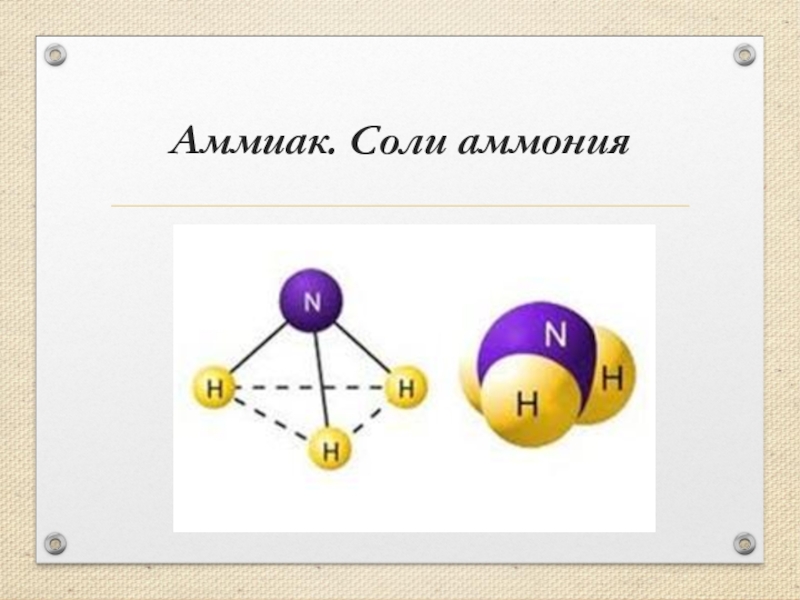
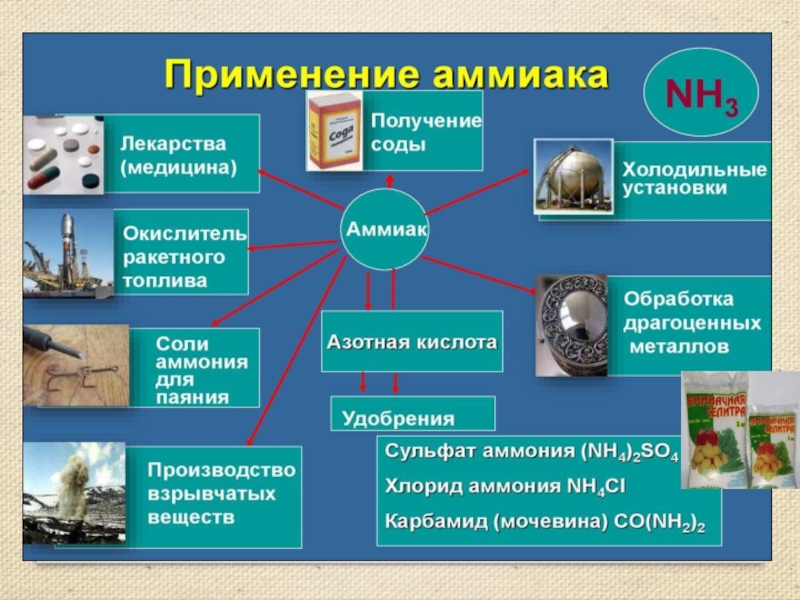
Презентация, доклад к уроку Аммиак, соли аммония
Содержание
- 1. Презентация к уроку Аммиак, соли аммония
- 2. Слайд 2
- 3. Слайд 3
- 4. Слайд 4
- 5. Слайд 5
- 6. Слайд 6
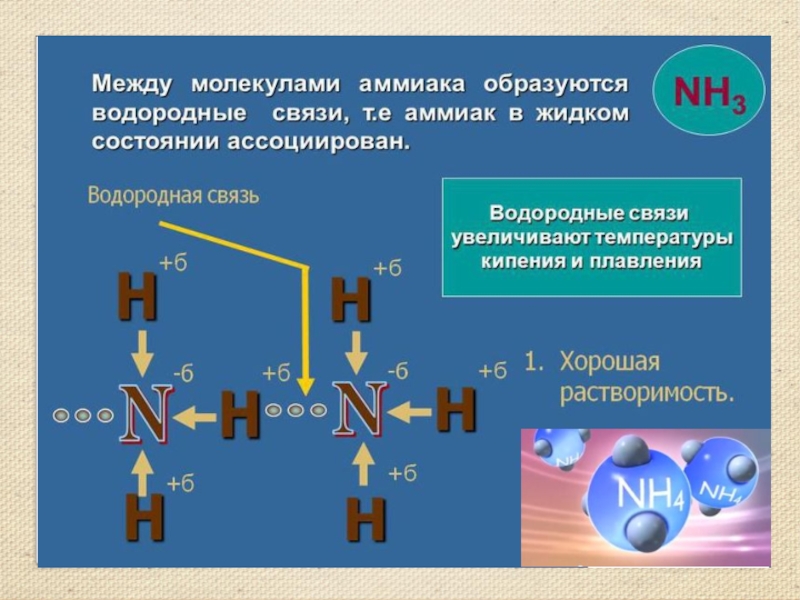
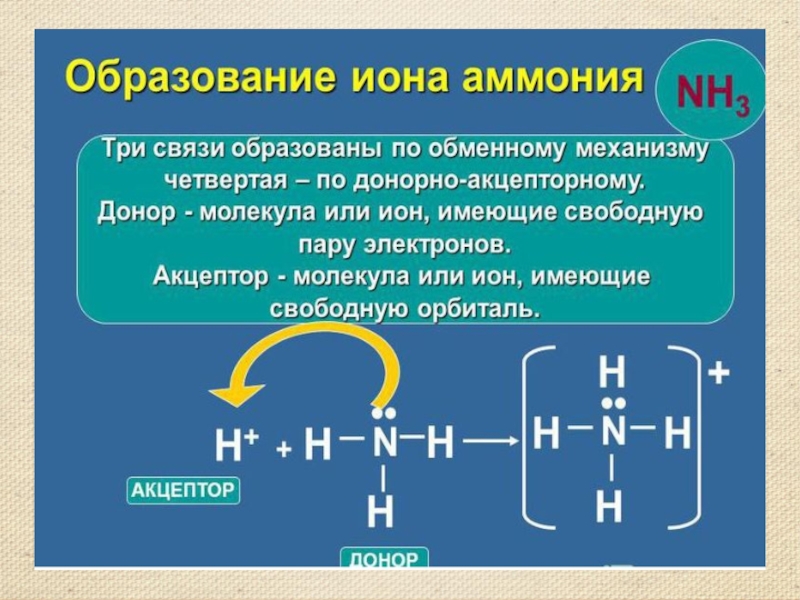
- 7. Строение молекулы аммиака. Молекулярная формула аммиака NH3
- 8. Слайд 8
- 9. Слайд 9
- 10. Слайд 10
- 11. Слайд 11
- 12. Слайд 12
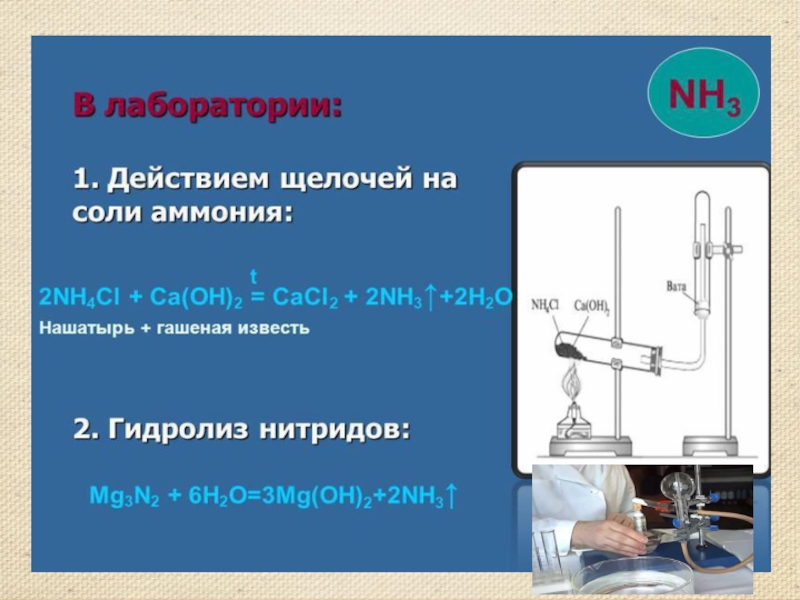
- 13. Получение аммиака Аммиак можно получить нагреванием смеси
- 14. Слайд 14
- 15. Слайд 15
- 16. Слайд 16
- 17. Химические свойства аммиака. Аммиак-восстановитель Аммиак на воздухе
- 18. Слайд 18
- 19. Слайд 19
- 20. с кислотами: Из сложных веществ аммиак реагирует
- 21. Слайд 21
- 22. Слайд 22
- 23. Слайд 23
- 24. Слайд 24
- 25. Слайд 25
- 26. Слайд 26
- 27. Слайд 27
- 28. Слайд 28
- 29. Слайд 29
- 30. Слайд 30
- 31. Слайд 31
- 32. Слайд 32
- 33. Слайд 33
- 34. Слайд 34
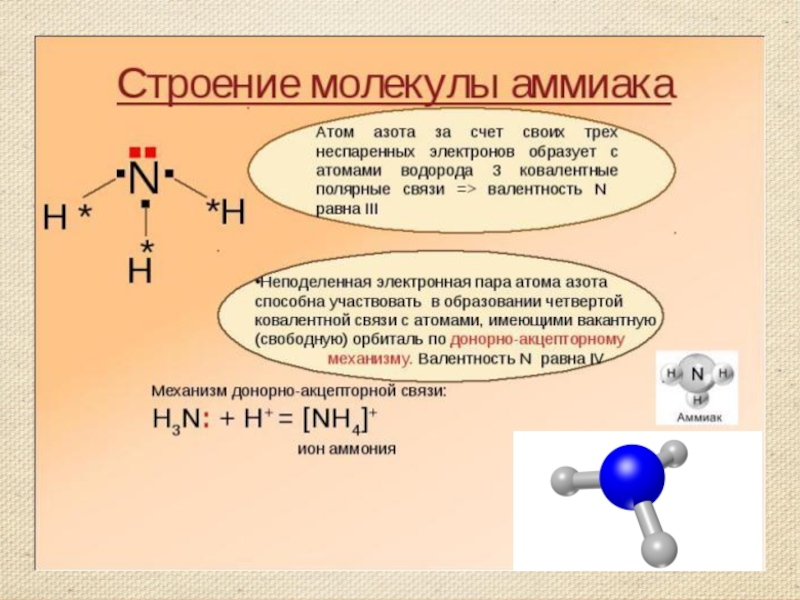
Строение молекулы аммиака. Молекулярная формула аммиака NH3 Электронная формула Структурная формула Масштабная модель
Слайд 7Строение молекулы аммиака.
Молекулярная формула аммиака NH3
Электронная формула
Структурная формула
Масштабная модель
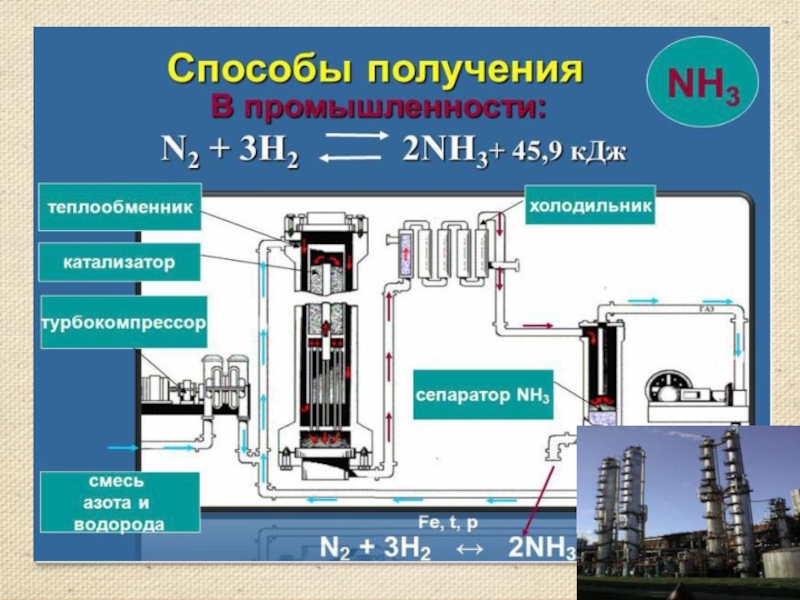
Слайд 13Получение аммиака
Аммиак можно получить нагреванием смеси соли ‑ хлорида аммония
и гидроксида кальция. При нагревании смеси происходит реакция образования соли, аммиака и воды.
2NH4Cl + Ca(OH)2 = 2NH3 ↑ + CaCl2 + 2H2O
Тщательно разотрем ступкой смесь соли и основания и нагреем смесь.
(аммиак - легкий газ).
2NH4Cl + Ca(OH)2 = 2NH3 ↑ + CaCl2 + 2H2O
Тщательно разотрем ступкой смесь соли и основания и нагреем смесь.
(аммиак - легкий газ).
Слайд 17Химические свойства аммиака.
Аммиак-восстановитель
Аммиак на воздухе не горит!
Но
в чистом кислороде он сгорает, окисляясь до азота. Осторожно нагреем раствор аммиака и подадим в горелку кислород. Поднесем зажженную лучинку к отверстию горелки. Аммиак загорается и горит желтовато- зеленым пламенем.
4NH3 + 3O2= 2N2 + 6H2O
Горение аммиака в кислороде
Слайд 20с кислотами:
Из сложных веществ аммиак реагирует
Аммиак NH3 взаимодействует с
концентрированными кислотами – соляной HCl, азотной HNO3 и серной H2SO4.
При добавлении кислоты к раствору аммиака появляется белый дым - выделяется соль -
При добавлении кислоты к раствору аммиака появляется белый дым - выделяется соль -
NH3 + HCl = NH4Cl↑
NH3 + HNO3 = NH4 NO3↓
нитрат аммония.
2NH3+ H2SO4 = (NH4)2SO4↓
сульфат аммония.
хлорид аммония.
Аммиак взаимодействует со всеми растворимыми в воде
кислотами с образованием солей аммония