- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку Алюминий
Содержание
- 1. Презентация к уроку Алюминий
- 2. "Однажды к римскому императору Тиберию
- 3. Я металл, серебристый и лёгкий, И зовусь
- 4. АЛЮМИНИЙ И ЕГО СОЕДИНЕНИЯ
- 5. Положение в Периодической системеАлюминий располагается в
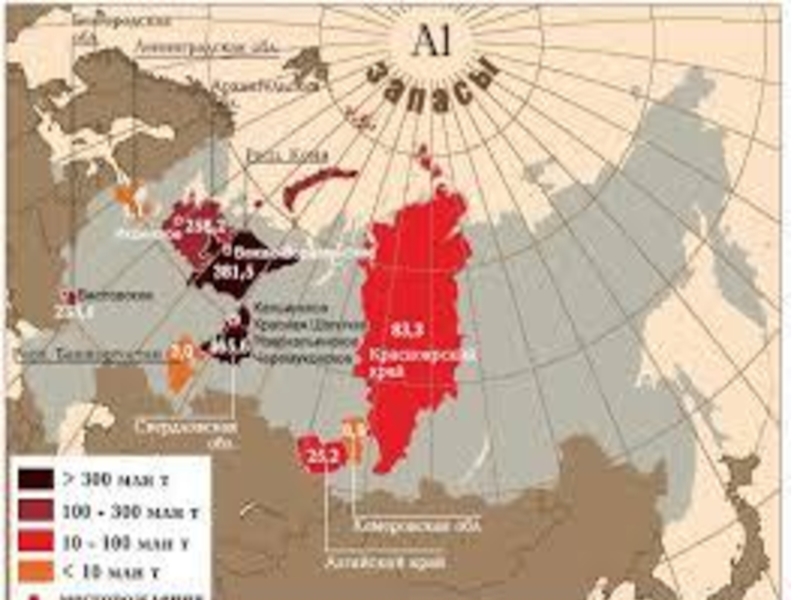
- 6. Нахождение в природеПо распространенности в земной коре алюминий
- 7. Слайд 7
- 8. Впервые алюминий был получен датским физиком Гансом
- 9. плотность (при 20°С) 2698,9 кг/м3; tпл 660,24°С;tкип
- 10. Окисляется на воздухе: 4Al + 3O2 = 2Al2O34
- 11. Взаимодействует с кислотами: 2Al + 6HCl = 2AlCl3
- 12. Вытесняет металлы из их оксидов (алюминотермия):8Al + 3Fe3O4
- 13. Очень твердый порошок белого цвета.Образуется:а) при окислении
- 14. Al2O3 по характеру амфотерный оксид. Взаимодействует:а) с кислотами: Al2O3
- 15. Белый нерастворимый в воде порошокПроявляет амфотерные свойства.Взаимодействует:а)
- 16. 1. Ученый, впервые получивший алюминий.2. Минерал состава
- 17. 1.Эрстед2. Корунд3. Алюминотермия4. Алюмен5. Электролиз6. Востановитель
- 18. Слайд 18
- 19. https://ru.wikipedia.org/wiki/https://ru.wikipedia.org/wiki/Алюминийximik.biz/prakticheskaya-himiya/53-aluminiy-primeneniyewww.metallsk.ru/st60.htmlhttps://aluminiumleader.ru/application/construction/ § 41Домашнее задание
Слайд 1Сами, трудясь, вы сделаете все и для близких людей и для
Слайд 2 "Однажды к римскому императору Тиберию пришёл незнакомец. В дар
Слайд 3Я металл, серебристый и лёгкий, И зовусь самолётный металл, И покрыт я оксидною
Слайд 5Положение
в Периодической системе
Алюминий располагается в 3 периоде, в главной подгруппе
Порядковый номер элемента – 13
Относительная атомная масса – 27
Заряд ядра атома алюминия +13
В атоме 3 энергетических уровня
Протонов – 13
Электронов – 13
Нейтронов - 14
Слайд 6Нахождение в природе
По распространенности в земной коре алюминий занимает 3-е место после
Слайд 8Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825 году
AlCl3 + 3K = 3KCl + Al
В настоящее время алюминий получают электролизом оксида:
эл.ток
2Al2O3 = 4Al + 3O2 – 3352 кДж
Получение алюминия
Слайд 9плотность (при 20°С) 2698,9 кг/м3;
tпл 660,24°С;
tкип около 2500°С;
Алюминий сочетает
На воздухе алюминий покрывается тонкой, но очень прочной пленкой оксида Al2О3, защищающей металл от дальнейшего окисления и обусловливающей его высокие антикоррозионные свойства.
Физические свойства
Слайд 10Окисляется на воздухе:
4Al + 3O2 = 2Al2O3
4 Al0 - 3ē →
3 O20 + 4ē → 2O-2 восстановление, окислитель
Вытесняет водород из воды
2Al + 6H2O = 2Al(OH)3 + 3H2↑
4 Al0 - 3ē → Al+3 окисление, восстановитель
3 2H+1 + 2ē → H20 восстановление, окислитель
Химические свойства
Слайд 11Взаимодействует с кислотами:
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al + 6H+
2Al + 6H+ = 2Al3+ + 3H2↑
Взаимодействует со щелочами:
2Al + 2H2O + 2NaOH = 2NaAlO2 + 3H2↑
2Al + 2H2O + 2Na+ + 2OH- = 2Na+ + 2AlO2- + 3H2↑
2Al + 2H2O + 2OH- = 2AlO2- + 3H2↑
Химические свойства
Слайд 12Вытесняет металлы из их оксидов
(алюминотермия):
8Al + 3Fe3O4 = 9Fe + 4Al2O3
8
3 24 Fe+2 + 2ē → Fe0 – восстановление, ок-ль
3 2Fe+3 + 6ē → 2Fe0 – восстановление, ок-ль
Химические свойства
Слайд 13Очень твердый порошок белого цвета.
Образуется:
а) при окислении или горении алюминия:
4Al +
б) в реакции алюминотермии:
2Al + Fe2O3 = 2Fe + Al2O3
в) при термическом разложении гидроксида:
2Al(OH)3 = Al2O3 + H2O
Соединения алюминия. Оксид
Слайд 14 Al2O3 по характеру амфотерный оксид.
Взаимодействует:
а) с кислотами:
Al2O3 + 3H2SO4 = Al2(SO4)3
Al2O3 + 6H+ + 3SO42- = 2Al3+ + 3SO42- + 3H2O
Al2O3 + 6H+ = 2Al3+ + 3H2O
б) со щелочами:
Al2O3 + 6NaOH = 2Na3AlO3 + 3H2O
Al2O3 + 6Na+ + 6OH- = 6Na+ + 2AlO33- + 3H2O
Al2O3 + 6OH- = 2AlO33- + 3H2O
Химические свойства
оксида алюминия
Слайд 15Белый нерастворимый в воде порошок
Проявляет амфотерные свойства.
Взаимодействует:
а) с кислотами:
Al(OH)3 + 3HNO3
Al(OH)3 + 3H+ + 3NO3- = Al3+ + 3NO3- + 3H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
б) со щелочами:
Al(OH)3 + 3KOH = K3AlO3 + 3H2O
Al(OH)3 + 3K+ + 3OH- = 3K+ + AlO33- + 3H2O
Al(OH)3 + 3OH- = AlO33- + 3H2O
Гидроксид алюминия
Слайд 16
1. Ученый, впервые получивший алюминий.
2. Минерал состава Al2O3, обладающий очень высокой
3. Способ получения металлов из оксидов с помощью алюминия.
4. Латинское слово, от которого образовано название химического элемента Al.
5. Процесс разложения веществ с участием электрического тока.
6. Чем является алюминий в химических реакциях?
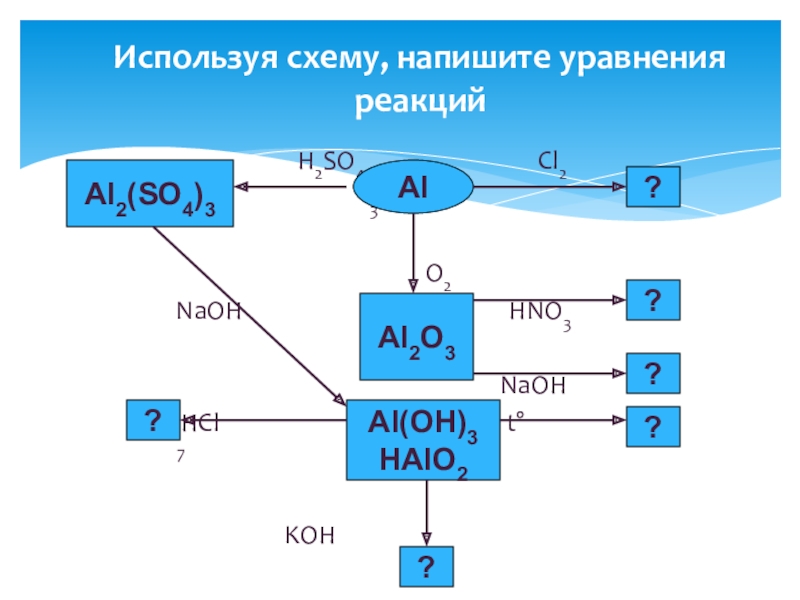
Слайд 18
1 3
O2
NaOH HNO3
4
NaOH
HCl t°
7 9
KOH
Используя схему, напишите уравнения реакций
Al
Al2O3
Al2(SO4)3
?
?
?
?
?
Al(OH)3
HAlO2
?