- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку 21 века по теме Кислоты
Содержание
- 1. Презентация к уроку 21 века по теме Кислоты
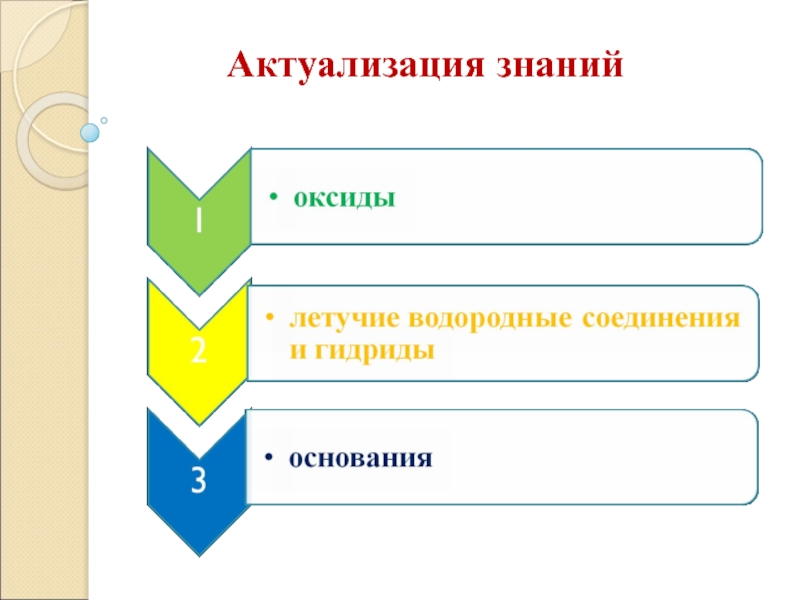
- 2. Актуализация знаний
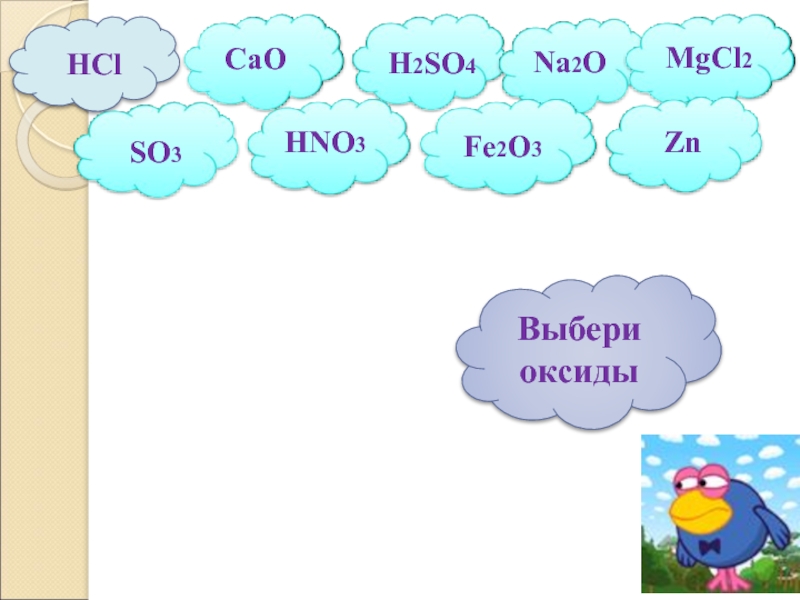
- 3. HCl
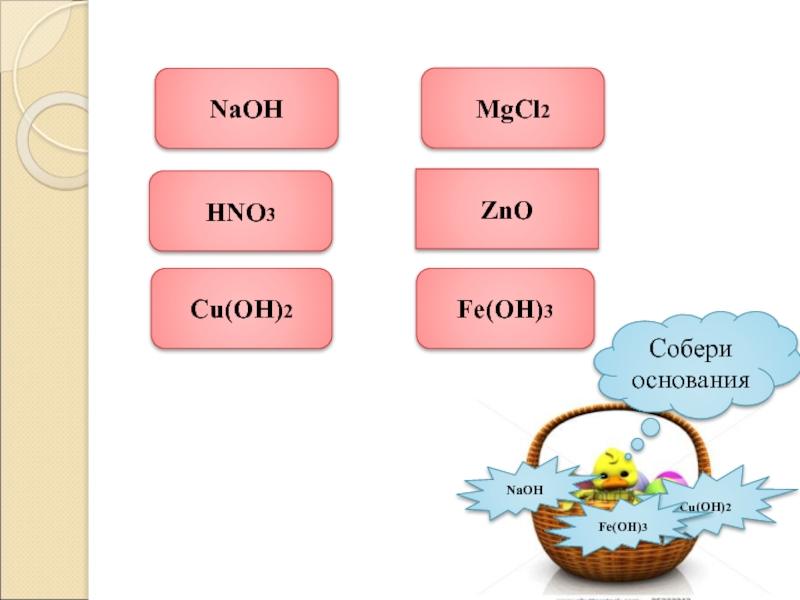
- 4. NaOHHNO3Cu(OH)2MgCl2ZnOFe(OH)3NaOHCu(OH)2Fe(OH)3Собери основания
- 5. Распределить предложенные вещества по классам, дать определения
- 6. Оксиды– сложные вещества, состоящие из двух элементов, один из которых кислород со степенью окисления -2
- 7. Основания – сложные вещества, состоящие из ионов металлов и связанных с ними гидроксид-ионов
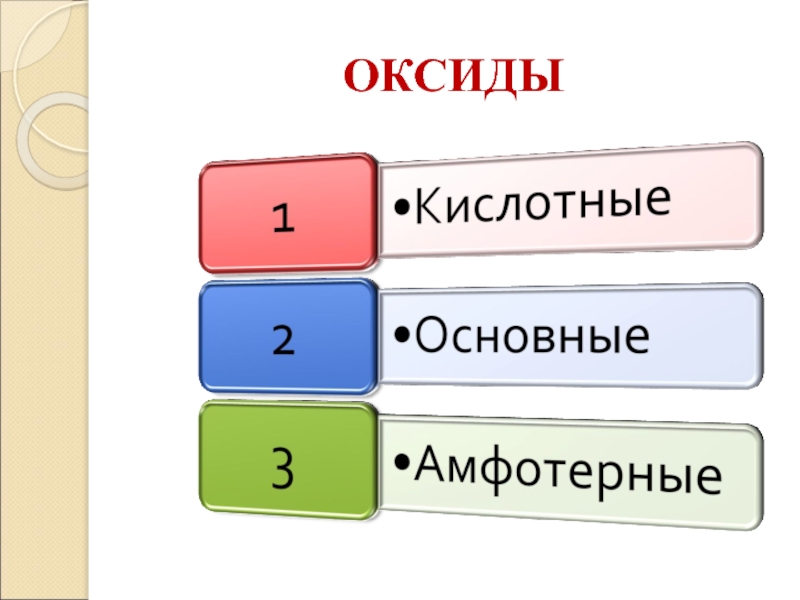
- 8. ОКСИДЫ
- 9. К какой группе веществ мы отнесем H2SO4, HCl, H3PO4?
- 10. КИСЛОТЫТЕМА УРОКА
- 11. Цель урока: сформировать комплекс знаний о кислотах как классе неорганических веществ
- 12. Девиз урока:«Знание только тогда знание, когда оно приобретено усилиями своей мысли, а не одной памяти.»Л.Н.Толстой
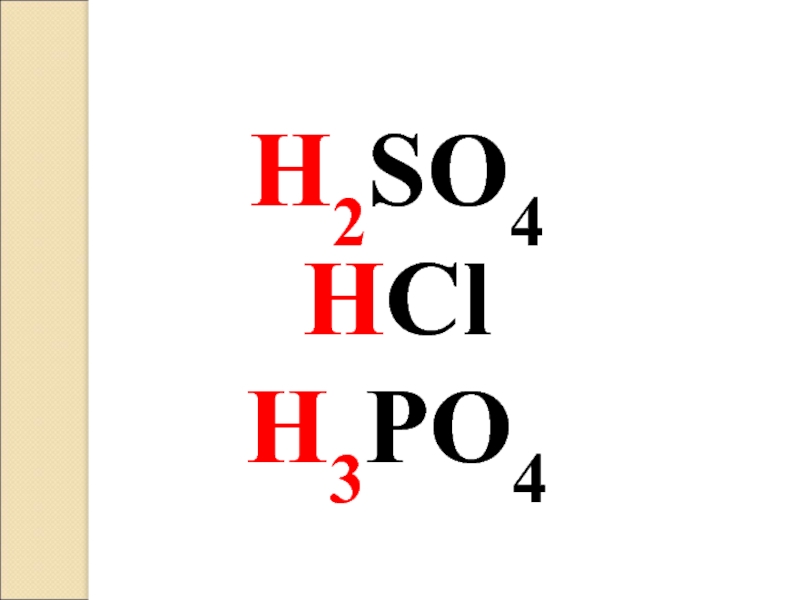
- 13. H2SO4 HCl H3PO4
- 14. Кислоты - это сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка.
- 15. H2SO4 серная
- 16. Физические свойства кислот По агрегатному состоянию: Газообразные
- 17. Классификация кислотПо числу атомов водорода кислоты можно
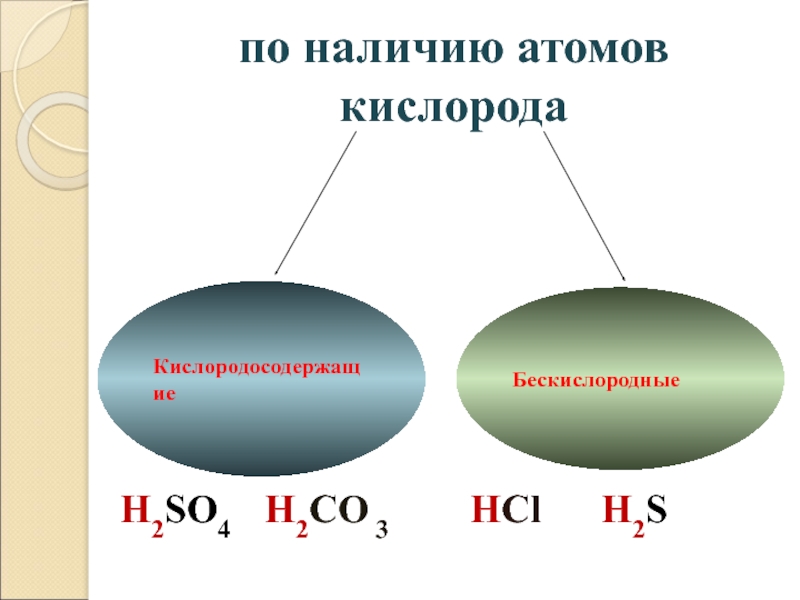
- 18. по наличию атомов кислородаH2SO4 H2CO 3 HCl H2SКислородосодержащиеБескислородные
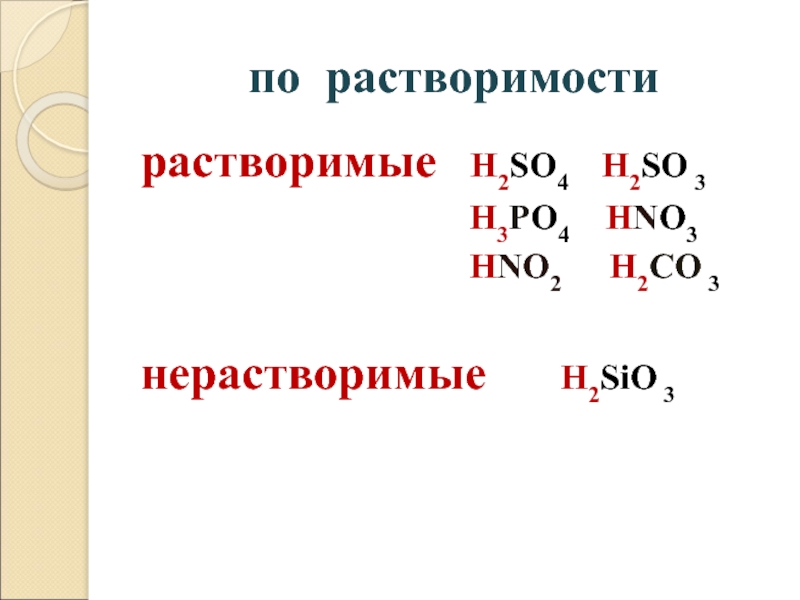
- 19. по растворимостирастворимые H2SO4 H2SO 3
- 20. Серная кислотаКремниевая кислотаАзотнаякислота
- 21. Правила разбавления серной кислотыПри растворении серной кислоты нужно вливать ее тонкой струей в воду и перемешивать
- 22. ПРАВИЛА БЕЗОПАСНОСТИ Едкое вещество—кислота! Разрушает и раздражает
- 23. Есть кислоты, которые в свободном виде не
- 24. Нахождение степени окисленияВ бинарных кислотах +1 -1
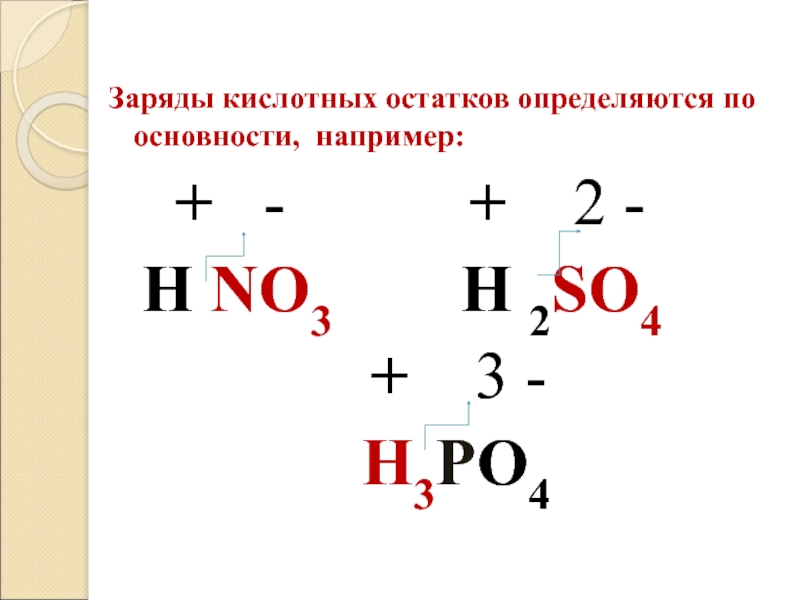
- 25. Заряды кислотных остатков определяются по основности, например:
- 26. Составим оксиды соответствующих кислот
- 27. Самостоятельная работаДайте характеристику следующим кислотам H3PO4 ,
- 28. Проверьте себяH3PO4 HNO2, H2SO3
- 29. Рефлексия1. На уроке я работал(а):
- 30. Домашнее заданиепараграф 21, вопросы 1 – 2, составить кроссворд по теме «Кислоты».
- 31. МОЛОДЦЫ!
Актуализация знаний
Слайд 1Филиал МБОУ Токаревской СОШ №2 в с.Гладышево
Презентация к уроку «Кислоты»
Учитель химии
Кузина Ирина Владимировна
Слайд 5Распределить предложенные вещества по классам, дать определения известных классов.
H2SO4,
СаO, КOH,
N2O5, Fe(OH)2, Li2O,
HCl, CO2, Ba(OH)2,
H3PO4
N2O5, Fe(OH)2, Li2O,
HCl, CO2, Ba(OH)2,
H3PO4
Слайд 6Оксиды– сложные вещества, состоящие из двух элементов, один из которых кислород
со степенью окисления -2
Слайд 12Девиз урока:
«Знание только тогда знание, когда оно приобретено усилиями своей мысли,
а не одной памяти.»
Л.Н.Толстой
Л.Н.Толстой
Слайд 14
Кислоты - это сложные вещества, молекулы которых состоят из атомов водорода
и кислотного остатка.
Слайд 15H2SO4 серная кислота
H2SO 3
сернистая кислота
H3PO4 фосфорная кислота
HNO3 азотная кислота
HNO2 азотистая кислота
H2CO 3 угольная кислота
H2SiO 3 кремниевая кислота
HCl хлороводородная
(соляная) кислота
H3PO4 фосфорная кислота
HNO3 азотная кислота
HNO2 азотистая кислота
H2CO 3 угольная кислота
H2SiO 3 кремниевая кислота
HCl хлороводородная
(соляная) кислота
Слайд 16Физические свойства кислот
По агрегатному состоянию:
Газообразные (HCl, H 2S)
Жидкие (HNO3, H 2SO 4)
Твердые (H3PO4, H2SiO 3).
Кислоты имеют кислый вкус:
Кислый вкус лимону придает лимонная кислота,
яблоку — яблочная кислота, скисшему молоку —
молочная кислота. Щавель имеет кислый вкус
благодаря наличию в его листьях щавелевой кислоты.
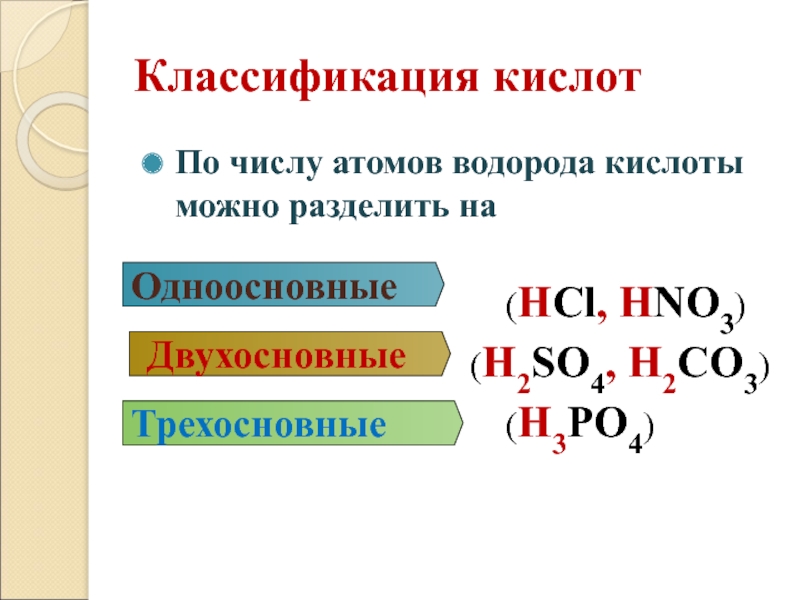
Слайд 17Классификация кислот
По числу атомов водорода кислоты можно разделить на
(HCl, HNO3)
(H2SO4, H2CO3)
(H3PO4)
(H2SO4, H2CO3)
(H3PO4)
Одноосновные
Двухосновные
Трехосновные
Слайд 21Правила разбавления серной кислоты
При растворении серной кислоты нужно вливать ее тонкой
струей в воду и перемешивать
Слайд 22ПРАВИЛА БЕЗОПАСНОСТИ
Едкое вещество—кислота! Разрушает и раздражает кожу, слизистые оболочки.
Попавшие на кожу
капли раствора кислоты немедленно смойте сильной струей холодной воды, а затем обработайте поврежденную поверхность 2%-м раствором питьевой соды.
Слайд 24Нахождение степени окисления
В бинарных кислотах
+1 -1 +1
-2
HCl H2S
Рассчитаем степени окисления элементов в серной кислоте.
+1 x -2
H2 SO4
Составим уравнение:
(+1)∙2+х+(-2)∙4=0 , где х- степень окисления серы; х=6
HCl H2S
Рассчитаем степени окисления элементов в серной кислоте.
+1 x -2
H2 SO4
Составим уравнение:
(+1)∙2+х+(-2)∙4=0 , где х- степень окисления серы; х=6
Слайд 25Заряды кислотных остатков определяются по основности, например:
+
- + 2 -
H NO3 H 2SO4
+ 3 -
H3PO4
H NO3 H 2SO4
+ 3 -
H3PO4
Слайд 27Самостоятельная работа
Дайте характеристику следующим кислотам H3PO4 , HNO2, H2SO3
по плану:
1.Наличие кислорода
2.Основность
3.Растворимость
4.Степени окисления элементов, образующих кислоту
5.Заряд иона, образуемого кислотным остатком
6.Соответствующий оксид
Учащиеся выбирают для характеристики любую кислоту.
1.Наличие кислорода
2.Основность
3.Растворимость
4.Степени окисления элементов, образующих кислоту
5.Заряд иона, образуемого кислотным остатком
6.Соответствующий оксид
Учащиеся выбирают для характеристики любую кислоту.
Слайд 29Рефлексия
1. На уроке я работал(а):
активно/пассивно
2. Своей работой на уроке я: доволен/ не доволен
3. Урок для меня показался: коротким/ длинным
4. За урок я: не устал(а)/ устал(а)
5. Мое настроение: стало лучше/ стало хуже
6. Материал урока мне был: понятен/ не понятен
полезен/бесполезен
интересен/ скучен
7. Домашнее задание мне кажется: легким/ трудным
2. Своей работой на уроке я: доволен/ не доволен
3. Урок для меня показался: коротким/ длинным
4. За урок я: не устал(а)/ устал(а)
5. Мое настроение: стало лучше/ стало хуже
6. Материал урока мне был: понятен/ не понятен
полезен/бесполезен
интересен/ скучен
7. Домашнее задание мне кажется: легким/ трудным