МБОУ СОШ №37
Научный руководитель:
Незговорова Марина Вячеславовна
учитель химии I категории
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к работе на секции НОУ по химии Влияние природы катализатора на скорость химических реакций
Содержание
- 1. Презентация к работе на секции НОУ по химии Влияние природы катализатора на скорость химических реакций
- 2. Цель работы - исследование влияния различных катализаторов
- 3. Катализа́тор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции.Ката́лиз- ускорение химических реакций под действием катализаторов, которые сами входе реакции не изменяются.
- 4. Скорость гомогенной реакции определяется как изменение концентрации
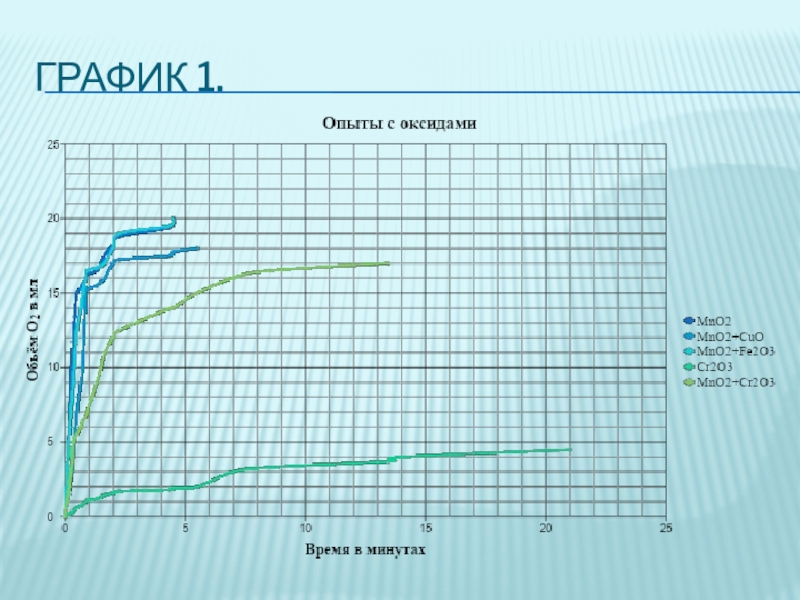
- 5. Опыты с оксидами металлов. Все опыты проводились
- 6. РИСУНОК 1.
- 7. График 1.
- 8. Опыты с ферментами.В опытах с ферментами концентрация
- 9. График 2.
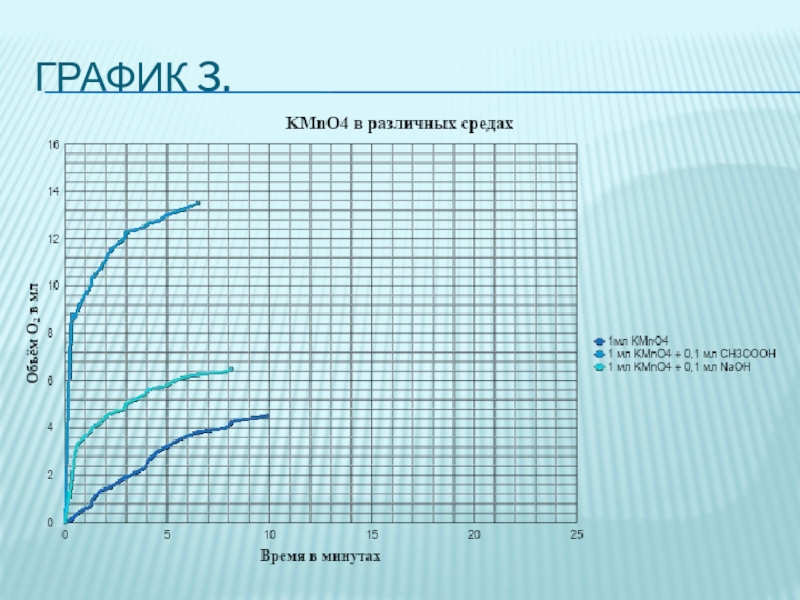
- 10. Опыты с перманганатом калия, в различных средах.Были
- 11. График 3.
- 12. ОПЫТЫ С ПЕРМАНГАНАТОМ КАЛИЯ, ВЗЯТЫМ В РАЗЛИЧНЫХ
- 13. График 4.
- 14. Выводы:Наилучшим образом в качестве катализатора разложения пероксида
Цель работы - исследование влияния различных катализаторов на скорость химической реакции.Поставленные задачи:1) изучить литературный материал о влиянии катализаторов на скорость химической реакции;2) исследовать зависимость скорости химической реакции от природы катализатора, концентрации катализатора, площади поверхности катализатора, среды
Слайд 1Влияние природы катализатора на разложение перекиси водорода.
Выполнил: Дерябин Максим Сергеевич
9в класс
Слайд 2Цель работы - исследование влияния различных катализаторов на скорость химической реакции.
Поставленные
задачи:
1) изучить литературный материал о влиянии катализаторов на скорость химической реакции;
2) исследовать зависимость скорости химической реакции от природы катализатора, концентрации катализатора, площади поверхности катализатора, среды (кислотной, щелочной и нейтральной).
3) провести опыты, позволяющие сравнить эффективность различных катализаторов относительно друг друга.
1) изучить литературный материал о влиянии катализаторов на скорость химической реакции;
2) исследовать зависимость скорости химической реакции от природы катализатора, концентрации катализатора, площади поверхности катализатора, среды (кислотной, щелочной и нейтральной).
3) провести опыты, позволяющие сравнить эффективность различных катализаторов относительно друг друга.
Слайд 3Катализа́тор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов
реакции.
Ката́лиз- ускорение химических реакций под действием катализаторов, которые сами входе реакции не изменяются.
Слайд 4Скорость гомогенной реакции определяется как изменение концентрации одного из исходных веществ
в единицу времени.
Скорость гетерогенной реакции определяется как изменение количества вещества в единицу времени на единицу поверхности.
Слайд 5Опыты с оксидами металлов.
Все опыты проводились в одинаковых условиях, с
помощью установки, изображённой на рисунке 1. В качестве катализаторов мы использовали : оксид марганца (IV) , оксид меди (II) , оксид железа (III), оксид хрома (III).
Во всех опытах с оксидами концентрация перекиси была 0,3%, масса катализатора 0,1г, объём перекиси 20мл.
Во всех опытах с оксидами концентрация перекиси была 0,3%, масса катализатора 0,1г, объём перекиси 20мл.
Слайд 8Опыты с ферментами.
В опытах с ферментами концентрация перекиси была 0,3%, объём
перекиси 20мл, масса катализатора 5г. В качестве катализаторов мы использовали : мелко-натёртую морковь, мелко-натёртый картофель, мясной фарш, крупные кусочки моркови.
Слайд 10Опыты с перманганатом калия, в различных средах.
Были проведены опыты с раствором
перманганата калия. В опытах с раствором перманганата калия концентрация перекиси была 0,3%, объём перекиси 20мл, концентрация раствора марганцовокислого калия была 10%. Мы проверили эффективность раствора перманганата калия как катализатора в различных средах, в этих опытах объём перманганата калия оставался неизменным и был 1мл.
Слайд 12ОПЫТЫ С ПЕРМАНГАНАТОМ КАЛИЯ, ВЗЯТЫМ В РАЗЛИЧНЫХ ОБЪЁМАХ.
Мы поочерёдно провели опыты
с раствором марганцовокислого калия в нейтральной среде взятым в следующих объёмах: 0,5мл , 1мл , 2мл, 3мл.
Слайд 14Выводы:
Наилучшим образом в качестве катализатора разложения пероксида водорода проявил себя среди
оксидов металлов оксид марганца (IV) .
Среди природных катализаторов наибольшую эффективность показала мелко-натёртая морковь.
Среды опытов с раствором перманганата калия, в различных средах наибольшая скорость реакции наблюдалась в опыте с уксусной кислотой.
В опытах с различными объёмами раствора марганцовокислого калия, наибольшая скорость реакции наблюдалась в опыте с объёмом раствора марганцовокислого калия 0,5мл.
Среди природных катализаторов наибольшую эффективность показала мелко-натёртая морковь.
Среды опытов с раствором перманганата калия, в различных средах наибольшая скорость реакции наблюдалась в опыте с уксусной кислотой.
В опытах с различными объёмами раствора марганцовокислого калия, наибольшая скорость реакции наблюдалась в опыте с объёмом раствора марганцовокислого калия 0,5мл.