- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Аллотропные модификации неметаллов
Содержание
- 1. Презентация: Аллотропные модификации неметаллов
- 2. АллотропияОт греческого allos – другой, tropos –
- 3. Аллотропные модификацииПростые вещества, образованные одним химическим элементом называют аллотропными модификациями
- 4. Элементы, имеющие аллотропные модификацииКислородФосфорСераУглерод
- 5. КислородКислород О2
- 6. КислородХимическая формула О2.Физические свойства: газ, без цвета,
- 7. ОзонХимическая формула О3.Физические свойства: синий газ с
- 8. Фосфор Белый фосфор
- 9. Белый фосфорХимическая формула P4.Физические свойства: воскообразное, прозрачное
- 10. Красный фосфорХимическая формула P.Физические свойства: твердое аморфное
- 11. Черный фосфорХимическая формула P.Физические свойства: по внешнему
- 12. Причины аллотропииОбразование молекул с различным числом атомов (О2 и О3).Образование различных кристаллических решеток (модификации фосфора).
- 13. Элементарный углерод образует три аллотропных видоизменения:
- 14. Графит тоже имеет атомную кристаллическую решётку, но устроена
- 15. АДСОРБЦИЯАлмаз и графит взаимопревращаемы. При сильном нагревании
- 16. Слайд 16
- 17. Ромбическая (a - сера) - S8t°пл. = 113°C; ρ = 2,07 г/см3. Наиболее устойчивая
- 18. СПАСИБО ЗА ВНИМАНИЕ!
АллотропияОт греческого allos – другой, tropos – поворот, свойство.Явление, при котором один и тот же химический элемент существует в виде нескольких простых веществ, различных по строению и свойствам.
Слайд 1Аллотропные модификации
неметаллов
Презентацию выполнила:
Ученица 9 класса
Шарлаева Яна
Учитель: Болховитина Л. В.
МКОУ Терновская ООШ
Слайд 2Аллотропия
От греческого allos – другой, tropos – поворот, свойство.
Явление, при котором
один и тот же химический элемент существует в виде нескольких простых веществ, различных по строению и свойствам.
Слайд 3
Аллотропные модификации
Простые вещества, образованные одним химическим элементом называют аллотропными модификациями
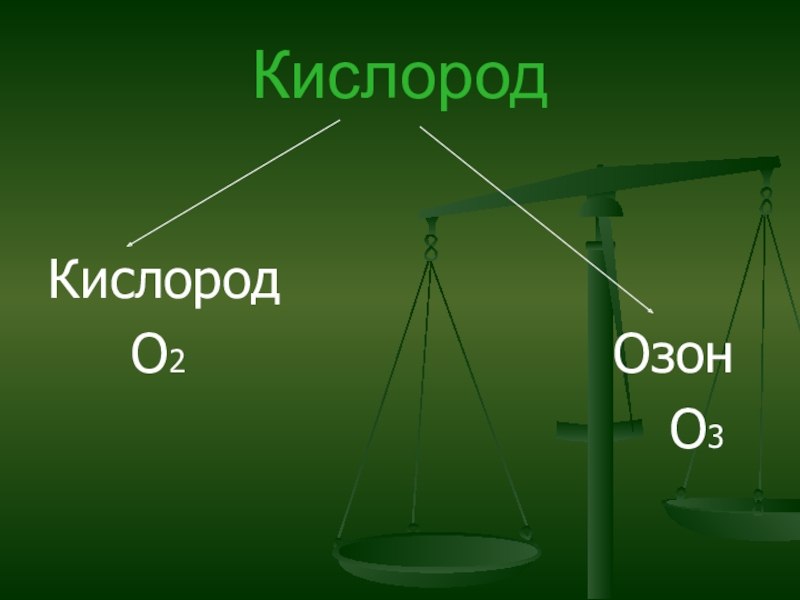
Слайд 6Кислород
Химическая формула О2.
Физические свойства: газ, без цвета, без запаха, мало растворим
в воде, не задерживает УФ лучи.
Биологические свойства: Не ядовит, не бактерициден, необходим для дыхания аэробных организмов.
Содержание в воздухе - 21% по объему, 23% по массе.
Биологические свойства: Не ядовит, не бактерициден, необходим для дыхания аэробных организмов.
Содержание в воздухе - 21% по объему, 23% по массе.
Слайд 7Озон
Химическая формула О3.
Физические свойства: синий газ с резким запахом, растворим в
воде в 10 раз лучше кислорода, задерживает УФ лучи.
Биологические свойства: Ядовит в больших концентрациях, бактерициден, сильно раздражает глаза и дыхательные пути.
Содержание в воздухе: летом – до 7*10-9% (по объему), зимой – до 2*10-10%. В атмосфере максимальная концентрация на высоте 20-25 км, где озон образует слой, защищающий Землю от УФ-излучения.
Биологические свойства: Ядовит в больших концентрациях, бактерициден, сильно раздражает глаза и дыхательные пути.
Содержание в воздухе: летом – до 7*10-9% (по объему), зимой – до 2*10-10%. В атмосфере максимальная концентрация на высоте 20-25 км, где озон образует слой, защищающий Землю от УФ-излучения.
Слайд 9Белый фосфор
Химическая формула P4.
Физические свойства: воскообразное, прозрачное вещество с характерным запахом.
Кристаллическая
решетка – молекулярная.
Белый фосфор ядовит,
на воздухе при t около 40 °С самовоспламеняется,
поэтому его следует хранить под водой.
Белый фосфор ядовит,
на воздухе при t около 40 °С самовоспламеняется,
поэтому его следует хранить под водой.
Слайд 10Красный фосфор
Химическая формула P.
Физические свойства: твердое аморфное вещество с цветом от
темно-коричневого до фиолетового.
Кристаллическая решетка атомная.
Красный фосфор не ядовит,
на воздухе не воспламеняется.
Не растворяется ни в воде, ни в сероуглероде. Не светится в темноте. Загорается лишь при поджигании.
Кристаллическая решетка атомная.
Красный фосфор не ядовит,
на воздухе не воспламеняется.
Не растворяется ни в воде, ни в сероуглероде. Не светится в темноте. Загорается лишь при поджигании.
Слайд 11Черный фосфор
Химическая формула P.
Физические свойства: по внешнему виду похож на графит,
полупроводник.
Кристаллическая решетка – атомная.
Черный фосфор малоактивен,
с трудом воспламеняется
на воздухе,
поэтому его можно безопасно подвергать механической обработке.
Кристаллическая решетка – атомная.
Черный фосфор малоактивен,
с трудом воспламеняется
на воздухе,
поэтому его можно безопасно подвергать механической обработке.
Слайд 12
Причины аллотропии
Образование молекул с различным числом атомов (О2 и О3).
Образование различных
кристаллических решеток (модификации фосфора).
Слайд 13Элементарный углерод образует три аллотропных видоизменения: алмаз, графит и карбин, наиболее
известны алмаз и графит.
Алмаз имеет атомную кристаллическую решётку. Каждый атом углерода в алмазе связан четырьмя прочными ковалентными связями с соседними атомами, расположенными в вершинах тетраэдра.
Благодаря такому строению алмаз — самое твёрдое из известных природных веществ. Все четыре валентных электрона каждого атома углерода участвуют в образовании связей, поэтому алмаз не проводит электрический ток. Это бесцветное прозрачное кристаллическое вещество, хорошо преломляющее свет.
Алмаз имеет атомную кристаллическую решётку. Каждый атом углерода в алмазе связан четырьмя прочными ковалентными связями с соседними атомами, расположенными в вершинах тетраэдра.
Благодаря такому строению алмаз — самое твёрдое из известных природных веществ. Все четыре валентных электрона каждого атома углерода участвуют в образовании связей, поэтому алмаз не проводит электрический ток. Это бесцветное прозрачное кристаллическое вещество, хорошо преломляющее свет.
Аллотропные видоизменения углерода.
Слайд 14Графит тоже имеет атомную кристаллическую решётку, но устроена она иначе. Решётка графита слоистая.
Каждый атом углерода соединён прочными ковалентными связями с тремя соседними атомами. Образуются плоские слои из шестиугольников, которые между собой связаны слабо. Один валентный электрон у атома углерода остаётся свободным.
Графит представляет собой тёмно-серое вещество с металлическим блеском, жирное на ощупь. В отличие от алмаза графит непрозрачный, проводит электрический ток и оставляет серый след на бумаге. У графита очень высокая температура плавления (3700 °С).
Графит представляет собой тёмно-серое вещество с металлическим блеском, жирное на ощупь. В отличие от алмаза графит непрозрачный, проводит электрический ток и оставляет серый след на бумаге. У графита очень высокая температура плавления (3700 °С).
Слайд 15АДСОРБЦИЯ
Алмаз и графит взаимопревращаемы. При сильном нагревании без доступа воздуха алмаз
чернеет и превращается в графит. Графит можно превратить в алмаз при высокой температуре и большом давлении.
Из мельчайших частиц графита состоят сажа, древесный уголь и кокс. Сажа образуется при неполном сгорании топлива. Древесный уголь получают при нагревании древесины без доступа воздуха, а кокс — переработкой каменного угля.
Древесный уголь имеет пористое строение и обладает способностью поглощать газы и растворённые вещества. Такое свойство называется адсорбцией.
Из мельчайших частиц графита состоят сажа, древесный уголь и кокс. Сажа образуется при неполном сгорании топлива. Древесный уголь получают при нагревании древесины без доступа воздуха, а кокс — переработкой каменного угля.
Древесный уголь имеет пористое строение и обладает способностью поглощать газы и растворённые вещества. Такое свойство называется адсорбцией.
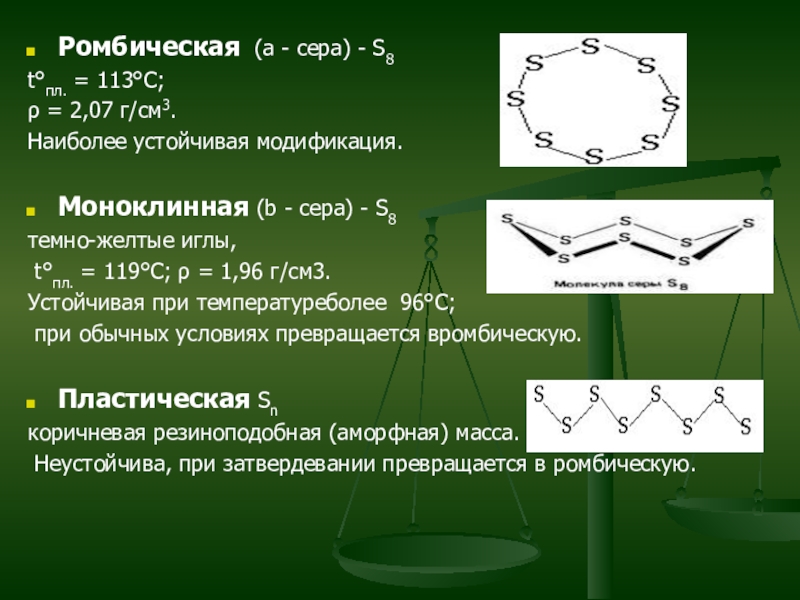
Слайд 17Ромбическая (a - сера) - S8
t°пл. = 113°C;
ρ = 2,07 г/см3.
Наиболее устойчивая модификация.
Моноклинная (b - сера) - S8
темно-желтые иглы,
t°пл. =
119°C; ρ = 1,96 г/см3.
Устойчивая при температуреболее 96°С;
при обычных условиях превращается вромбическую.
Пластическая Sn
коричневая резиноподобная (аморфная) масса.
Неустойчива, при затвердевании превращается в ромбическую.
Устойчивая при температуреболее 96°С;
при обычных условиях превращается вромбическую.
Пластическая Sn
коричневая резиноподобная (аморфная) масса.
Неустойчива, при затвердевании превращается в ромбическую.