А. А.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад 8 класс, урок-обобщение Типы химических реакций
Содержание
- 1. Презентация 8 класс, урок-обобщение Типы химических реакций
- 2. Химия- жизнь, а жизнь- химия! (М.И. Бармин)
- 3. Цель урока: повторить классификацию веществ, типы химических
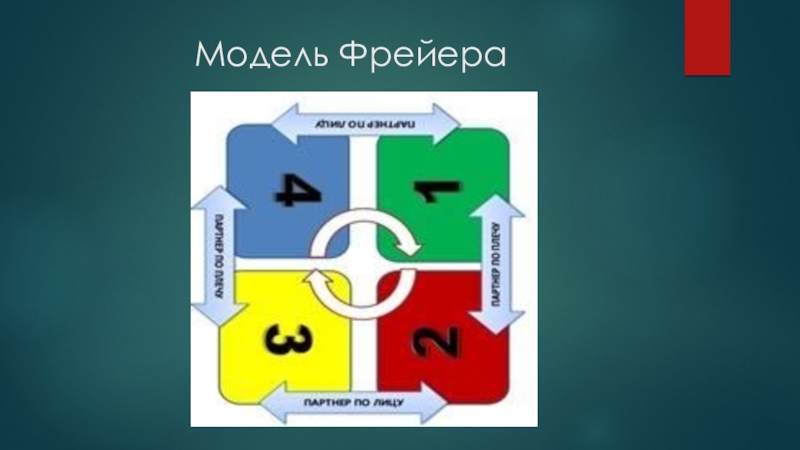
- 4. Модель Фрейера
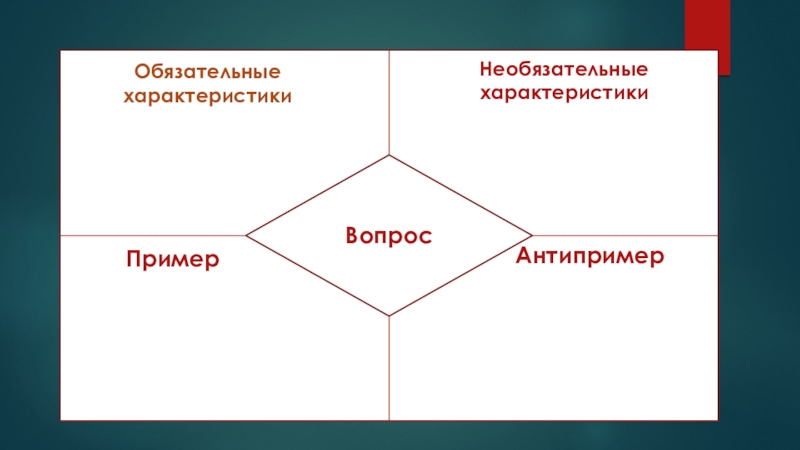
- 5. DfОбязательные характеристикиНеобязательныехарактеристикиВопросПримерАнтипример
- 6. Вопросы:1 группа: Что такое химическая реакция?2 группа:
- 7. СИТУАЦИЯ №1 Мама
- 8. CaO + H2O = Ca(OH)2Реакция Гидроксид кальциясоединения
- 9. Какой из этих реакций подходит?СОЕДИНЕНИЯ
- 10. Чтобы запаять чайник, папе для обработки поверхности
- 11. РЕАКЦИЯ Zn + 2HCl = ZnCl2 + H2Хлорид цинказамещения
- 12. Какой из этих реакций подходит?СОЕДИНЕНИЯ
- 13. Члены кружка «Юный химик» помогали учителю готовить
- 14. Реакция CaCO3 + 2HCl = CaCl2 +
- 15. Какой из этих реакций подходит?СОЕДИНЕНИЯ
- 16. Светлана Леонидовна получила осадок гидроксида меди (II)(Сu(OH)2(
- 17. Реакция CuSO4 + 2NaOH = Cu(OH)2 +
- 18. Какой из этих реакций подходит?СОЕДИНЕНИЯ
- 19. РефлексияЕсли выделится газ – это раз;И получится
Химия- жизнь, а жизнь- химия! (М.И. Бармин)
Слайд 1Обобщающий урок
по теме
«Типы химических реакций»
Выполнила:
Учитель биологии и химии
Кулаковская
Слайд 3Цель урока: повторить классификацию веществ, типы химических реакций и признаки их
классификации, научить обучающихся применять полученные знания о типах химических реакций на практике – составлять уравнения химических реакций, определять типы химических реакций.
Задачи.
Образовательные - развить навыки самостоятельной работы, умения записывать уравнения реакций и расставлять коэффициенты, указывать типы реакций, делать выводы и обобщения.
Развивающие - развить речевые навыки, способности к анализу; развитие познавательных способностей, мышления, внимания, умения использовать изученный материал для познания нового.
Воспитательные - воспитание самостоятельности, сотрудничества, нравственных качеств – коллективизма, способности к взаимовыручке, адекватной самооценке.
Слайд 6Вопросы:
1 группа: Что такое химическая реакция?
2 группа: По каким признакам можно
классифицировать химические реакции?
3 группа: Зачем необходимо знать типы реакций?
4 группа: Что происходит во время химических реакций?
3 группа: Зачем необходимо знать типы реакций?
4 группа: Что происходит во время химических реакций?
Слайд 7СИТУАЦИЯ №1
Мама решила побелить квартиру,
пошла в магазин за известью, а её там не оказалось.
Что делать?
Тут она вспомнила, что сосед предлагал ей негашеную известь (СаО) но её надо залить водой, т.е. загасить.
Что делать?
Тут она вспомнила, что сосед предлагал ей негашеную известь (СаО) но её надо залить водой, т.е. загасить.
Слайд 9Какой из этих реакций подходит?
СОЕДИНЕНИЯ
1. АВ + СД = АД + СВ
ЗАМЕЩЕНИЯ 2. А + В = АВ
ОБМЕНА 3. АВ = А + В
РАЗЛОЖЕНИЯ 4. АВ + С = СВ + А
ЗАМЕЩЕНИЯ 2. А + В = АВ
ОБМЕНА 3. АВ = А + В
РАЗЛОЖЕНИЯ 4. АВ + С = СВ + А
Слайд 10 Чтобы запаять чайник, папе для обработки поверхности металла понадобилась «травленая» соляная
кислота. Для её приготовления он взял кусочек цинка и опустил его в раствор соляной кислоты.
СИТУАЦИЯ №2
Слайд 12Какой из этих реакций подходит?
СОЕДИНЕНИЯ
1. АВ + СД = АД + СВ
ЗАМЕЩЕНИЯ 2. А + В = АВ
ОБМЕНА 3. АВ = А + В
РАЗЛОЖЕНИЯ 4. АВ + С = СВ + А
ЗАМЕЩЕНИЯ 2. А + В = АВ
ОБМЕНА 3. АВ = А + В
РАЗЛОЖЕНИЯ 4. АВ + С = СВ + А
Слайд 13Члены кружка «Юный химик» помогали учителю готовить на следующий урок лабораторную
работу. Случайно капля соляной кислоты попала на кусочек мела (карбонат кальция). Послышалось шипение, ребята испугались, подумав, что сейчас произойдет что-нибудь страшное.
СИТУАЦИЯ № 3
Слайд 15Какой из этих реакций подходит?
СОЕДИНЕНИЯ
1. АВ + СД = АД + СВ
ЗАМЕЩЕНИЯ 2. А + В = АВ
ОБМЕНА 3. АВ = А + В
РАЗЛОЖЕНИЯ 4. АВ + С = СВ + А
ЗАМЕЩЕНИЯ 2. А + В = АВ
ОБМЕНА 3. АВ = А + В
РАЗЛОЖЕНИЯ 4. АВ + С = СВ + А
Слайд 16 Светлана Леонидовна получила осадок гидроксида меди (II)(Сu(OH)2( при взаимодействии раствора сульфата
меди (СuSO4) и избытка гидроксида натрия( NaOH)) для проведения лабораторного опыта с соляной кислотой. А ребята, невнимательно прочитав задание, взяли и нагрели его, ничего туда не добавляя. Вместо растворения голубого осадка выпал осадок другого цвета.
СИТУАЦИЯ № 4
Слайд 17Реакция
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Гидроксид меди Сульфат натрия
Cu(OH)2 CuO + H2O
оксид меди
Cu(OH)2 CuO + H2O
оксид меди
t*
разложения
Слайд 18Какой из этих реакций подходит?
СОЕДИНЕНИЯ
1. АВ + СД = АД + СВ
ЗАМЕЩЕНИЯ 2. А + В = АВ
ОБМЕНА 3. АВ = А + В
РАЗЛОЖЕНИЯ 4. АВ + С = СВ + А
ЗАМЕЩЕНИЯ 2. А + В = АВ
ОБМЕНА 3. АВ = А + В
РАЗЛОЖЕНИЯ 4. АВ + С = СВ + А
Слайд 19Рефлексия
Если выделится газ – это раз;
И получится вода – это два;
А
еще - нерастворимый
Осаждается продукт…
«Есть осадок» – говорим мы.
Это третий важный пункт.
Осаждается продукт…
«Есть осадок» – говорим мы.
Это третий важный пункт.