- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Презентации на тему Электролитическая диссоциация
Содержание
- 1. Презентации на тему Электролитическая диссоциация
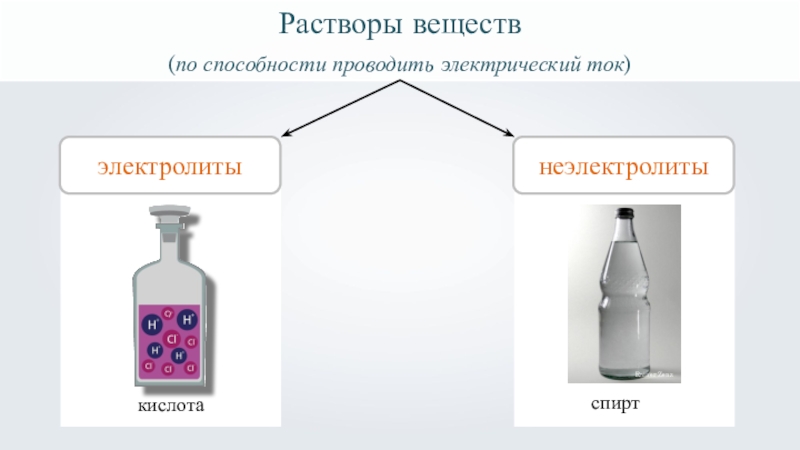
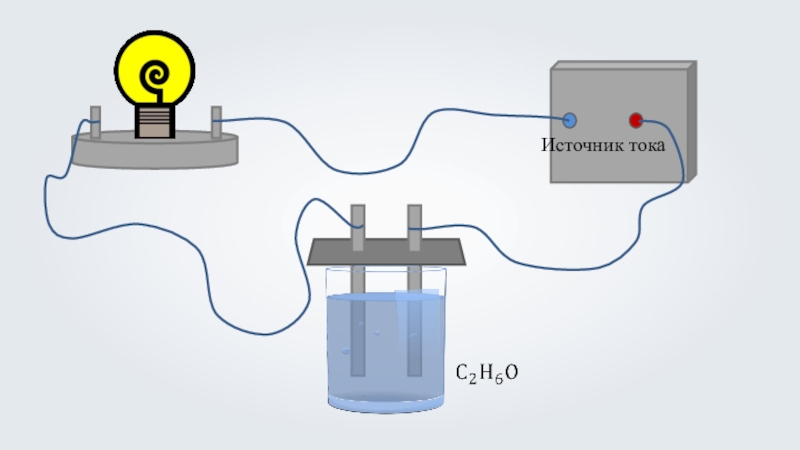
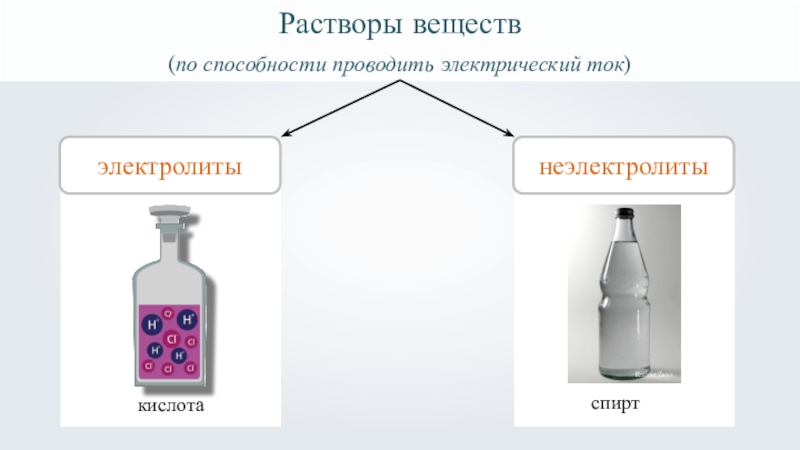
- 2. Растворы веществ(по способности проводить электрический ток) электролитыкислота
- 3. Растворы веществ(по способности проводить электрический ток) электролиты1неэлектролитыRainer Zenzспирткислота
- 4. Слайд 4
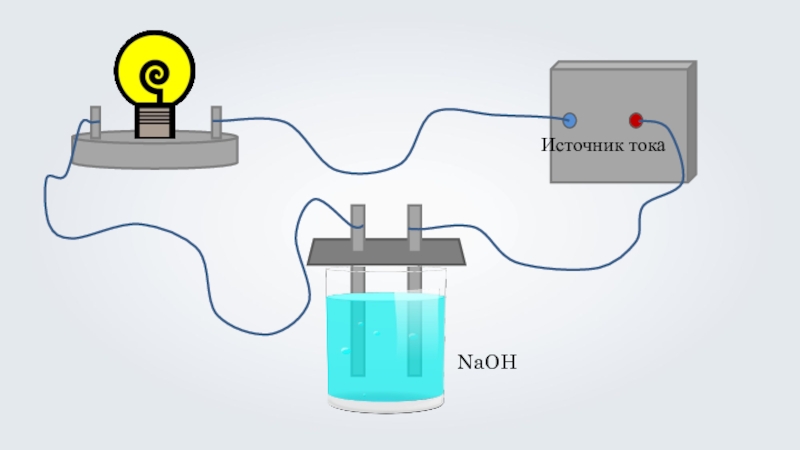
- 5. NaOH
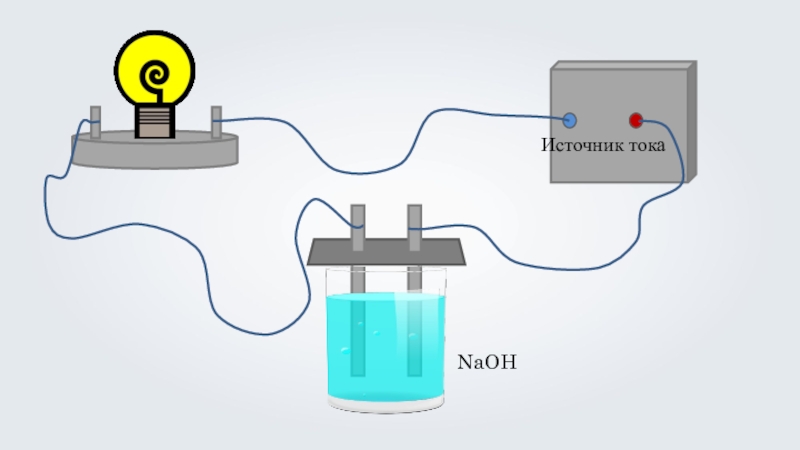
- 6. NaOH
- 7.
- 8. Растворы веществ
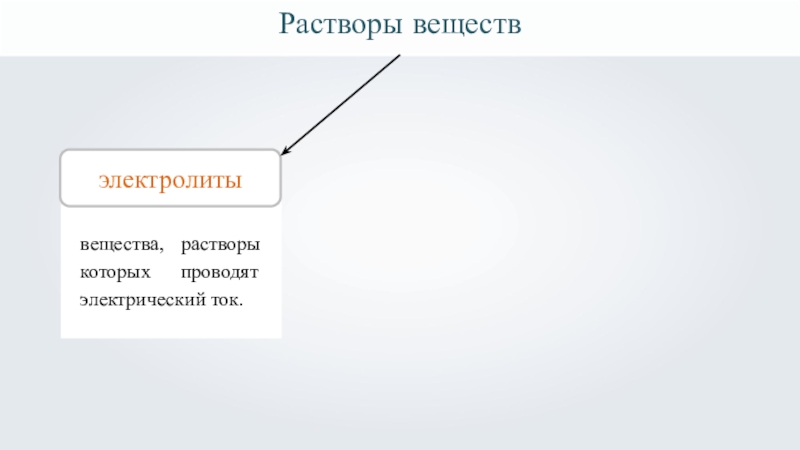
- 9. Растворы веществэлектролитывещества, растворы которых проводят электрический ток.
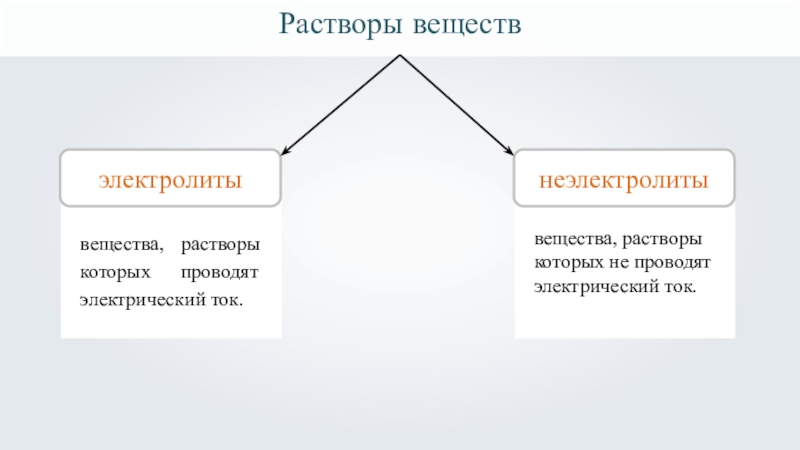
- 10. Растворы веществэлектролиты1неэлектролитывещества, растворы которых проводят электрический ток. вещества, растворы которых не проводят электрический ток.
- 11. Слайд 11
- 12. Слайд 12
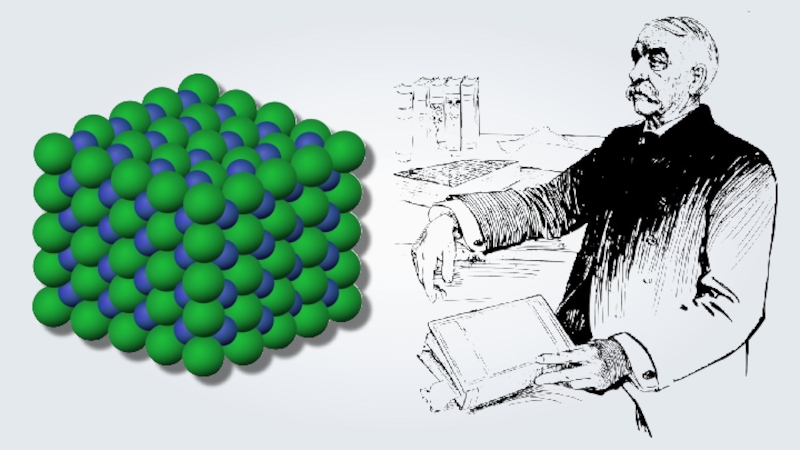
- 13. Майкл ФарадейXIX век — получено представление об образовании ионов в растворах электролитов.
- 14. Сванте Аррениус1877 год — сформулирована теория электролитической диссоциации.
- 15. Электролитическая диссоциация — процесс распада электролита на ионы.
- 16. Иван Алексеевич Каблуков Владимир Александрович Кистяковский
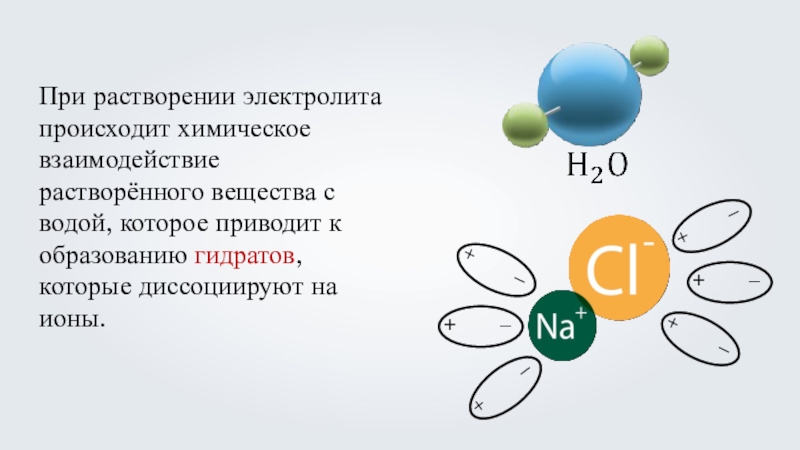
- 17. При растворении электролита происходит химическое взаимодействие растворённого
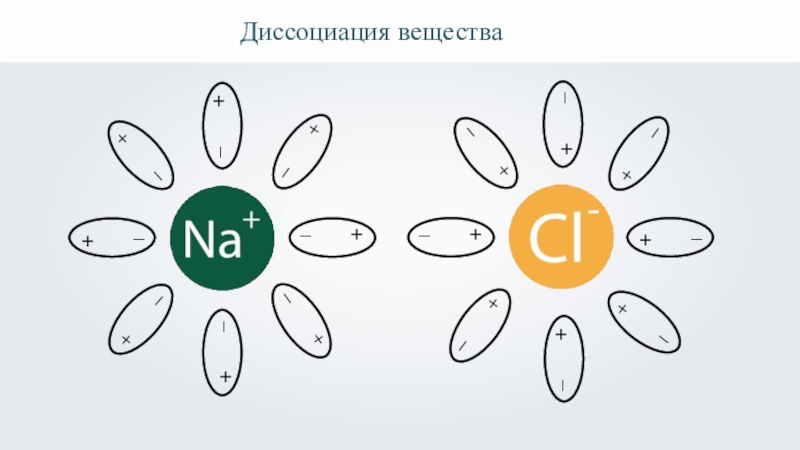
- 18. Диссоциация вещества
- 19. Диссоциация вещества
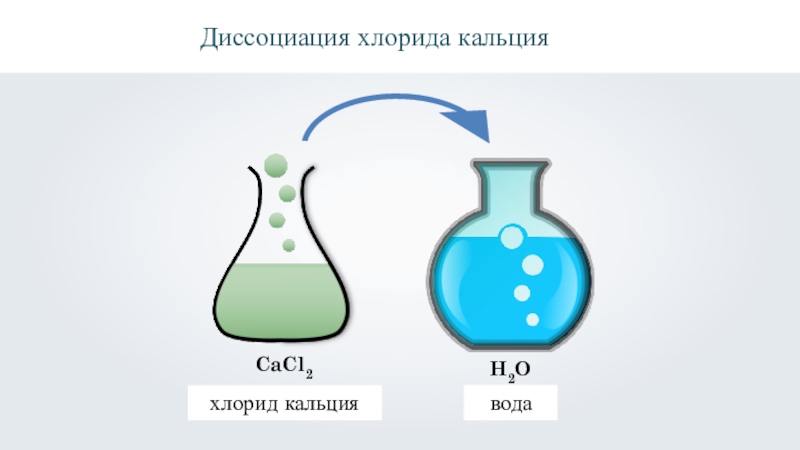
- 20. H2OCaCl2хлорид кальцияводаДиссоциация хлорида кальция
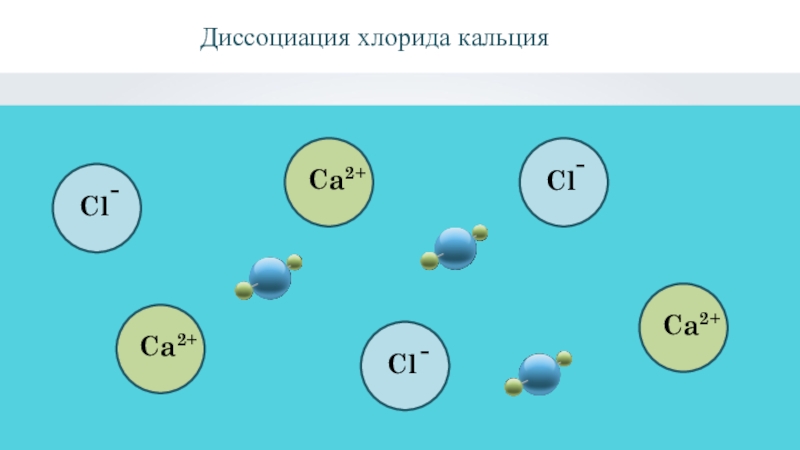
- 21. Диссоциация хлорида кальция- - -
- 22. Процессы при диссоциации веществ в воде1. Ориентация
- 23. CaCl2 = Ca2+ + 2Cl Уравнение диссоциации
- 24. Ассоциация — процесс, при котором хаотически движущиеся гидратированные ионы могут столкнуться и объединиться.
- 25. Степень диссоциации (α) — это отношение количества
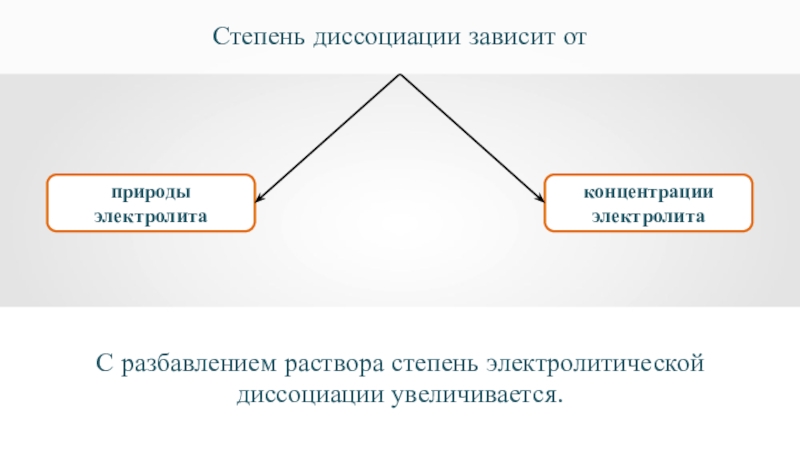
- 26. природы электролитаконцентрации электролитаСтепень диссоциации зависит отС разбавлением раствора степень электролитической диссоциации увеличивается.
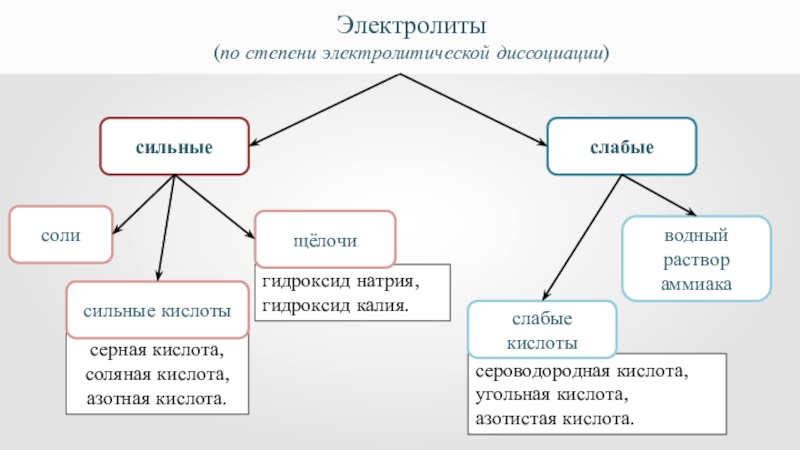
- 27. сильныеслабыеЭлектролиты(по степени электролитической диссоциации)солигидроксид натрия, гидроксид калия.щёлочиводный
- 28. Растворы веществ(по способности проводить электрический ток) электролиты1неэлектролитыRainer Zenzспирткислота
- 29. Электролитическая диссоциация характеризуется степенью диссоциации, в соответствии с которой электролиты разделены на сильные и слабые.
Слайд 3
Растворы веществ
(по способности проводить электрический ток)
электролиты
1
неэлектролиты
Rainer Zenz
спирт
кислота
Слайд 10
Растворы веществ
электролиты
1
неэлектролиты
вещества, растворы которых проводят электрический ток.
вещества, растворы которых не
Слайд 13Майкл Фарадей
XIX век — получено представление об образовании ионов в растворах
Слайд 17При растворении электролита происходит химическое взаимодействие растворённого вещества с водой, которое
Слайд 22
Процессы при диссоциации веществ в воде
1. Ориентация двухполярных молекул воды около
ионов кристалла.
2. Взаимодействие молекул воды с противоположно
заряженными ионами поверхностного слоя
кристалла или гидратация.
3. Распад кристалла электролита
на гидратированные ионы (диссоциация).
Слайд 23CaCl2 = Ca2+ + 2Cl
Уравнение диссоциации хлорида кальция
Каждая частица хлорида
CaCl2
хлорид кальция
-
Слайд 24
Ассоциация — процесс, при котором хаотически движущиеся гидратированные ионы могут столкнуться
Слайд 25
Степень диссоциации (α) — это отношение количества вещества электролита, распавшегося на
a =
n
nр
Д
Слайд 26природы электролита
концентрации электролита
Степень диссоциации зависит от
С разбавлением раствора степень электролитической диссоциации
Слайд 27сильные
слабые
Электролиты
(по степени электролитической диссоциации)
соли
гидроксид натрия, гидроксид калия.
щёлочи
водный раствор аммиака
серная кислота, соляная
сильные кислоты
сероводородная кислота, угольная кислота,
азотистая кислота.
слабые кислоты