- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Подготовка к ОГЭ по химии
Содержание
- 1. Подготовка к ОГЭ по химии
- 2. Элементы содержания, проверяемые заданиями экзаменационной работы
- 3. Описание требований к уровню
- 4. Часть 2 - задания с развернутым
- 5. Этапы формирования умений составлять уравнения реакций ОВРУпражнения
- 6. Степень окисления. Памятка для обучающегосяВ соединениях с.о.
- 7. 4. Степень окисления фтора в соединениях всегда
- 8. Примеры заданийРасставьте с.о. элементов в соединениях:XeF4, CCl4,
- 9. Восстановитель и окислительВосстановитель – это элемент или
- 10. Активные окислителиГалогеныКислородАзот в азотной кислотеСера в серной кислотеЭлементы в высшей положительной степени окисления
- 11. Активные восстановителиМеталлыВодородАзот в аммиакеСера в сероводородеЭлементы в низшей отрицательной степени окисления
- 12. Алгоритм расстановки коэффициентов методом электронного балансаЗаписываем уравнение
- 13. 5. За вертикальной чертой выписываем число отданных
- 14. Взаимодействие простых веществ между собойВ следующих схемах
- 15. Реакции простых веществ со сложными веществамиРасставьте коэффициенты,
- 16. Используя метод электронного баланса, составьте уравнение реакцииОпределите окислитель и восстановитель.H2SO4 + Al → Al2(SO4)3 + S + H2OAg + HClO3 → AgCl + AgClO3 + H2OS + KOH → K2S + K2SO3 + H2OB + HBrO3 + H2O → H3BO3 + HBrCl2 + I2 + H2O→ HIO3 + HClHNO3 + P + H2O → NO + H3PO4
- 17. Реакции между сложными веществамиИспользуя метод электронного баланса,
Элементы содержания, проверяемые заданиями экзаменационной работы Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии. Окислительно-восстановительные реакции. Окислитель и восстановитель.
Слайд 2Элементы содержания, проверяемые заданиями
экзаменационной работы
Классификация химических реакций по различным
признакам: числу и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии. Окислительно-восстановительные реакции. Окислитель и восстановитель.
Слайд 3 Описание требований к уровню
подготовки, достижение которого
проверяется в ходе экзамена
Знать: степень окисления, окислитель и
восстановитель, окисление и восстановление
Уметь: определять валентность и с.о.
элементов в соединении, типы химических
реакций
Объяснять: сущность ОВР
Слайд 4 Часть 2 - задания с развернутым ответом наиболее сложные в
экзаменационной работе.
Выполнение заданий этого вида предполагает сформированность
комплексных умений:
составлять электронный баланс и уравнение
окислительно-восстановительной реакции
Слайд 5Этапы формирования умений составлять уравнения реакций ОВР
Упражнения в расстановке с.о.
Понятие об
окислителях и восстановителях
3. Алгоритм расстановки коэффициентов методом электронного баланса
Типы реакций ОВР
5. Примеры заданий
3. Алгоритм расстановки коэффициентов методом электронного баланса
Типы реакций ОВР
5. Примеры заданий
Слайд 6Степень окисления. Памятка для обучающегося
В соединениях с.о. водорода +1, кроме гидридов
В
соединениях с.о. кислорода -2, кроме пероксидов и фторидов
С.о. металлов в соединениях всегда положительная, для металлов первых 3-х «А» групп постоянна: +1, +2, +3 соответственно
С.о. металлов в соединениях всегда положительная, для металлов первых 3-х «А» групп постоянна: +1, +2, +3 соответственно
Слайд 74. Степень окисления фтора в соединениях всегда -1
5. У свободных атомов
и простых веществ с.о. = 0
6. Суммарная с.о. всех элементов в соединении = 0
Высшая положительная с.о. соответствует номеру группы
8. Низшая отрицательная с.о. находят по формуле: № группы - 8
6. Суммарная с.о. всех элементов в соединении = 0
Высшая положительная с.о. соответствует номеру группы
8. Низшая отрицательная с.о. находят по формуле: № группы - 8
Слайд 8Примеры заданий
Расставьте с.о. элементов в соединениях:
XeF4, CCl4, PCl4, SnS2, CrO3, SbCl3,
Mn2O7,SO2, SO3
KMnO4, Na2Cr2O7, Na2SO3, KClO3, Na2CrO4,
BaMnO4 , NH4ClO4, CHCl3, HClO, Al2(SO4)3
KMnO4, Na2Cr2O7, Na2SO3, KClO3, Na2CrO4,
BaMnO4 , NH4ClO4, CHCl3, HClO, Al2(SO4)3
Слайд 9Восстановитель и окислитель
Восстановитель – это элемент или вещество,
отдающее электроны. Само
оно при этом
окисляется.
Окислитель – это элемент или вещество,
принимающее электроны. Само оно при
этом восстанавливается.
Окислитель Восстановитель
окисляется.
Окислитель – это элемент или вещество,
принимающее электроны. Само оно при
этом восстанавливается.
Окислитель Восстановитель
Слайд 10Активные окислители
Галогены
Кислород
Азот в азотной кислоте
Сера в серной кислоте
Элементы в высшей положительной
степени окисления
Слайд 11Активные восстановители
Металлы
Водород
Азот в аммиаке
Сера в сероводороде
Элементы в низшей отрицательной степени окисления
Слайд 12Алгоритм расстановки коэффициентов методом электронного баланса
Записываем уравнение реакций без коэффициентов
Расставляем с.о.
у каждого атома, входящего в состав веществ
Подчёркиваем атомы элементов, изменивших с.о.
Составляем электронный баланс
Подчёркиваем атомы элементов, изменивших с.о.
Составляем электронный баланс
Слайд 135. За вертикальной чертой выписываем число отданных и принятых электронов
6. Исходя
из наименьшего общего кратного, записываем коэффициенты
7. В уравнение реакции выставляем коэффициенты из схемы электронного баланса
8. Для атомов элементов не участвующих в балансе, расставляем коэффициенты путём подбора
7. В уравнение реакции выставляем коэффициенты из схемы электронного баланса
8. Для атомов элементов не участвующих в балансе, расставляем коэффициенты путём подбора
Слайд 14Взаимодействие простых веществ между собой
В следующих схемах укажите с.о. каждого элемента
и расставьте коэффициенты методом электронного баланса:
Na + Br2 NaBr
N2 + Mg Mg3N2
Допишите уравнения реакций ОВР:
Cl2 + Fe
Al + I2
Na + Br2 NaBr
N2 + Mg Mg3N2
Допишите уравнения реакций ОВР:
Cl2 + Fe
Al + I2
Слайд 15Реакции простых веществ со сложными веществами
Расставьте коэффициенты, используя метод электронного баланса:
NH3
+ O2 N2 + H2O
Al + V2O5 Al2O3 + V
Допишите уравнения реакций ОВР:
С + H2SO4
ZnS + O2
Al + V2O5 Al2O3 + V
Допишите уравнения реакций ОВР:
С + H2SO4
ZnS + O2
Слайд 16Используя метод электронного баланса, составьте уравнение реакции
Определите окислитель и восстановитель.
H2SO4 + Al
→ Al2(SO4)3 + S + H2O
Ag + HClO3 → AgCl + AgClO3 + H2O
S + KOH → K2S + K2SO3 + H2O
B + HBrO3 + H2O → H3BO3 + HBr
Cl2 + I2 + H2O→ HIO3 + HCl
HNO3 + P + H2O → NO + H3PO4
Ag + HClO3 → AgCl + AgClO3 + H2O
S + KOH → K2S + K2SO3 + H2O
B + HBrO3 + H2O → H3BO3 + HBr
Cl2 + I2 + H2O→ HIO3 + HCl
HNO3 + P + H2O → NO + H3PO4
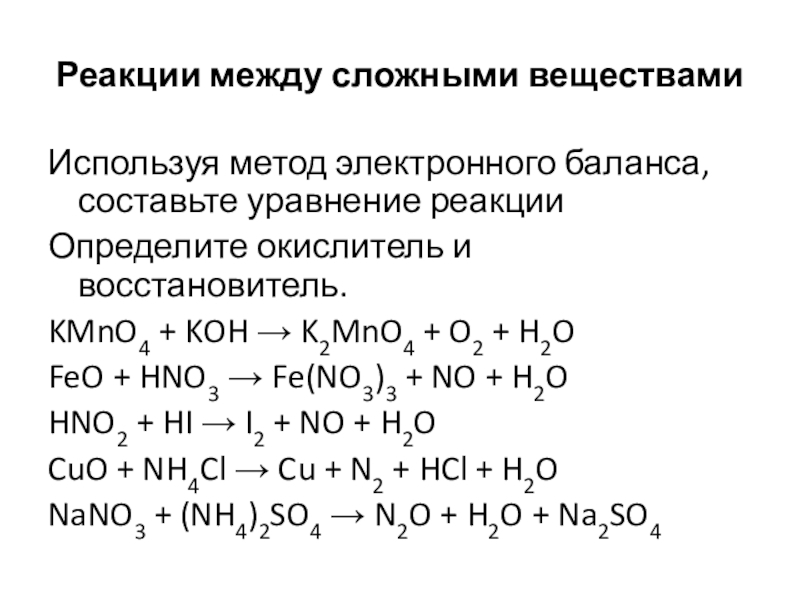
Слайд 17Реакции между сложными веществами
Используя метод электронного баланса, составьте уравнение реакции
Определите окислитель
и восстановитель.
KMnO4 + KOH → K2MnO4 + O2 + H2O
FeO + HNO3 → Fe(NO3)3 + NO + H2O
HNO2 + HI → I2 + NO + H2O
CuO + NH4Cl → Cu + N2 + HCl + H2O
NaNO3 + (NH4)2SO4 → N2O + H2O + Na2SO4
KMnO4 + KOH → K2MnO4 + O2 + H2O
FeO + HNO3 → Fe(NO3)3 + NO + H2O
HNO2 + HI → I2 + NO + H2O
CuO + NH4Cl → Cu + N2 + HCl + H2O
NaNO3 + (NH4)2SO4 → N2O + H2O + Na2SO4