Менделеева. Строение атома. Химическая связь»
Приготовила: учитель химии
МБОУ СОШ № 13 г. Хилок Григорьева М.Л
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Периодический закон
Содержание
- 1. Периодический закон
- 2. Слайд 2
- 3. Цель урока: рассмотреть на примере открытия Периодического закона
- 4. «Первое и главное в жизни – труд
- 5. Сегодня мы с вами, ребята, побываем в
- 6. Слайд 6
- 7. Кем и когда был открыт периодический закон?Где
- 8. Верно ли я даю определения?А) Номер периода
- 9. Какие подтверждения периодического закона, известные ещё при
- 10. Предпосылки открытия Периодического закона Д. И. Менделеевым
- 11. I. Накопление фактологичес-
- 12. II.Работы ученых – предшественников Д.И.Менделеева
- 13. Классификация БерцелиусаНедостатки: групп было всего две и
- 14. Триады ДёберейнераВ 1829 году Деберейнеропубликовал найденныйим «закон
- 15. Триады ДеберейнераНедостатки: удалосьсоставить 5 триад,т. е. использовать только 15 элементов, остальные элементы он классифицироватьне смог.
- 16. Спираль ШанкуртуаВ 1862 году первуюпопытку расположитьэлементы в
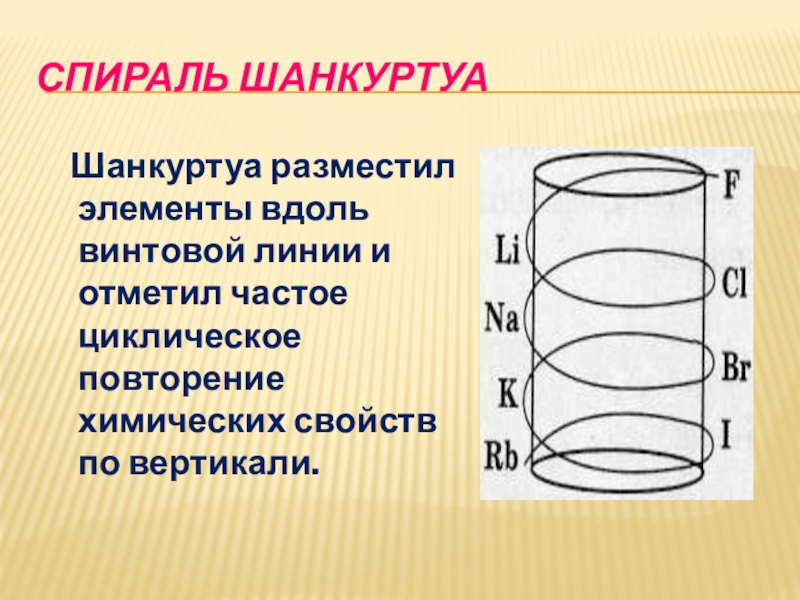
- 17. Спираль Шанкуртуа Шанкуртуа разместил элементы вдоль
- 18. Октавы НьюлендсаВ 1865 году свой вариантпериодической системыпредложил
- 19. Октавы НьюлендсаНедостатки:модель быласкомпрометирова-на настойчивыми попытками автора найти
- 20. Таблица МейераВ этом же десятилетии по-явились ещё
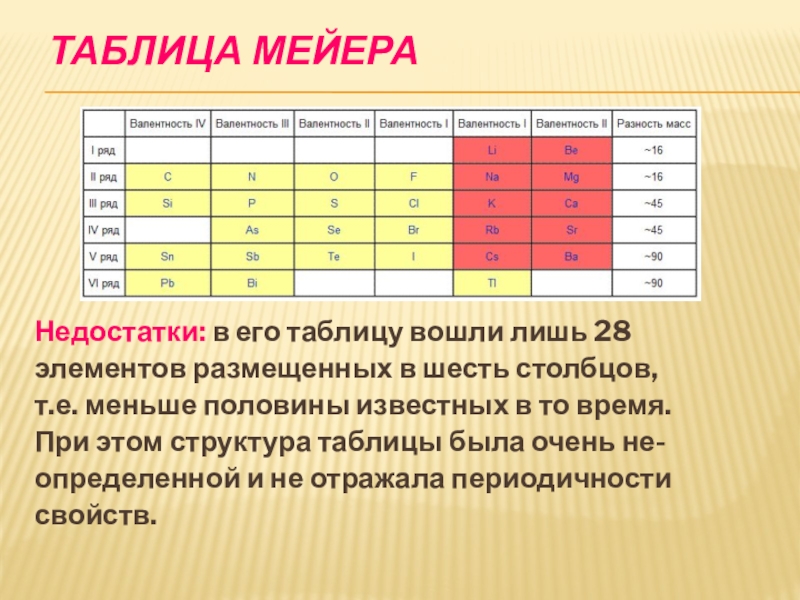
- 21. Таблица МейераНедостатки: в его таблицу вошли лишь
- 22. ВопросВсе ученые, которые занимались поисками естественной классификации
- 23. Личностные качества Д.И.Менделееваэнциклопедичность знаний,научная интуиция,умение обобщать,постоянное стремление к познанию неведомого,дар научного предвидения.
- 24. Первая формулировка Периодического закона1 марта 1869 г.
- 25. Современная формулировка Периодического закона:Свойства химических элементов и
- 26. Слайд 26
- 27. Третья, причинно- следственная формулировка Периодического закона:Свойства химических
- 28. Значение Периодического закона:Периодический закон и Периодическая система
- 29. ПроблемаОдин известный философ назвал открытие Менделеевым Периодического
- 30. Группа американских химиков во главе с Т.
- 31. Все элементы в Периодической системе имеют строго
Цель урока: рассмотреть на примере открытия Периодического закона основные этапы становления научной теории вообще: предпосылки, формулирование обобщения, ее дальнейшее развитие. Повторить основные закономерности горизонтальной, вертикальной и диагональной зависимости свойств химических элементов и образуемых ими веществ в Периодической
Слайд 3Цель урока: рассмотреть на примере открытия Периодического закона основные этапы становления научной
теории вообще: предпосылки, формулирование обобщения, ее дальнейшее развитие. Повторить основные закономерности горизонтальной, вертикальной и диагональной зависимости свойств химических элементов и образуемых ими веществ в Периодической системе в свете строения атома. На основе проблемного подхода формировать у учащихся чувство гордости за отечественную науку.
Тип урока: повторение и закрепление УМ.
Оборудование: Периодическая система химических элементов Д. И. Менделеева, карточки с заданиями, презентация по теме.
Тип урока: повторение и закрепление УМ.
Оборудование: Периодическая система химических элементов Д. И. Менделеева, карточки с заданиями, презентация по теме.
Слайд 4
«Первое и главное в жизни – труд для других» ( Д.
И. Менделеев)
«Периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает» ( Д. И. Менделеев)
«Периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает» ( Д. И. Менделеев)
Слайд 5Сегодня мы с вами, ребята, побываем в удивительной и загадочной стране
«Химия». Много у неё тайн и загадок. Жители этой страны очень разнообразны, порой даже противоречивы по характеру, но все они чтут законы и обычаи своей страны и бережно хранят в памяти имя своего создателя. Сейчас мы проверим, что мы знаем о создателе этой страны.
Слайд 7Кем и когда был открыт периодический закон?
Где родился Д. И. Менделеев?
Кто были его родители?
Где учился Д. И. Менделеев? Кем он хотел стать? Почему ему это не удалось?
Какое высшее учебное заведение окончил Д. И. Менделеев?
В каком году и по какой причине Д. И. Менделеев скончался?
Как читается периодический закон по Д. И. Менделееву?
Современная формулировка периодического закона.
Где учился Д. И. Менделеев? Кем он хотел стать? Почему ему это не удалось?
Какое высшее учебное заведение окончил Д. И. Менделеев?
В каком году и по какой причине Д. И. Менделеев скончался?
Как читается периодический закон по Д. И. Менделееву?
Современная формулировка периодического закона.
Слайд 8Верно ли я даю определения?
А) Номер периода показывает количество электронов на
последнем слое
Б) Номер группы показывает количество электронных слоёв
В) В главной подгруппе находятся элементы и больших и малых периодов.
Г) Порядковый номер это относительная атомная масса.
Б) Номер группы показывает количество электронных слоёв
В) В главной подгруппе находятся элементы и больших и малых периодов.
Г) Порядковый номер это относительная атомная масса.
Слайд 9Какие подтверждения периодического закона, известные ещё при жизни Д. И. Менделеева,
вы знаете?
У Д. И. Менделеева было необычное хобби. Какое?
У Д. И. Менделеева было необычное хобби. Какое?
Слайд 11 I. Накопление фактологичес-
кого материала
Ко
времени открытия Периодического закона было известно 63 химических элемента, описаны состав и свойства их многочисленных соединений.
Слайд 12
II.Работы ученых – предшественников Д.И.Менделеева
Классификация Берцелиуса
Он разделил все элементы
на металлы и
неметаллы на
основе различий в свойствах
образованных ими простых
веществ и соединений.
Йенс Якоб
Берцелиус
(1779 – 1848 гг.)
основе различий в свойствах
образованных ими простых
веществ и соединений.
Йенс Якоб
Берцелиус
(1779 – 1848 гг.)
Слайд 13Классификация Берцелиуса
Недостатки:
групп было всего две и включали они значительно отлича-
ющиеся друг от друга элементы
наличие амфотерных оксидов и гидрокси- дов у некоторых ме- таллов вносило пута- ницу.
наличие амфотерных оксидов и гидрокси- дов у некоторых ме- таллов вносило пута- ницу.
Слайд 14Триады Дёберейнера
В 1829 году Деберейнер
опубликовал найденный
им «закон триад»: атомный
вес многих элементов
бли-
зок к среднему арифмети-
ческому двух других эле-
ментов, близких к исходно-
му по химическим свойст-
вам (стронций, кальций и Иоганн Вольфганг
барий; хлор, бром и йод и Дёберейнер
др.). (1780-1849 гг.)
зок к среднему арифмети-
ческому двух других эле-
ментов, близких к исходно-
му по химическим свойст-
вам (стронций, кальций и Иоганн Вольфганг
барий; хлор, бром и йод и Дёберейнер
др.). (1780-1849 гг.)
Слайд 15Триады Деберейнера
Недостатки: удалось
составить 5 триад,
т. е. использовать
только 15 элементов,
остальные
элементы
он классифицировать
не смог.
он классифицировать
не смог.
Слайд 16Спираль Шанкуртуа
В 1862 году первую
попытку расположить
элементы в порядке
возрастания атомных
весов предпринял
Шанкуртуа.
Александр Эмиль
Шанкуртуа
(1820-1886 гг.)
Шанкуртуа
(1820-1886 гг.)
Слайд 17Спираль Шанкуртуа
Шанкуртуа разместил элементы вдоль винтовой линии и отметил
частое циклическое повторение химических свойств по вертикали.
Слайд 18Октавы Ньюлендса
В 1865 году свой вариант
периодической системы
предложил химик и музы-
кант Джон
Александр
Ньюлендс, модель кото-
рого («закон октав»)
внешне немного напоми-
нала менделеевскую. Джон Александр
Рейна Ньюлендс
(1837-1898 гг.)
Ньюлендс, модель кото-
рого («закон октав»)
внешне немного напоми-
нала менделеевскую. Джон Александр
Рейна Ньюлендс
(1837-1898 гг.)
Слайд 19Октавы Ньюлендса
Недостатки:
модель была
скомпрометирова-
на настойчивыми
попытками автора
найти в таблице
мистическую музы-
кальную
гармонию; при таком расположении
без пропусков исключалась возможность
открытия новых элементов и многие элементы
попадали на несоответствующие им места.
без пропусков исключалась возможность
открытия новых элементов и многие элементы
попадали на несоответствующие им места.
Слайд 20Таблица Мейера
В этом же десятилетии по-
явились ещё несколько по-
пыток систематизации хими-
ческих
элементов; ближе
всего к окончательному ва-
рианту подошёл Мейер
(1864). Он расположил хими-
ческие элементы в порядке
возрастания их атомных Юлиус Лотар
масс. Мейер
(1830-1895 гг)
всего к окончательному ва-
рианту подошёл Мейер
(1864). Он расположил хими-
ческие элементы в порядке
возрастания их атомных Юлиус Лотар
масс. Мейер
(1830-1895 гг)
Слайд 21Таблица Мейера
Недостатки: в его таблицу вошли лишь 28
элементов размещенных в шесть
столбцов,
т.е. меньше половины известных в то время.
При этом структура таблицы была очень не-
определенной и не отражала периодичности
свойств.
т.е. меньше половины известных в то время.
При этом структура таблицы была очень не-
определенной и не отражала периодичности
свойств.
Слайд 22Вопрос
Все ученые, которые занимались поисками естественной классификации химических элементов, находились в
равных условиях, имели одни и те же предпосылки. Почему же ни одному из них, кроме Д. И. Менделеева, не удалось открыть Периодический закон?
Слайд 23 Личностные качества Д.И.Менделеева
энциклопедичность знаний,
научная интуиция,
умение обобщать,
постоянное стремление к познанию неведомого,
дар
научного предвидения.
Слайд 24Первая формулировка Периодического закона
1 марта 1869 г.
«Свойства химических элементов и
образованных ими веществ находятся в периодической зависимости от их относительных атомных масс».
Слайд 25Современная формулировка Периодического закона:
Свойства химических элементов и образованных ими веществ находятся
в Периодической зависимости от заряда их атомных ядер.
Слайд 27Третья, причинно- следственная формулировка Периодического закона:
Свойства химических элементов и образованных ими
веществ находятся в периодической зависимости от изменения внешних электронных структур их атомов.
Слайд 28Значение Периодического закона:
Периодический закон и Периодическая система позволили:
1. установить взаимную связь
между элементами и объединить их по свойствам;
2. расположить элементы в естесственной последовательности;
3. вскрыть периодичность, т. е. повторяемость общих свойств отдельных элементов и их соединений;
4. исправить и уточнить относительные атомные массы отдельных элементов( например, у Be с 13 на 9);
5. исправить и уточнить с. о. отдельных элементов ( например, у Be с +3 на + 2)
6. предсказать и описать свойства, указать путь открытия еще неоткрытых элементов ( триумф Периодического закона и Периодической системы при открытии Ga, Sc, Ge)
2. расположить элементы в естесственной последовательности;
3. вскрыть периодичность, т. е. повторяемость общих свойств отдельных элементов и их соединений;
4. исправить и уточнить относительные атомные массы отдельных элементов( например, у Be с 13 на 9);
5. исправить и уточнить с. о. отдельных элементов ( например, у Be с +3 на + 2)
6. предсказать и описать свойства, указать путь открытия еще неоткрытых элементов ( триумф Периодического закона и Периодической системы при открытии Ga, Sc, Ge)
Слайд 29Проблема
Один известный философ назвал открытие Менделеевым Периодического закона научным подвигом, подобным
подвигу Леверье, который открыл планету Нептун. Почему так эмоционально философ характеризует открытие русского химика- подвигом? Подвиг- смертельный риск во имя великой цели. Чем рисковал Менделеев?
Слайд 30Группа американских химиков во главе с Т. Сиборгом в 1955 г.
получила новый, сто первый элемент, которому в честь величайшего русского химика единодушно присвоили название «Менделевий». А какие еще химические элементы связаны своими названиями с нашей Родиной – Россией?
Слайд 31Все элементы в Периодической системе имеют строго определенное зарядом атомного ядра
местоположение. Другое дело водород: он записан в таблице Менделеева дважды. Почему?