- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Открытый урок по теме: Сера и его соединения (9кл)
Содержание
- 1. Открытый урок по теме: Сера и его соединения (9кл)
- 2. Цель урокаИзучить физические и химические свойства серы
- 3. План урокаСера в природеАтомы серыАллотропия серыФизические свойстваХимические свойства Применение серыСоединения серы
- 4. Исторические сведенияСера известна с глубокой древности и
- 5. Сера в природеКакие природные соединения, содержащие серу, вам известны?
- 6. Сера в природекиноварь HgSхалькопирит CuFeS2галенит PbSпирит FeS2самородная сера Sгипс СаSO4.2H2O
- 7. Общая характеристика серы.1.Химический символ – 2.Порядковый
- 8. Физические свойства серы1.Цвет-желтого цвета2.агрегатное состояние-твердое хрупкое 3.плотность-близка
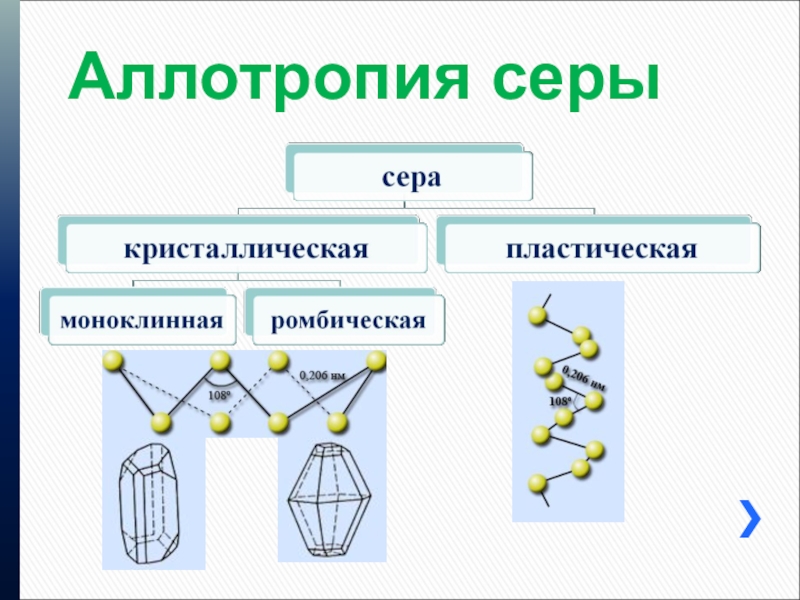
- 9. Аллотропия серы
- 10. Слайд 10
- 11. Слайд 11
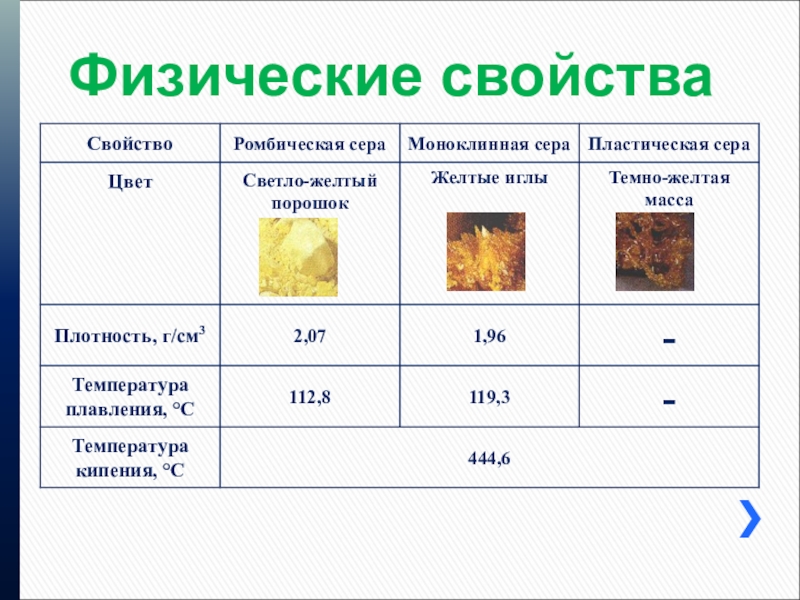
- 12. Физические свойства
- 13. Химические свойства Какими окислительно-восстановительными свойствами обладает сера?
- 14. Химические свойстваСера – окислительСера – восстановительПри взаимодействии
- 15. Сера - окислительS0 + 2ē -> S-21) Сера реагирует со щелочными
- 16. Слайд 16
- 17. Слайд 17
- 18. Сера - восстановитель S - 2ē -> S+2; S - 4ē -> S+4;
- 19. Химические свойстваСера – окислительСера – восстановительЗакончите уравнения
- 20. Химические свойстваСера – окислительСера – восстановительЗакончите уравнения
- 21. Применение серыПроизводство серной кислотыПолучение резиныПолучение гидросульфата кальция
- 22. В 79 г.н.э. в Италии произошло извержение
- 23. H2S-Сероводород – ядовитый, бесцветный газ с характерным
- 24. Слайд 24
- 25. ЗагадкиХоть многие вещества превращает в яд, в
- 26. Рефлексия: Человек рождается на свет,Чтоб творить, дерзать
- 27. Биологическая роль серыСера участвует в ОВР в
- 28. Домашнее заданиеУчебник: 12-13, упр. 3(с54)
Цель урокаИзучить физические и химические свойства серы как простого вещества, Распространение в природе, аллотропные модификации серы и применение.Соединения серы сероводород и сернистый газ.
Слайд 2Цель урока
Изучить физические и химические свойства серы как простого вещества,
Распространение
в природе, аллотропные модификации серы и применение.
Соединения серы сероводород и сернистый газ.
Соединения серы сероводород и сернистый газ.
Слайд 3План урока
Сера в природе
Атомы серы
Аллотропия серы
Физические свойства
Химические свойства
Применение серы
Соединения серы
Слайд 4Исторические сведения
Сера известна с глубокой древности и упоминается Гомером в «Одиссее»
как лекарство от недугов.
В Древнем Египте серу использовали для приготовления красок, косметических средств.
В Древней Греции, сжигая серу, дезинфицировали помещение и вещи.
В Древнем Риме ее использовали для лечения кожных заболеваний.
В средние века сера была одним из «начал» у алхимиков, считалась необходимой составной частью «философского камня».
В Древнем Египте серу использовали для приготовления красок, косметических средств.
В Древней Греции, сжигая серу, дезинфицировали помещение и вещи.
В Древнем Риме ее использовали для лечения кожных заболеваний.
В средние века сера была одним из «начал» у алхимиков, считалась необходимой составной частью «философского камня».
Слайд 6Сера в природе
киноварь HgS
халькопирит CuFeS2
галенит PbS
пирит FeS2
самородная сера S
гипс СаSO4.2H2O
Слайд 7
Общая характеристика серы.
1.Химический символ –
2.Порядковый номер –
3.Относительная атомная масса
–
Расположение в периодической системе:
Номер периода-
Номер группы-
Подгруппа-
Электронная формула строения атома –
Валентность:
Расположение в периодической системе:
Номер периода-
Номер группы-
Подгруппа-
Электронная формула строения атома –
Валентность:
Слайд 8Физические свойства серы
1.Цвет-желтого цвета
2.агрегатное состояние-твердое хрупкое
3.плотность-близка к 2, порошок серы
всплывает, так как не смачивается водой.
Температура плавления-112,8 °C
Температура кипения-444,6 °C
Проводит ли тепло и электричество-плохо проводит теплоту и не проводит электрический ток
Температура плавления-112,8 °C
Температура кипения-444,6 °C
Проводит ли тепло и электричество-плохо проводит теплоту и не проводит электрический ток
Слайд 14Химические свойства
Сера – окислитель
Сера – восстановитель
При взаимодействии с какими веществами сера
проявляет окислительные, а с какими – восстановительные свойства?
Слайд 15Сера - окислитель
S0 + 2ē -> S-2
1) Сера реагирует со щелочными металлами без нагревания:
2Na + S -> Na2S ОПЫТ
c остальными металлами
(кроме Au,Pt) - при повышенной t°:
2Al + 3S –t°-> Al2S3
Zn + S –t°-> ZnS ОПЫТ
Cu + S –t°-> CuS ОПЫТ
2) С некоторыми неметаллами сера образует бинарные соединения:
H2 + S -> H2S
C + 2S -> CS2
2Al + 3S –t°-> Al2S3
Zn + S –t°-> ZnS ОПЫТ
Cu + S –t°-> CuS ОПЫТ
2) С некоторыми неметаллами сера образует бинарные соединения:
H2 + S -> H2S
C + 2S -> CS2
Слайд 18Сера - восстановитель
S - 2ē -> S+2; S - 4ē -> S+4; S - 6ē ->S+6
1) c кислородом:
S +
O2 –t°-> S+4O2
2S + 3O2 –t°;pt-> 2S+6O3
2) c галогенами (кроме йода):
S + Cl2 -> S+2Cl2
3) c кислотами - окислителями:
S + 2H2SO4(конц) -> 3S+4O2 + 2H2O
2S + 3O2 –t°;pt-> 2S+6O3
2) c галогенами (кроме йода):
S + Cl2 -> S+2Cl2
3) c кислотами - окислителями:
S + 2H2SO4(конц) -> 3S+4O2 + 2H2O
Слайд 19Химические свойства
Сера – окислитель
Сера – восстановитель
Закончите уравнения реакций:
S + H2
=
S + Na =
S + Fe =
S + Hg =
S + Na =
S + Fe =
S + Hg =
S + O2 =
S + F2 =
Слайд 20Химические свойства
Сера – окислитель
Сера – восстановитель
Закончите уравнения реакций:
S + H2
=
S + Na =
S + Fe =
S + Hg =
S + Na =
S + Fe =
S + Hg =
S + O2 =
S + F2 =
H2S
SF6
SO2
Na2S
FeS
HgS
3
2
Слайд 21Применение серы
Производство серной кислоты
Получение резины
Получение гидросульфата кальция (для производства бумаги)
Производство пороха,
пиротехники
Получение «сусального золота» – SnS2
В медицине для лечения кожных заболеваний
В сельском хозяйстве для борьбы с вредителями
Получение «сусального золота» – SnS2
В медицине для лечения кожных заболеваний
В сельском хозяйстве для борьбы с вредителями
Слайд 22
В 79 г.н.э. в Италии произошло извержение вулкана Везувия. Лава залила
соседние города Помпеи, Геркуланум и Стабию и законсервировала их на века. При этом погибло 2 тысячи жителей. Это произошло так быстро, что многие из них не успели даже покинуть свои дома. Одной из причин гибели людей стало удушающее действие сернистого газа и сероводорода, обильно выделявшиеся из жерла вулкана.
Что произошло с точки зрения химии? Напишите уравнения реакций
Что произошло с точки зрения химии? Напишите уравнения реакций
Слайд 23H2S-Сероводород – ядовитый, бесцветный газ с характерным запахом гниющего белка, плохо
растворяется в воде.
SO2 - оксид серы (IV)(сернистый газ), бесцветный газ с резким запахом.
SO2 - оксид серы (IV)(сернистый газ), бесцветный газ с резким запахом.
Слайд 25Загадки
Хоть многие вещества превращает в яд, в химии она достойна всяческих
наград
Подмигнув лиловым глазом, сера сразу стала газом.
Подмигнув лиловым глазом, сера сразу стала газом.
Слайд 26Рефлексия:
Человек рождается на свет,
Чтоб творить, дерзать – и не иначе,
Чтоб оставить
в жизни добрый след
И решить все трудные задачи. Человек рождается на свет…Для чего?
Ищите свой ответ.
И решить все трудные задачи. Человек рождается на свет…Для чего?
Ищите свой ответ.
Слайд 27Биологическая роль серы
Сера участвует в ОВР в организмах растений и животных
Сера
входит в состав белков и аминокислот
Особенно много серы в волосах, шерсти, рогах, копытах
Соединения серы обнаружены в хрящах, костях, в желчи
Особенно много серы в волосах, шерсти, рогах, копытах
Соединения серы обнаружены в хрящах, костях, в желчи