- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Основные положения ТЭД
Содержание
- 1. Основные положения ТЭД
- 2. Расскажите о последовательности процессов, происходящих при
- 3. История открытия теории электролитической диссоциации В
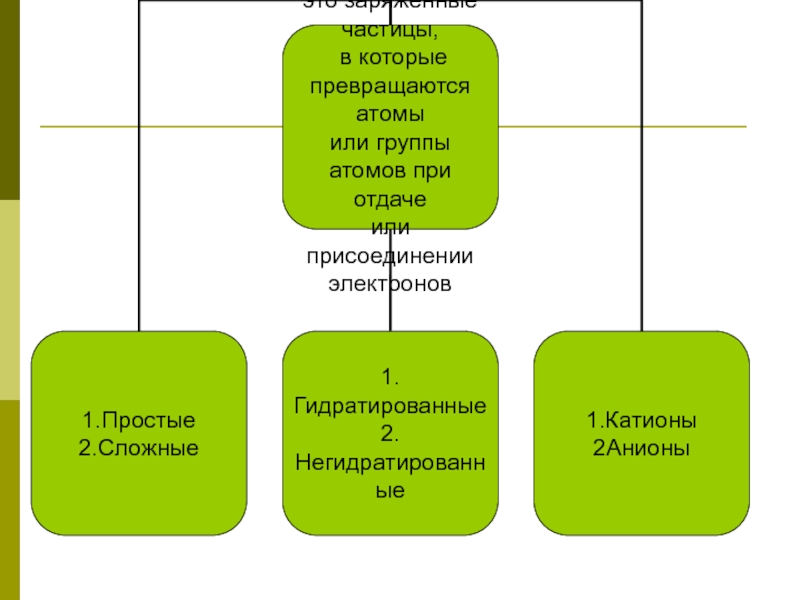
- 4. Положение ТЭД №1Вещества, растворы или расплавы которых
- 5. Положение ТЭД №2Процесс распада электролита на ионы
- 6. Слайд 6
- 7. Положение №3При растворении в воде веществ с
- 8. Положение ТЭД №4Под действием электрического тока положительно
- 9. Положение ТЭД №5Не все электролиты в равной
- 10. Положение ТЭД №6Химические свойства растворов электролитов определяются
- 11. Выводы> по способности к распаду на ионы
Слайд 2Расскажите о последовательности процессов,
происходящих при диссоциации:
Веществ с ионной связью
Ориентация
Гидратация
Диссоциация
Веществ
Ориентация
Гидратация
Ионизация
Диссоциация
Слайд 3История открытия теории электролитической диссоциации
В 1887 году шведский химик
Слайд 4Положение ТЭД №1
Вещества, растворы или расплавы которых проводят электрический ток, называются
Вещества, растворы или расплавы которых не проводят электрический ток, называются неэлектролитами. К неэлектролитам относятся оксиды, растворы сахара, глюкозы и многих других органических веществ.
Положение ТЭД №1: Вещества по их способности проводить ток в растворах делят на -----------и -------------.
Слайд 5Положение ТЭД №2
Процесс распада электролита на ионы называется электролитической диссоциацией.
NaCl →
Создаются условия для возникновения электрического тока – направленного движения заряженных частиц, (рисунок: распад хлорида натрия в воде)
Сванте Аррениус в 1877 году пришёл к выводу, что причиной электропроводности является наличие в растворе заряженных частиц – ионов, которые образуются при растворении электролита в воде.
Русские учёные И.А. Каблуков и В.А. Кистяковский, обобщив работы С. Аррениуса и труды Д.И. Менделеева по растворам, предложили современную теорию электролитической диссоциации.
При растворении в воде или расплавлении электролиты диссоциируют (распадаются) на положительные и отрицательные ионы:
MgCl2 →Mg2++2Cl-
В растворах электролиты ------------(распадаются) на ------------- и ------------- ----.
Слайд 7Положение №3
При растворении в воде веществ с ковалентной сильнополярной связью, например,
HCl → H++ Cl-
(кино механизм диссоциации кислот)
Причиной диссоциации электролита в водных растворах является его гидратация, т.е. взаимодействие с молекулами воды. Свойства гидратированных и негидратированных ионов отличаются. Так все растворы солей меди голубого цвета, он определяется гидратированными ионами меди.
CuCl2 → Cu2+ + 2Cl-
CuSO4 → Cu2+ + SO42-
Cu(NO3)2 →Cu2+ + 2NO3-
Причиной диссоциации в водных растворах является его взаимодействие с молекулами , т.е. его
Слайд 8Положение ТЭД №4
Под действием электрического тока положительно заряженные ионы движутся к
Примеры катионов: Na+, Cu2+, NH4+, анионов: Cl-, SO42-, OH-.
Под действием электрического тока положительные ионы (-------) движутся к катоду, а отрицательные (------) ─ к аноду.
Слайд 9Положение ТЭД №5
Не все электролиты в равной мере диссоциируют на ионы.
α = n/N,
где n – число диссоциированных молекул, N – общее число молекул в растворе.
Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы. У них α стремится к единице. К сильным электролитам относятся: все растворимые соли, кислоты H2SO4, HNO3, HCl, все щелочи.
Слабые электролиты при растворении в воде почти не диссоциируют на ионы. У них α стремится к нулю. К слабым электролитам относятся: слабые кислоты – H2S, H2CO3, H2SO3, HNO2, NH3 ·H2O, вода.
Электролитическая диссоциация для слабых электролитов обратима. Поэтому в уравнениях диссоциации сильных электролитов пишут знак равенства, а в уравнениях слабых электролитов знак обратимости процесса.
NaOH = Na+ + OH-
слабый электролит
HF<=> H+ + F-
сильный электролит
Не все в одинаковой мере диссоциируют на .
Слайд 10Положение ТЭД №6
Химические свойства растворов электролитов определяются свойствами ионов, находящихся в
HNO3 = H+ + NO3-
Многоосновные кислоты диссоциируют ступенчато, причем для сильных кислот диссоциация обратима, начиная со второй ступени:
H2SO4 = H+ + HSO4-
HSO4-⬄ H+ + SO42-
Все растворимые основания в водных растворах диссоциируют на катионы металлов и анионы гидроксогрупп ОН-
NaOH = Na+ + OH-
Гидроксиды двухвалентных металлов диссоциируют ступенчато, причем необратимо только по первой ступени:
Ba(OH)2=BaOH-+ OH-
BaOH-↔Ba2++ OH-
Растворимые средние соли в водных растворах диссоциируют на катионы металла и анионы кислотного остатка. В отличие от многоосновных кислот и оснований, содержащих несколько гидроксид-ионов, такие соли, как NaSO4, AlCl3 диссоциируют сразу полностью, а не ступенчато
NaSO4 = 2Na+ + Cl-
AlCl3 = Al3+ + 3Cl-
Растворимые кислые соли в водных растворах диссоциируют на катионы металла и водорода и анионы кислотного остатка.
Диссоциация происходит ступенчато:
NaHSO4 = Na+ + HSO4-
HSO4- ↔ H+ + SO42-
Свойства растворов электролитов определяются свойствами тех -----, которые они образуют при -----------.
Слайд 11Выводы
> по способности к распаду на ионы – диссоциации –вещества делятся
> для объяснения физико-химических явлений в растворах электролитов используется теория электролитической диссоциации;
> в зависимости от полюса, к которому движутся ионы при пропускании электрического тока, они называются катионами и анионами
> электролиты бывают сильные и слабые
> электролитическая диссоциация слабых электролитов обратима;
> свойства растворов электролитов определяются свойствами ионов, находящихся в растворе.