- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Амфотерные соединения в неорганической химии
Содержание
- 1. Презентация по химии на тему Амфотерные соединения в неорганической химии
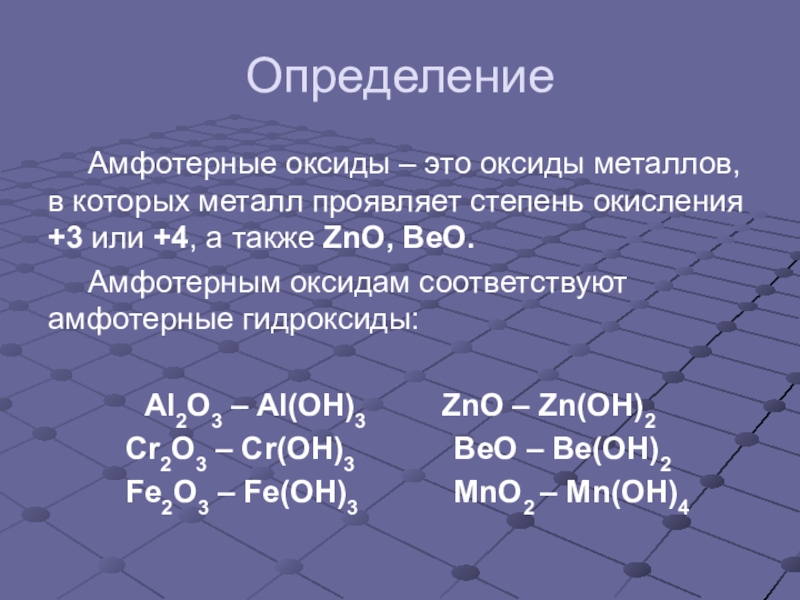
- 2. ОпределениеАмфотерные оксиды – это оксиды металлов, в
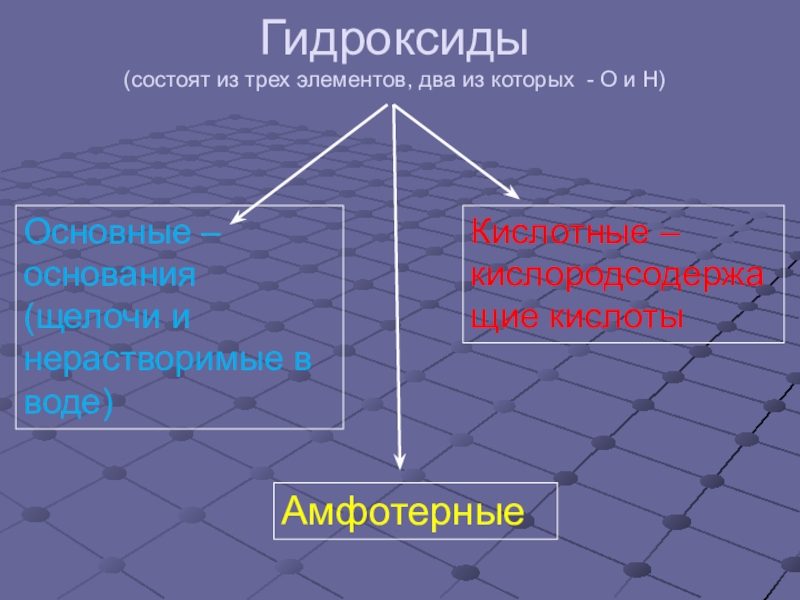
- 3. Гидроксиды (состоят из трех элементов, два из
- 4. Что мы знаем о противоположных по свойствам
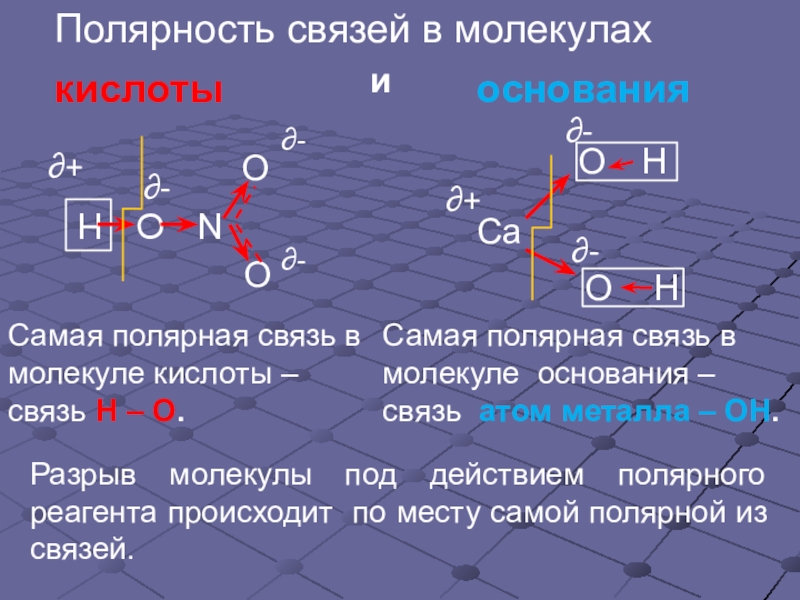
- 5. ∂+∂-∂-Самая полярная связь в молекуле основания –
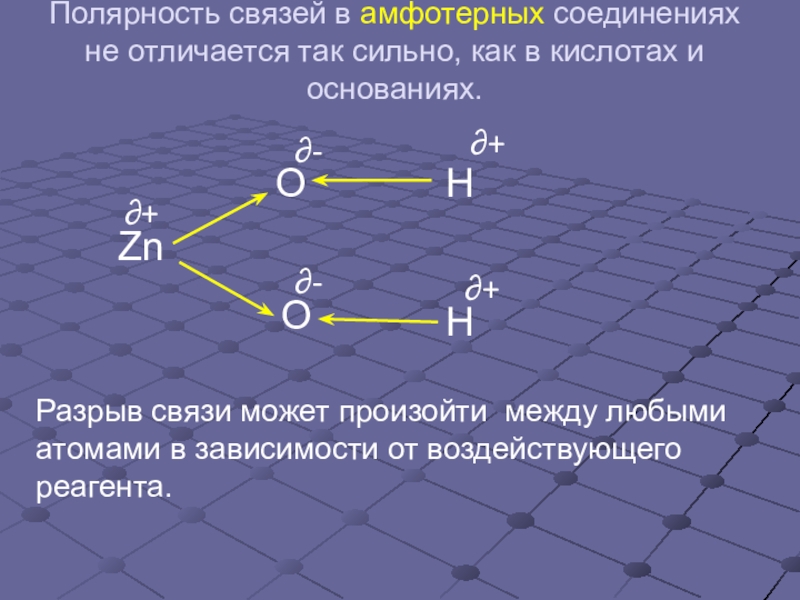
- 6. Полярность связей в амфотерных соединениях не отличается
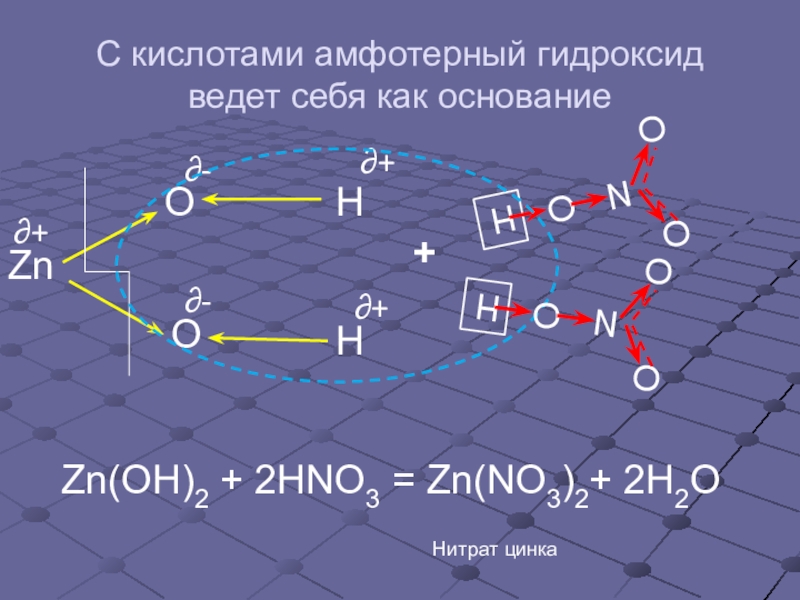
- 7. С кислотами амфотерный гидроксид ведет себя как основание+Zn(OH)2 + 2HNO3 = Zn(NO3)2+ 2H2OНитрат цинка
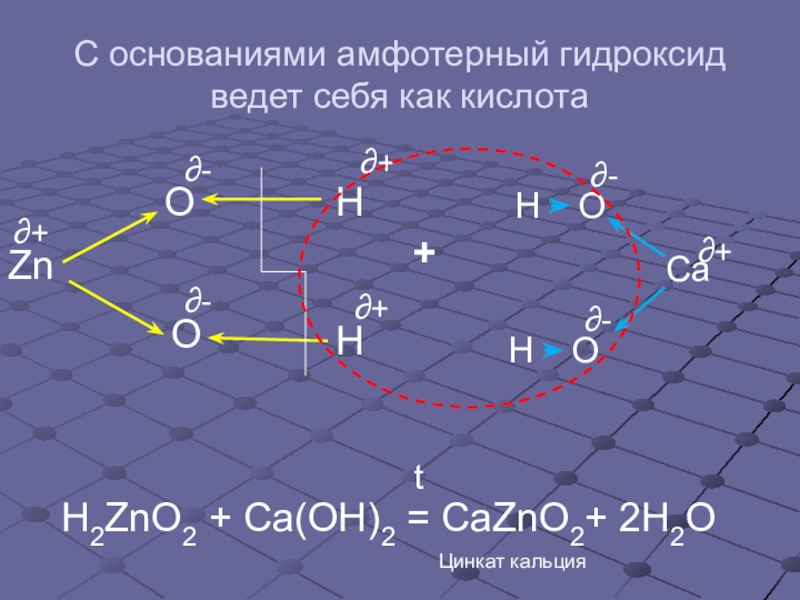
- 8. С основаниями амфотерный гидроксид ведет себя как кислота+H2ZnO2 + Сa(OH)2 = CaZnO2+ 2H2OCaOOHH∂-∂-∂+tЦинкат кальция
- 9. Кислоты не взаимодействуют с другими кислотами.Основания не
- 10. Задание ОГЭИ с гидроксидом калия, и с серной кислотой реагирует 1) оксид натрия 2) хлорид натрия 3) гидроксид кальция 4) гидроксид алюминия
- 11. Гидроксид цинка реагирует с 1) NaOH 2) PbS 3) NaCl 4) Pb(OH)2
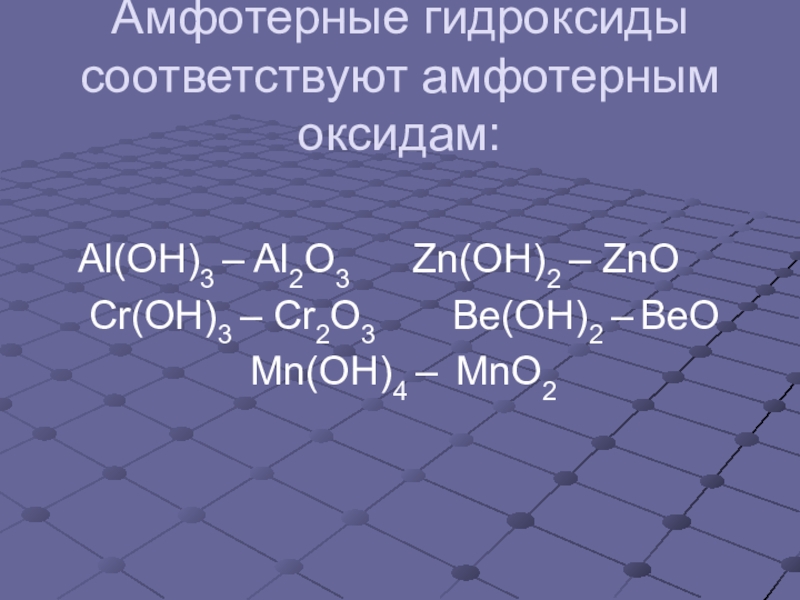
- 12. Амфотерные гидроксиды соответствуют амфотерным оксидам: Al(OH)3
- 13. Амфотерные оксиды вступают в реакции с теми
- 14. Zn(OH)2 + N2O5 = Zn(NO3)2+ H2OZnO +
- 15. В растворах щелочей амфотерные соединения образуют комплексные
- 16. Амфотерные металлы реагируют с растворами щелочей ,
- 17. Некоторые металлы и их соединения проявляют двойственные
- 18. Реакции алюминия и его амфотерных соединений2Al +
- 19. Реакции амфотерных соединений алюминия в растворахAl(ОН)3 +
- 20. Задания на выбор одного верного ответа
- 21. И с раствором гидроксида
- 22. С соляной кислотой реагируют каждый из двух
- 23. С каким из указанных веществ вступает в реакцию оксид цинкаK2SO4O2Na2OCu(OH)2
- 24. Оцените правильность следующих суждений:А) Гидроксиды по свойствам
- 25. Гидроксид натрия реагирует со всеми веществами ряда:*1)
- 26. С гидроксидом алюминия не реагирует раствор 1)
- 27. Каждое из перечисленных веществ: CuCl2, SO3, H3PO4,
- 28. Каждое из перечисленных веществ: CuCl2, SO3, H3PO4,
- 29. При действии избытка раствора гидроксида
- 30. Исходные вещества А) Al + NaOH +
- 31. Спасибо за внимание!
Слайд 2Определение
Амфотерные оксиды – это оксиды металлов, в которых металл проявляет степень
Амфотерным оксидам соответствуют амфотерные гидроксиды:
Al2O3 – Al(OH)3 ZnO – Zn(OH)2
Cr2O3 – Cr(OH)3 BeO – Be(OH)2
Fe2O3 – Fe(OH)3 MnO2 – Mn(OH)4
Слайд 3Гидроксиды
(состоят из трех элементов, два из которых - О и Н)
Основные
Кислотные –кислородсодержащие кислоты
Амфотерные
Слайд 4Что мы знаем о противоположных по свойствам гидроксидах?
Кислоты –соединения, в химических
Основания – соединения, в химических реакциях обычно отдающие гидроксид-ион (ОН-).
(Вступающие в реакцию с протоном)
2НNO3 + Ca(OH)2 = Ca(NO3)2 + 2H2O
Кислоты и основания всегда взаимодействуют друг с другом, образуя соль и воду.
Слайд 5∂+
∂-
∂-
Самая полярная связь в молекуле основания – связь атом металла –
Разрыв молекулы под действием полярного реагента происходит по месту самой полярной из связей.
∂-
Самая полярная связь в молекуле кислоты – связь Н – О.
Полярность связей в молекулах
кислоты
и
основания
Слайд 6Полярность связей в амфотерных соединениях не отличается так сильно, как в
Разрыв связи может произойти между любыми атомами в зависимости от воздействующего реагента.
Слайд 7С кислотами амфотерный гидроксид ведет себя как основание
+
Zn(OH)2 + 2HNO3 =
Нитрат цинка
Слайд 8С основаниями амфотерный гидроксид ведет себя как кислота
+
H2ZnO2 + Сa(OH)2 =
Ca
O
O
H
H
∂-
∂-
∂+
t
Цинкат кальция
Слайд 9Кислоты не взаимодействуют с другими кислотами.
Основания не реагируют с другими основаниями.
Амфотерные
Слайд 10Задание ОГЭ
И с гидроксидом калия, и с серной кислотой реагирует
1) оксид натрия
2) хлорид
3) гидроксид кальция
4) гидроксид алюминия
Слайд 12Амфотерные гидроксиды соответствуют амфотерным оксидам:
Al(OH)3 – Al2O3
Cr(OH)3 – Cr2O3 Be(OH)2 – BeO
Mn(OH)4 – MnO2
Слайд 13Амфотерные оксиды вступают в реакции с теми же веществами, что и
Zn(OH)2 + 2HNO3 = Zn(NO3)2+ 2H2O
ZnO + 2HNO3 = Zn(NO3)2+ H2O
H2ZnO2 + Сa(OH)2 = CaZnO2+ 2H2O
ZnO + Сa(OH)2 = CaZnO2+ H2O
сплавление
сплавление
Слайд 14Zn(OH)2 + N2O5 = Zn(NO3)2+ H2O
ZnO + N2O5 = Zn(NO3)2
H2ZnO2 +
ZnO + СaO = CaZnO2
сплавление
Амфотерные соединения вступают в реакции как с кислотными, так и основными оксидами
сплавление
Слайд 15В растворах щелочей амфотерные соединения образуют комплексные соли
Zn(OН)2 + 2NaOH= Na2[Zn(OH)4]
ZnO
тетрагидроцинкат натрия
Слайд 16Амфотерные металлы реагируют с растворами щелочей , образуя комплексные соли и
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Амфотерные металлы реагируют с растворами кислот , образуя соли и водород.
Zn + 2HCl = ZnCl2 + H2↑
Слайд 17Некоторые металлы и их соединения проявляют двойственные свойства. Они вступают в реакции
Слайд 18Реакции алюминия и его амфотерных соединений
2Al + 2NaOH + 6H2O =
2Al + 6HCl = 2AlCl3 +3H2↑
Al(OH)3 + NaOH = NaAlO2+ 2H2O, т.к.
сплавление
Al(OH)3 = H3AlO3 = HAlO2 + H2O
t
ортоалюминиевая кислота
метаалюминиевая кислота
метаалюминат натрия
Al2O3 + 2NaOH = 2NaAlO2+ H2O
сплавление
Слайд 19Реакции амфотерных соединений алюминия в растворах
Al(ОН)3 + NaOH = Na[Al(OH)4]
Al2О3
Al2О3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Al(ОH)3 + 3HCl = AlCl3 + 3H2O
Слайд 21 И с раствором гидроксида натрия и с серной
1) ВаO
2) Cr2O3
3) SiO2
4) MgO
Слайд 22С соляной кислотой реагируют каждый из двух оксидов*
1) K2O и SO3
2)
3) CO2 и ZnO
4) CrO3 и Na2O
*Степень окисления амфотерного оксида не может превышать +4. Оксиды металлов со степенями окисления +5,+6,+7 - кислотные оксиды.
Слайд 24Оцените правильность следующих суждений:
А) Гидроксиды по свойствам делятся на кислоты, основания
Б) Гидроксиды элементов главных подгрупп первой и второй групп Периодической системы – растворимые основания (щелочи).*
1)верно только А
2)верно только Б
3)верны оба суждения
4)оба суждения неверны
* Проверьте по таблице растворимости это утверждение
Слайд 25Гидроксид натрия реагирует со всеми веществами ряда:*
1) Zn, Na 2CO3, CuO
2)
3) SO3, H3PO 4, AI2O3
4) SO3, MgO, H3PO4
* Чтобы исключить ряд, достаточно найти в нем хотя бы одно не реагирующее с NaOH вещество.
Слайд 26С гидроксидом алюминия не реагирует раствор
1) азотной кислоты
2) гидроксида
3) соляной кислоты
4) сульфата натрия
Слайд 27Каждое из перечисленных веществ: CuCl2, SO3, H3PO4, Zn(OH)2
реагирует с
1)серной кислотой
2) водой
3)гидроксидом натрия
4)оксидом углерода(VI)
Слайд 28Каждое из перечисленных веществ: CuCl2, SO3, H3PO4, Zn(OH)2
реагирует с
1)серной кислотой
2) водой
3)гидроксидом натрия
4)оксидом углерода(VI)
Слайд 29 При действии избытка раствора гидроксида натрия на раствор сульфата
1) ZnO
2) Zn(OH)2
3) Na2ZnO2
4)Na2[Zn(OH)4]
Слайд 30Исходные вещества
А) Al + NaOH + H2O
Б) Al2O3+ +NaOH(сплавление)
В) Al2O3+NaOH+H2O
Г)
Продукты реакции
1) Na[Al(OH)4]
2) Al(OH)3+ Na2O
3) Na[Al(OH)4] + H2
4) NaAlO2+ H2O
5) NaAlO2
6) NaAlO2+ H2







![Презентация по химии на тему Амфотерные соединения в неорганической химии В растворах щелочей амфотерные соединения образуют комплексные солиZn(OН)2 + 2NaOH= Na2[Zn(OH)4]ZnO В растворах щелочей амфотерные соединения образуют комплексные солиZn(OН)2 + 2NaOH= Na2[Zn(OH)4]ZnO + 2NaOH + H2O = Na2[Zn(OH)4]тетрагидроцинкат](/img/tmb/5/468055/dec9b9300f3dacfa154e72bb56a9ea3f-800x.jpg)


![Презентация по химии на тему Амфотерные соединения в неорганической химии Реакции алюминия и его амфотерных соединений2Al + 2NaOH + 6H2O = Реакции алюминия и его амфотерных соединений2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑2Al + 6HCl =](/img/thumbs/979339d3554fb5fe4e79872947df2e62-800x.jpg)
![Презентация по химии на тему Амфотерные соединения в неорганической химии Реакции амфотерных соединений алюминия в растворахAl(ОН)3 + NaOH = Na[Al(OH)4] Al2О3 Реакции амфотерных соединений алюминия в растворахAl(ОН)3 + NaOH = Na[Al(OH)4] Al2О3 + 6HCl = 2AlCl3 + 3H2OAl2О3](/img/thumbs/ca060dc6e9ed253daa3766a5e4c90762-800x.jpg)










![Презентация по химии на тему Амфотерные соединения в неорганической химии Исходные вещества А) Al + NaOH + H2OБ) Al2O3+ +NaOH(сплавление)В) Al2O3+NaOH+H2OГ) Исходные вещества А) Al + NaOH + H2OБ) Al2O3+ +NaOH(сплавление)В) Al2O3+NaOH+H2OГ) Al(OH)3+ NaOHПродукты реакции1) Na[Al(OH)4]2) Al(OH)3+ Na2O3)](/img/tmb/5/468055/ee29f845796da5449468f7714c829c2b-800x.jpg)






