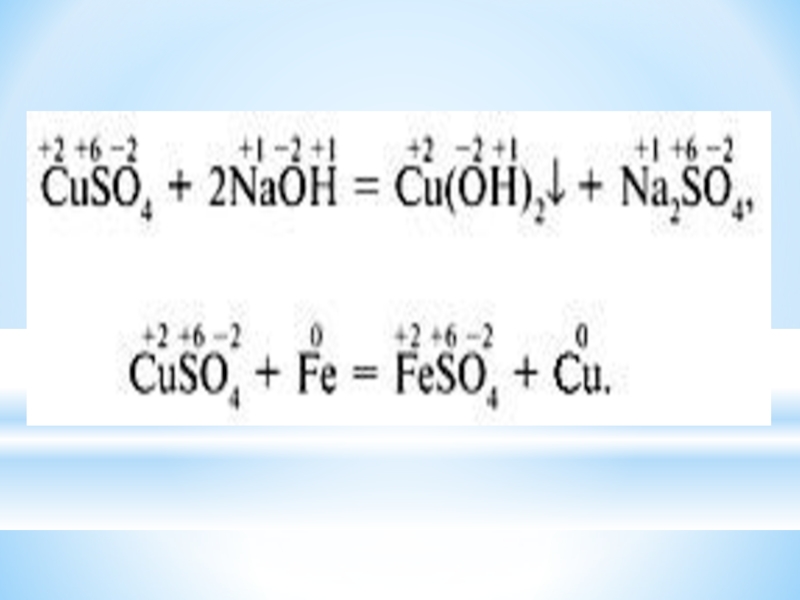- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Окислительно - востановительные реакции
Содержание
- 1. Окислительно - востановительные реакции
- 2. Слайд 2
- 3. Реакции, в результате которых изменяются степени окисления
- 4. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом.Например:S +
- 5. CuS+HNO3→Cu(NO3)2+ S + NO+H2O1. Запишем уравнение реакции2.
- 6. 4. Выпишем те элементы, которые поменяли степени
- 7. Подставим в уравнение коэффициенты, найденные в балансе
- 8. 8. По кислороду проверим правильность составления
- 9. Алгоритм составления уравнений ОВР методом электронного баланса:Составить
- 10. Определить, какой элемент окисляется, (его степень окисления
- 11. Сбалансировать число электронов между окислителем и восстановителем.Определить
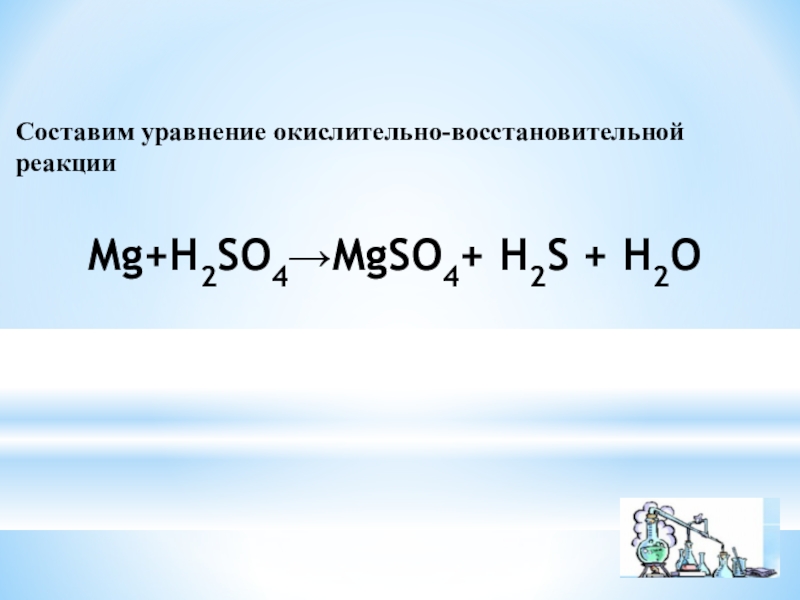
- 12. Составим уравнение окислительно-восстановительной реакцииMg+H2SO4→MgSO4+ H2S + H2O
- 13. Составим уравнение окислительно-восстановительной реакцииMg+H2SO4→MgSO4+ H2S + H2O4Mg0+5H2+1
- 14. Написать уравнение окислительно – восстановительных реакций, расставить
Слайд 3Реакции, в результате которых изменяются степени окисления элементов, входящих в состав
Окислением называется процесс отдачи электронов атомом, молекулой или ионом.
Например:
Al – 3e- = Al3+
Fe2+ - e- = Fe3+
H2 – 2e- = 2H+
2Cl- - 2e- = Cl2
При окислении степень окисления повышается.
Слайд 4Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом.
Например:
S + 2е- = S2-
Сl2 + 2е- = 2Сl-
Fe3+ + e-
При восстановлении степень окисления понижается
Атомы, молекулы или ионы, отдающие электроны называются восстановителями.
Во время реакции они окисляются.
Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями.
Во время реакции они восстанавливаются.
Слайд 5CuS+HNO3→Cu(NO3)2+ S + NO+H2O
1. Запишем уравнение реакции
2. Расставим степени окисления всех
Cu+2S-2 +H+1N+5O-23→Cu+2(N+5O-23)-12+ S0 + N+2O-2+H+12O-2
3. Выделим элементы, которые поменяли степени окисления
Cu+2S-2 +H+1N+5O-23→Cu+2(N+5O-23)-12+ S0 + N+2O-2+H+12O-2
Видим, что в результате реакции поменяли степени окисления два элемента –
сера (S) поменяла полностью (от – 2 до 0)
aзот (N) поменял частично (от +5 до +2 поменял), часть осталась +5
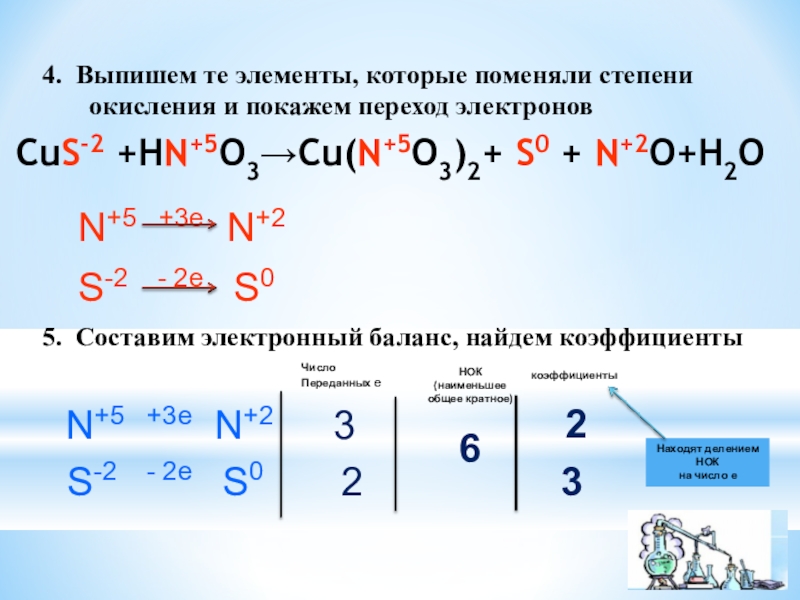
Слайд 64. Выпишем те элементы, которые поменяли степени
CuS-2 +HN+5O3→Cu(N+5O3)2+ S0 + N+2O+H2O
N+5 +3e N+2
S-2 - 2e S0
5. Составим электронный баланс, найдем коэффициенты
N+5 +3e N+2 3
S-2 - 2e S0 2
Число
Переданных е
НОК
(наименьшее
общее кратное)
6
коэффициенты
Находят делением
НОК
на число е
2
3
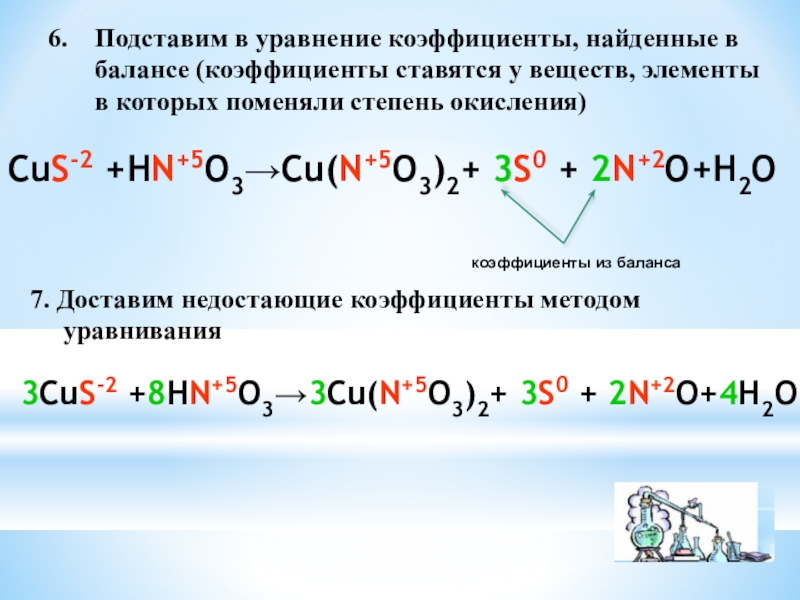
Слайд 7Подставим в уравнение коэффициенты, найденные в балансе (коэффициенты ставятся у веществ,
CuS-2 +HN+5O3→Cu(N+5O3)2+ 3S0 + 2N+2O+H2O
коэффициенты из баланса
7. Доставим недостающие коэффициенты методом
уравнивания
3CuS-2 +8HN+5O3→3Cu(N+5O3)2+ 3S0 + 2N+2O+4H2O
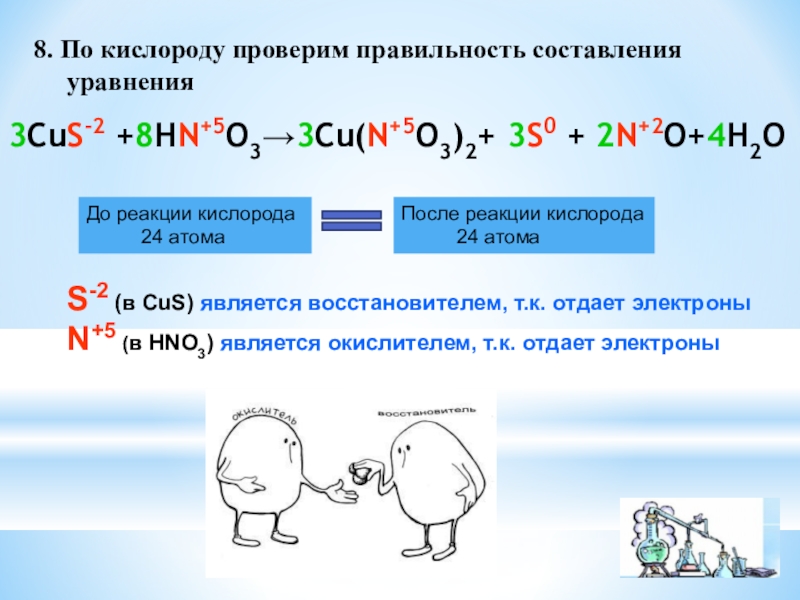
Слайд 88. По кислороду проверим правильность составления
уравнения
3CuS-2
До реакции кислорода
24 атома
После реакции кислорода
24 атома
S-2 (в CuS) является восстановителем, т.к. отдает электроны
N+5 (в HNO3) является окислителем, т.к. отдает электроны
Слайд 9Алгоритм составления уравнений ОВР методом электронного баланса:
Составить схему реакции.
Al + HCl → AlCl3 +
Определить степени окисления элементов в реагентах и продуктах реакции.
Al0 + H+1Cl-1 → Al+3Cl3-1 + H20
Определить, является реакция окислительно-восстановительной или она протекает без изменения степеней окисления элементов.
Эта реакция является ОВР
Подчеркнуть элементы, степени, окисления которых изменяются.
Al0 + H+1Cl-1 → Al+3Cl3-1 + H20
Слайд 10Определить, какой элемент окисляется, (его степень окисления повышается) и какой элемент
Al0 → Al+3 окисляется
H+1→ H20 восстанавливается
В левой части схемы обозначить с помощью стрелок процесс окисления (смещение электронов от атома элемента) и процесс восстановления (смещение электронов к атому элемента)
Al0 – 3 ē → Al+3 процесс окисление
2H+1 + 2 ē → H20 процесс восстановление
Определить восстановитель и окислитель.
Al0 – 3 ē → Al+3 восстановитель
2H+1+ 2 ē → H20 окислитель
Слайд 11Сбалансировать число электронов между окислителем и восстановителем.
Определить коэффициенты для окислителя и
Расставить коэффициенты перед формулами окислителя и восстановителя.
2Al +6 HCl → 2AlCl3 + 3H2
Проверить уравнение реакции.
Посчитаем количество атомов справа и слева, если их будет равное количество – уравнение мы уравняли.
Слайд 13Составим уравнение окислительно-восстановительной реакции
Mg+H2SO4→MgSO4+ H2S + H2O
4Mg0+5H2+1 S+6O4-2→4Mg+2S+6O4-2+ H2+1S-2 + 4H2+1O-2
S+6
Mg0 - 2e Mg+2 2 4 восстановитель, окисляется
8
Слайд 14Написать уравнение окислительно – восстановительных реакций, расставить коэффициенты методом электронного баланса
А)
Б) Fe + CuSO4 = FeSO4 + Cu
Домашнее задание: п 5, упр. 6 стр 22.
Zn + 2H2SO4(конц) = ZnSO4 + SO2 + 2H2O
Al + O2 = Al2O3