- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Общая характеристика не металлов
Содержание
- 1. Общая характеристика не металлов
- 2. Слайд 2
- 3. Из 109 химических элементов 22 неметаллы, расположены
- 4. Химическая связь –ковалентная неполярная Ковалентная неполярная связь
- 5. Инертные или благородные газы не образуют молекул
- 6. При обычной температуре неметаллы могут быть в
- 7. Многие не проводят электрический ток
- 8. Способность атомов одного химического элемента образовывать несколько
- 9. 1. строение молекулы пример: О2
- 10. Аллотропные формы кислородаКислород образует две аллотропные модификации
- 11. Аллотропные модификации углеродаУглерод образует две аллотропные формы
- 12. Аллотропные модификации фосфораФосфор образует семь аллотропных модификаций,
- 13. Есть ли аллотропия у металлов?Надо отметить, что
- 14. Химические свойства неметаллов Проявляют сильные окислительные свойства,
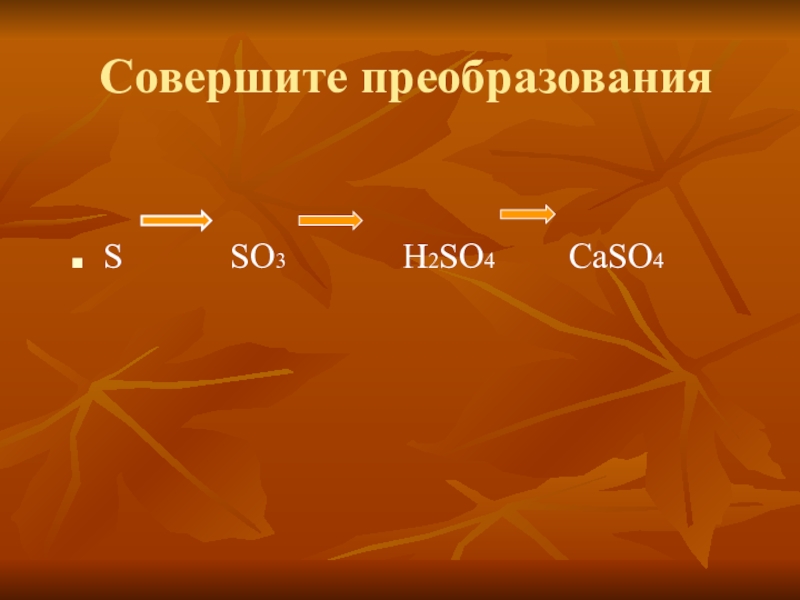
- 15. Совершите преобразованияS
- 16. Воздух - смесь неметаллов и их
- 17. Состав воздухаПостоянная составная часть воздуха:
- 18. Переменные составные части воздуха - это CO2
- 19. Воздух, свободный от переменных и случайных составных частей, прозрачен, лишён цвета, вкуса и запаха, Мвоздуха= 29г/см3
- 20. Воздух – это океан газов, на дне
Слайд 3Из 109 химических элементов 22 неметаллы, расположены в правом верхнем углу
Неметаллы характеризуются маленькими радиусами атомов и большим числом электронов на последнем энергетическом уровне ( валентных электронов). Они с трудом отдают эти электроны и легко принимают чужие.
неметаллы
Слайд 4Химическая связь –ковалентная неполярная
Ковалентная неполярная связь - осуществляется посредством образования общих
Cl - Cl
H - H
O = O
Слайд 5Инертные или благородные газы не образуют молекул и существуют в атомарном
Многие неметаллы образуют молекулу, состоящую из двух атомов ( H2 , O2 , N2 , F2,
Cl2 , Br2, I2) при этом образуется очень непрочная молекулярная неполярная кристаллическая решетка
He –гелий, Ne-неон ,
Ar-аргон , Kr-криптон , Xe-ксенон , Rn-радон
Кристаллические решётки
Есть неметаллы, образующие самые прочные атомные кристаллические решётки- алмаз (С) и кремния (Si)
Слайд 6При обычной температуре неметаллы могут быть в разном агрегатном состоянии
жидкие -
Br -бром
твердые –
S –сера,
P-фосфор,
I2 –йод,
C–-алмаз и графит
газообразные-
O2-кислород ,
H2 - водород,
N2- азот ,
Cl2-хлор,
F2-фтор.
Агрегатное состояние
Слайд 7
Многие не проводят электрический ток (кроме графита и кремния).
Не
В твердом состоянии- хрупкие
Не имеют металлического блеска ( кроме иода-I2 , графита-C и кремния Si)
Цвет охватывает все цвета спектра(красный-красный фосфор, желтый –сера, зеленый-хлор, фиолетовый –пары иода).
Температура плавления изменяется в огромном интервале tпл (N2)= -210C , а t пл (Алмаз) =3730С
Физические свойства
Слайд 8Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией,
Аллотропия
Слайд 9
1. строение молекулы
пример: О2 и О3
2.строение кристаллической
пример: алмаз и графит
Причины аллотропии
Слайд 10Аллотропные формы кислорода
Кислород образует две аллотропные модификации (причина- строение молекулы)
Кислород
O2
Газ без цвета и запаха
Входит в состав воздуха
Не ядовит!
Озон
O3
Газ бледно-фиолетового цвета с резким запахом свежести.
Обладает бактерицидными свойствами ,
Способен удерживать ультрафиолетовые лучи
Слайд 11Аллотропные модификации углерода
Углерод образует две аллотропные формы (причина – строение кристаллической
Алмаз
Тетраэдрическая крист. решетка
Бесцветные кристаллы
Самое твердое вещество в природе
tпл=37300C
Графит
Кристаллическая решетка напоминает соты
Слоистое кристаллическое вещество
Жирное на ощупь
непрозрачное ,серого цвета
Слайд 12Аллотропные модификации фосфора
Фосфор образует семь аллотропных модификаций, причиной является строение кристаллической
Фосфор белый
( молек.кр решётка )
P4
Мягкое, бесцветное вещество
В темноте светится
Ядовит,!
Фосфор красный
( атомная кр.решётка)
Pn
аморфное полимерное вещество(порошок)
в темноте не светится
неядовит
Слайд 13Есть ли аллотропия у металлов?
Надо отметить, что аллотропные формы образуют не
Например, олово Sn образует две модификации белое-олово (всем известный белый очень пластичный и мягкий металл, из которого делают оловянных солдатиков)
При температуре -330C белое олово превращается в серое (мелкокристаллический порошок со свойствами неметалла), этот переход называют оловянной чумой.
Слайд 14Химические свойства неметаллов
Проявляют сильные окислительные свойства, но многие могут выступать
Слайд 16Воздух - смесь неметаллов и их соединений.
В конце ХYlll века
Слайд 17 Состав воздуха
Постоянная составная часть воздуха:
Азот N2 78,2% 75,50%
Кислород O2 20,9% 23,20%
Благородные газы
(в основном аргон) 0,94% 1,30%
Слайд 18Переменные составные части воздуха - это CO2 , H2O и О3
Случайные составные части воздуха – пыль, микроорганизмы, пыльца растений. некоторые газы, в том числе и те, которые образуют кислотные дожди(SO2,SO3,N2O5 ).
Слайд 19Воздух, свободный от переменных и случайных составных частей, прозрачен, лишён цвета,
Слайд 20Воздух – это океан газов, на дне которого живут люди, животные
( рыб и водных растений).