веществ и типы химических реакций
Обобщающий урок по химии в 8 классе
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Обобщающий урок по химии в 8 классе по теме Важнейшие классы неорганических соединений
Содержание
- 1. Обобщающий урок по химии в 8 классе по теме Важнейшие классы неорганических соединений
- 2. Девиз урока«Химик требуется не такой, который лишь
- 3. Цель урокаОбобщить и систематизировать знания учащихся о классах неорганических соединений, типах химических реакций.
- 4. Классы неорганических веществОксиды – вещества, состоящие из
- 5. Основания – это вещества, образованные атомами металлов
- 6. Кислоты - вещества, образованные атомами водорода, способными
- 7. Соли – это вещества, образованные атомами металла и кислотными остаткамиKCl MgSO4 Ba(NO3)2
- 8. Химические реакции - это превращение одних веществ в другие, отличающиеся от исходных составом, строением, свойствами.
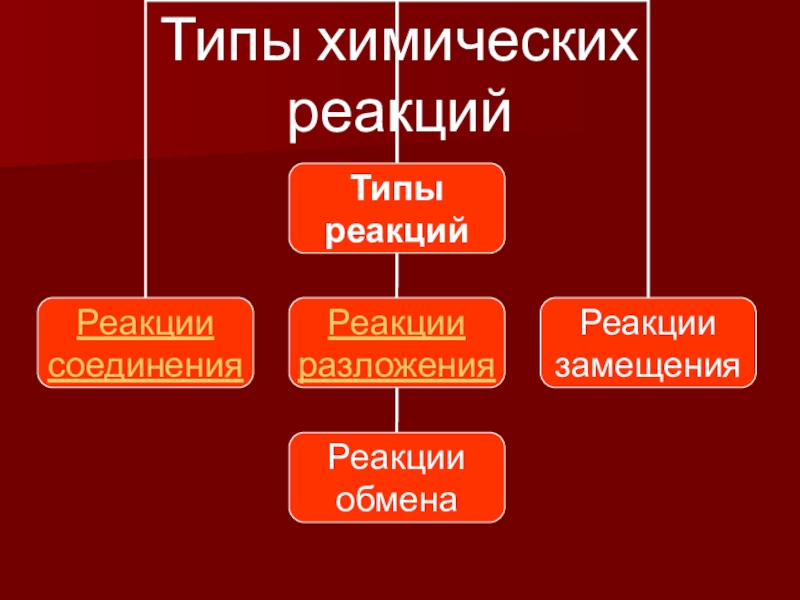
- 9. Типы химических реакций
- 10. Реакции соединенияА + В = АВ2 H2 + O2 = 2H2OMgO + SO3 = MgSO4
- 11. Реакции разложенияАВС = А +ВСАВ = А+В
- 12. Реакции замещенияАВ + С = СВ +
- 13. Реакции обменаАВ + СD = AD +CBNa2SO4 + BaCl2 = 2NaCl + BaSO4
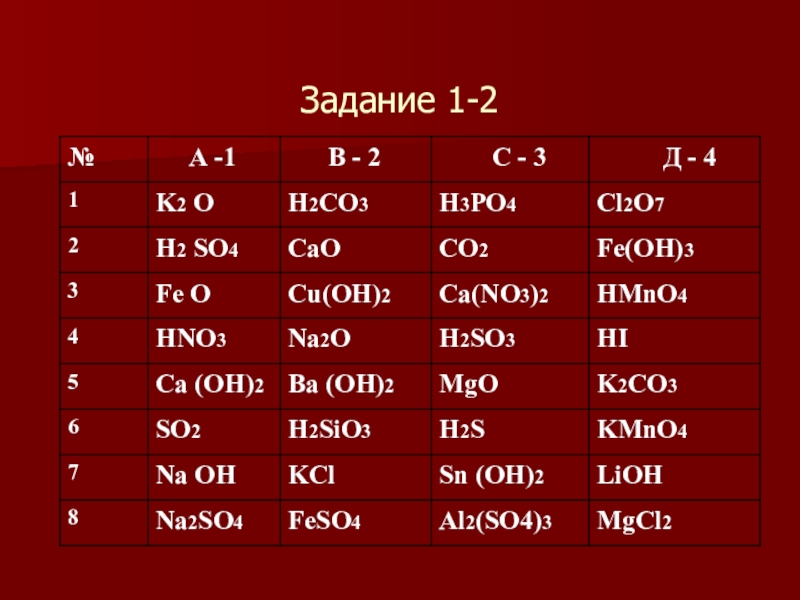
- 14. Задание 1-2
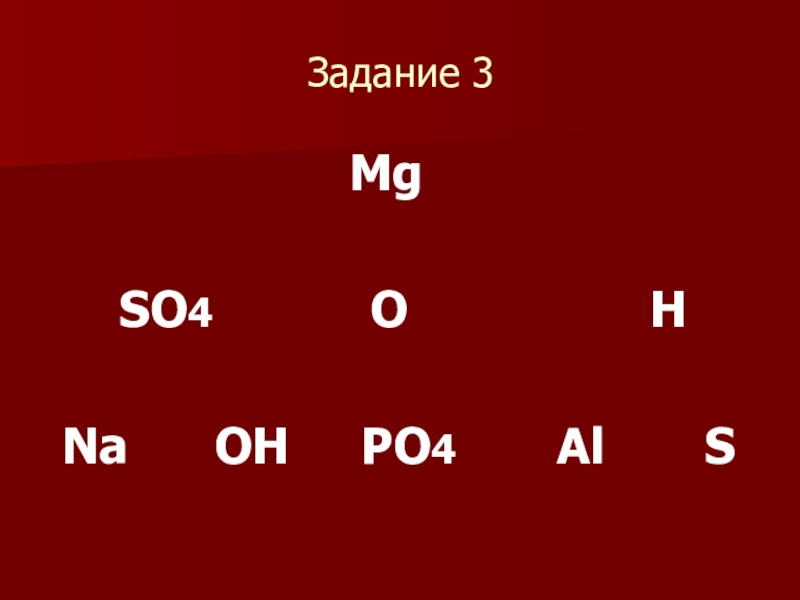
- 15. Задание 3
- 16. Задание 4
Девиз урока«Химик требуется не такой, который лишь из одного чтения книг понял сию науку, но который собственным искусством в ней прилежно упражнялся».
Слайд 2Девиз урока
«Химик требуется не такой, который лишь из одного чтения книг
понял сию науку, но который собственным искусством в ней прилежно упражнялся».
Слайд 3Цель урока
Обобщить и систематизировать знания учащихся о классах неорганических соединений, типах
химических реакций.
Слайд 4Классы неорганических веществ
Оксиды – вещества, состоящие из двух элементов, один из
которых кислород.
BaO SO3 Mn2O7 N2O5
BaO SO3 Mn2O7 N2O5
Слайд 6Кислоты - вещества, образованные атомами водорода, способными замещаться на атомы металла,
и кислотными остатками.
H2SO4 HNO3 HMnO4 HCl
H2SO4 HNO3 HMnO4 HCl
Слайд 8Химические реакции - это превращение одних веществ в другие, отличающиеся от
исходных составом, строением, свойствами.