- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Непредельные углеводороды ряда алкенов
Содержание
- 1. Непредельные углеводороды ряда алкенов
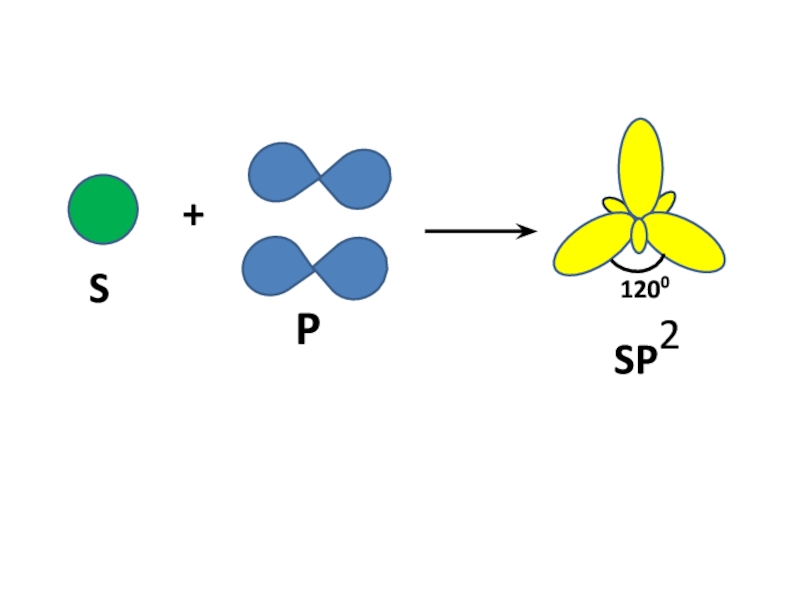
- 2. SP+1200SP2
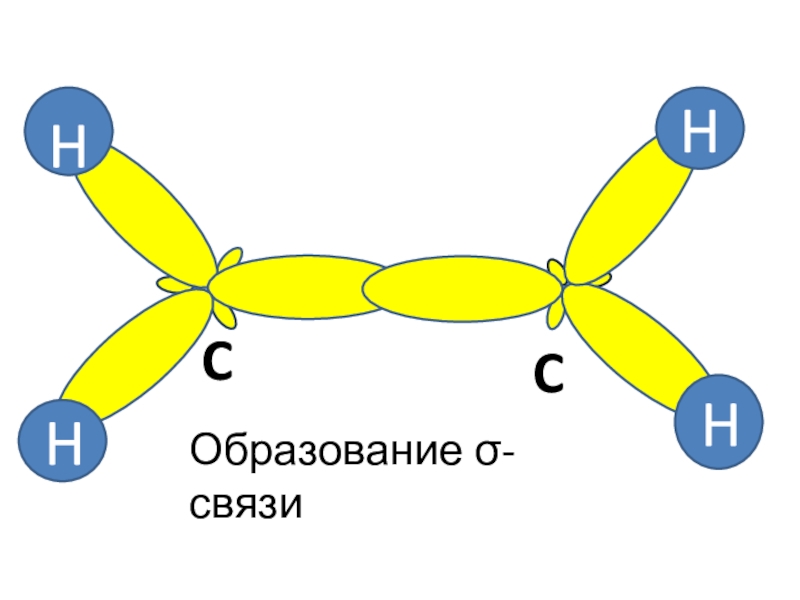
- 3. H HH HCCОбразование σ-связи
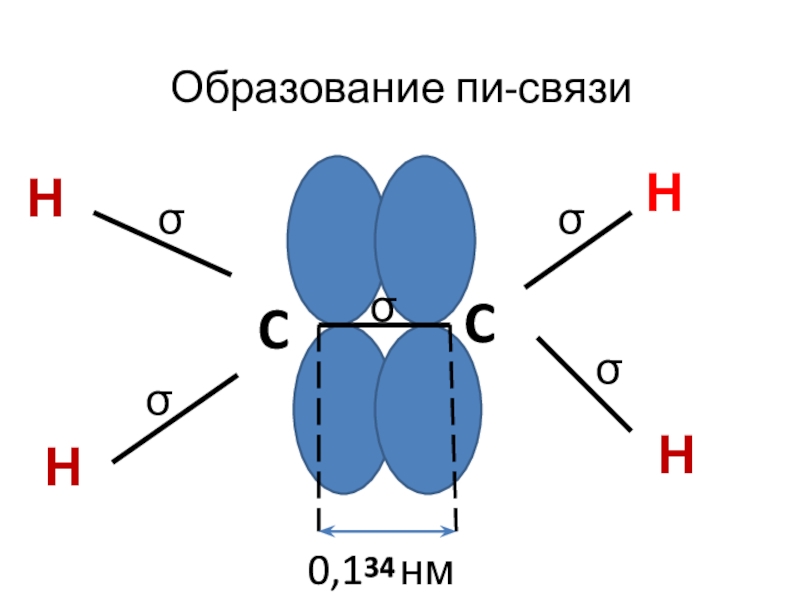
- 4. CCННННОбразование пи-связиσσσσσ0,1 нм34
- 5. Гомологический ряд алкеновC 2H4C 4H8C 3H6C 5H10Этен
- 6. 1 . Изомерия углеродного скелетаСН 2 =
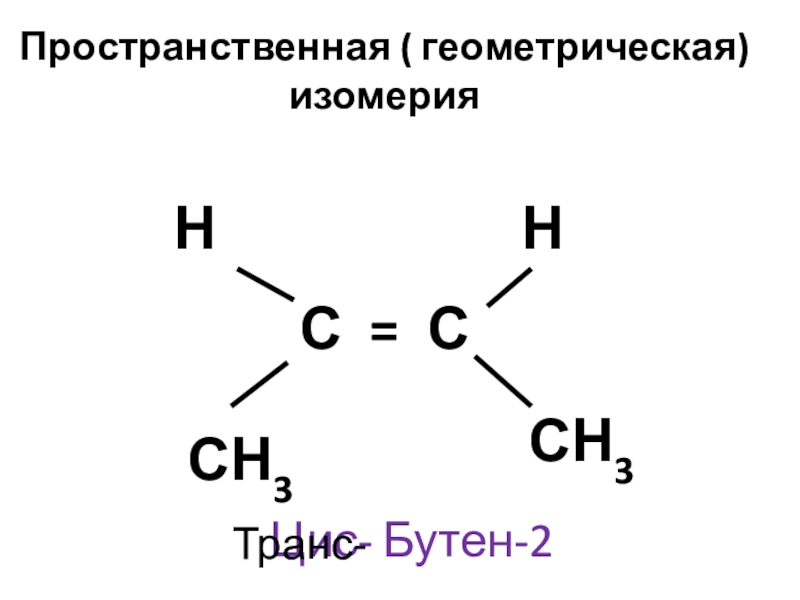
- 7. Пространственная ( геометрическая) изомерия С = С
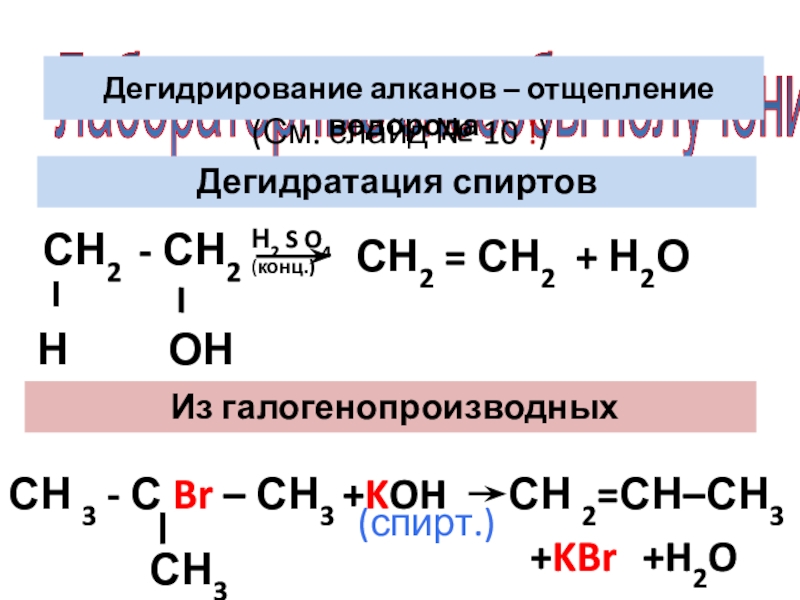
- 8. Лабораторные способы получения Дегидрирование алканов –
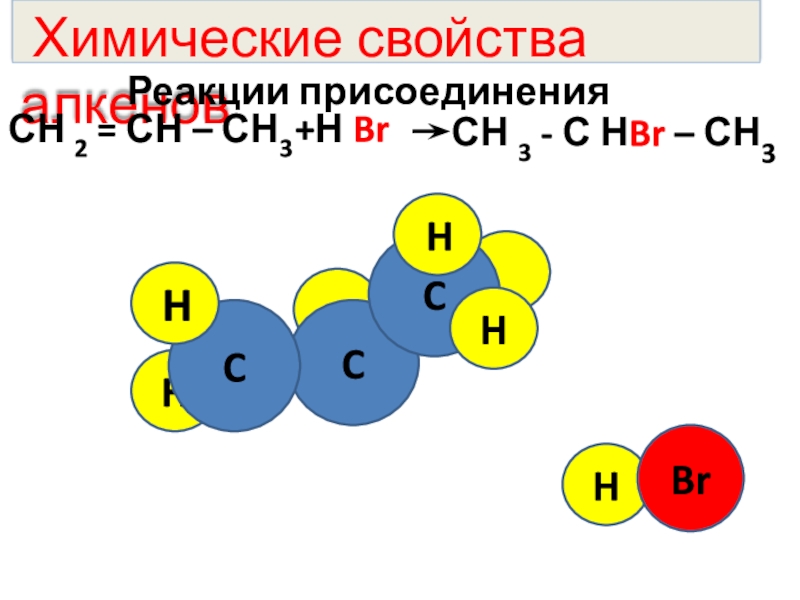
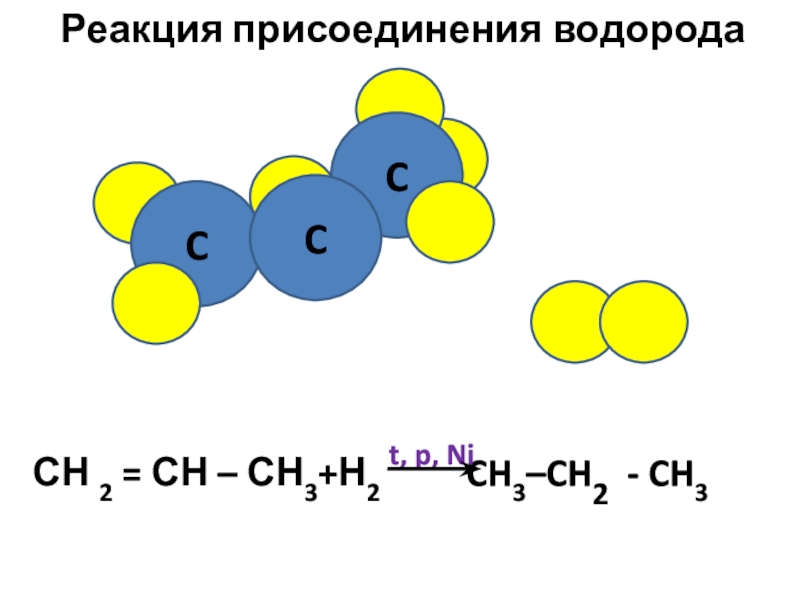
- 9. H Химические свойства алкенов Реакции присоединенияСН
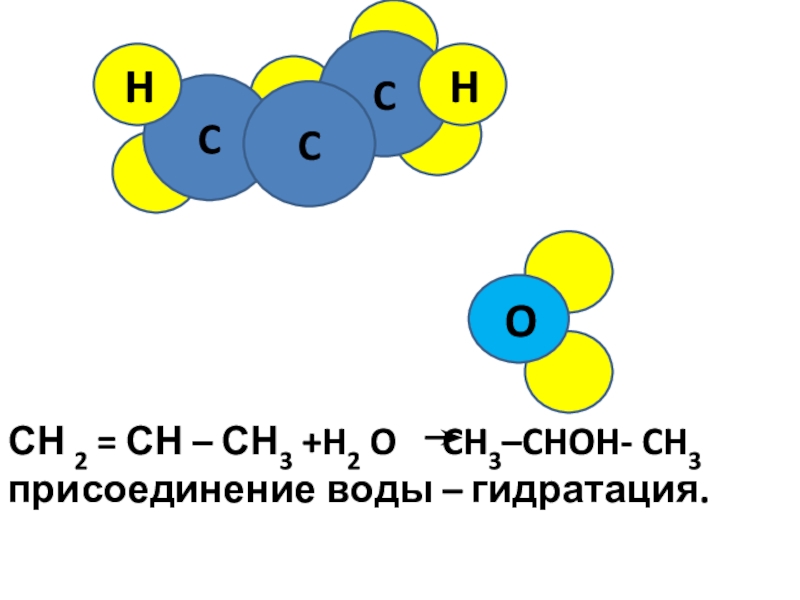
- 10. CC HC H OСН
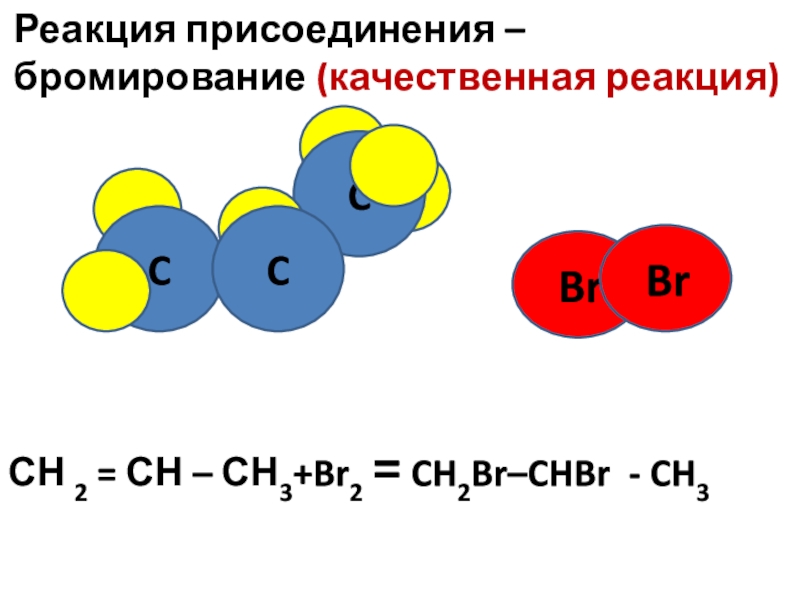
- 11. Br CC Реакция присоединения
- 12. Реакция присоединения водородаCCC
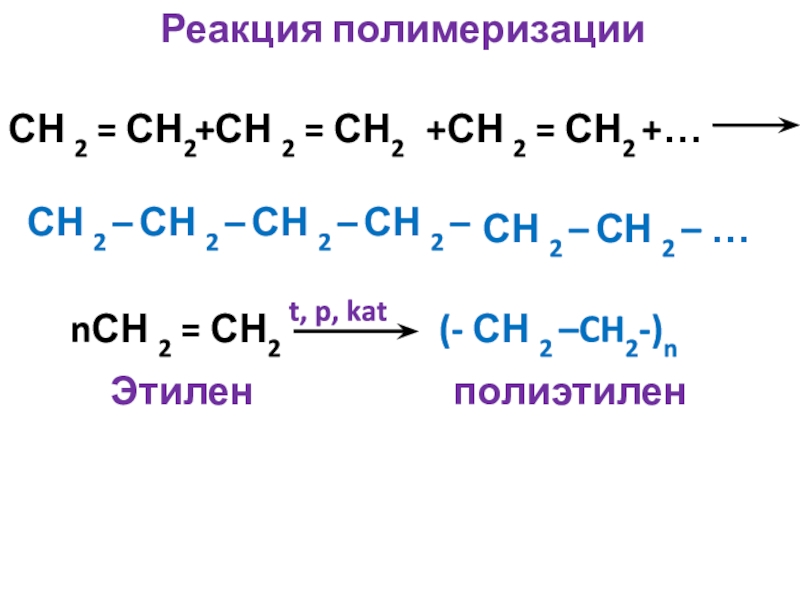
- 13. Реакция полимеризацииСН 2 = СН2
- 14. nСН 2 = СН2
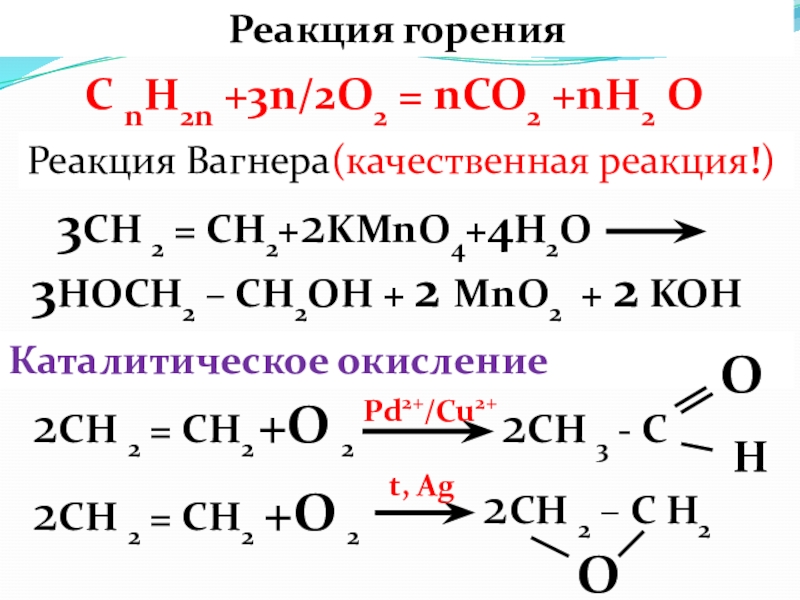
- 15. Реакция горения 3СН 2 = СН2+2KMnO4+4H2O
Слайд 5Гомологический ряд алкенов
C 2H4
C 4H8
C 3H6
C 5H10
Этен (этилен)
Пропен
Бутен
Пентен
Радикал-винил
Слайд 61 . Изомерия углеродного скелета
СН 2 = СН – СН 2
СН 3 - СН = СН - СН3 БУТЕН - 2
СН 2 = С– СН3 2–метилпропен
СН3
–
2. Изомерия положения « = » связи
Слайд 8 Лабораторные способы получения
Дегидрирование алканов – отщепление водорода
(См. слайд №
Дегидратация спиртов
СН2 - СН2
Н
ОН
Н2 S O4 (конц.)
Из галогенопроизводных
СН2 = СН2 + Н2О
СН 3 - С Br – СН3
СН3
СН 2=СН–СН3
+KOH
+KBr
+H2O
(спирт.)
Слайд 9
H
Химические свойства алкенов
Реакции присоединения
СН 2 = СН
СН 3 - С НBr – СН3
+Н Br
C
C
C
H
H
H
H
Br
Слайд 11 Br
C
C
Реакция присоединения – бромирование
C
Br
СН 2 = СН – СН3+Br2 = CH2Br–CHBr - CH3
Слайд 13Реакция полимеризации
СН 2 = СН2
+СН 2 =
+СН 2 = СН2 +…
СН 2 –
СН 2 –
СН 2 –
СН 2 –
СН 2 –
СН 2 – …
t, p, kat
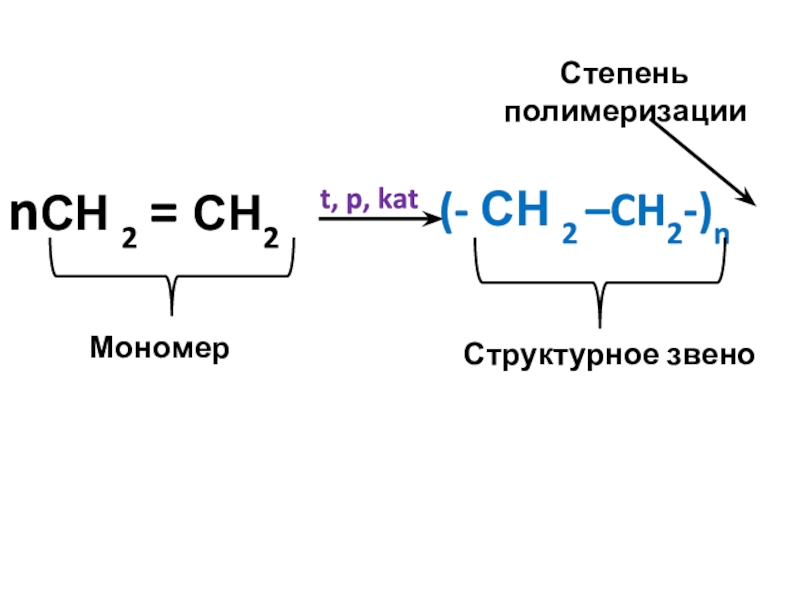
nСН 2 = СН2
(- СН 2 –CH2-)n
Этилен полиэтилен
Слайд 15Реакция горения
3СН 2 = СН2+2KMnO4+4H2O
C nH2n +3n/2O2 = nCO2 +nH2 O
Реакция Вагнера(качественная реакция!)
2СН 2 = СН2
Каталитическое окисление
2СН 3 - С
2СН 2 = СН2
+О 2
+О 2
О
2СН 2 – С Н2
О
Н
Pd2+/Cu2+
t, Ag