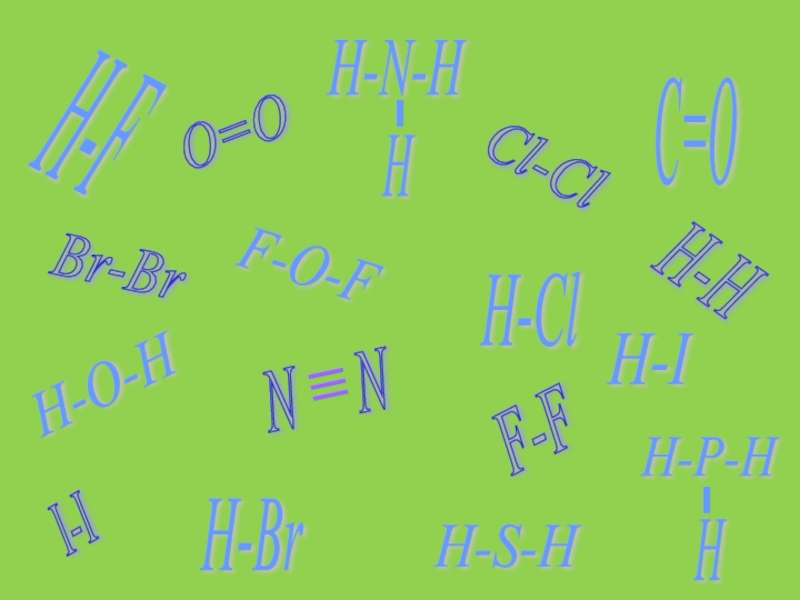- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Ковалентті химиялық байланыс түрлері
Содержание
- 1. Ковалентті химиялық байланыс түрлері
- 2. Қосылыстағы атомдардың бір-біріне әсері арқылы жүзеге
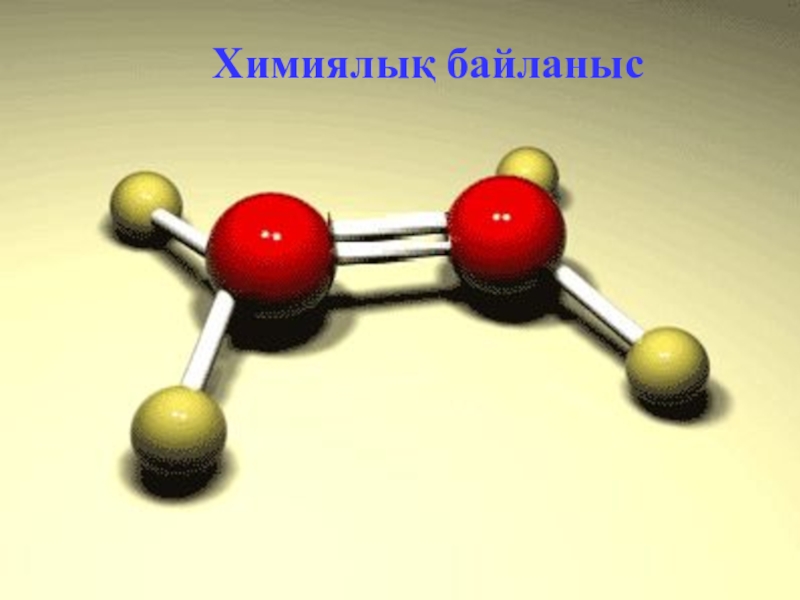
- 3. ХИМИЯЛЫҚ БАЙЛАНЫС - химиялық қосылыстағы элемент атомдарының бір-біріне әсері арқылы жүзеге асатын күштердің шоғырлануы
- 4. Химиялық байланыс түзілген кезде атомдардың электрондық құрылымы
- 5. Джильбер Льюис
- 6. H-F H-Cl H-Br H-I C=O H-H H-S-H H-O-H I-I F-O-F Br-Br F-F Cl-Cl O=O
- 7. Полюссіз ковалентті химиялық байланысты молекулада электрон жұбы
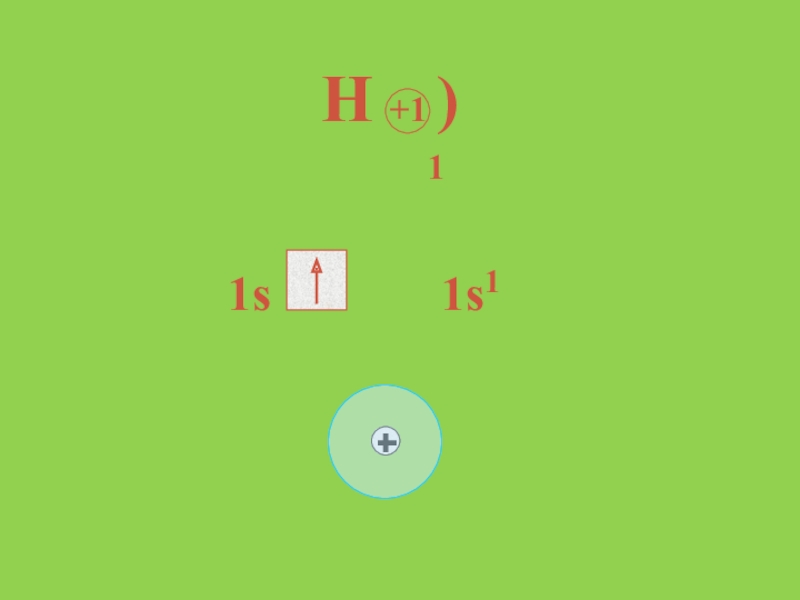
- 8. H +1 ) 1
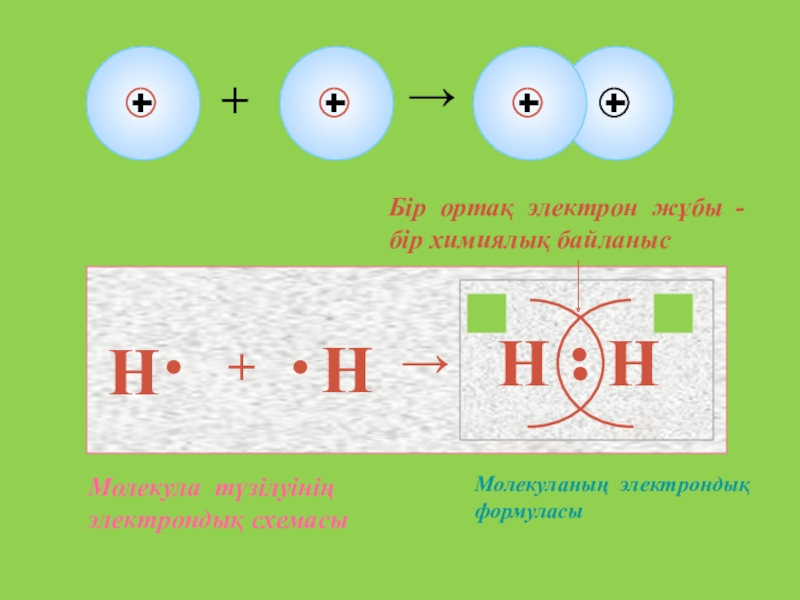
- 9. Н+Н→НН2ē2ēБір ортақ электрон жұбы - бір химиялық байланыс Молекуланың электрондық формуласыМолекула түзілуінің электрондық схемасы
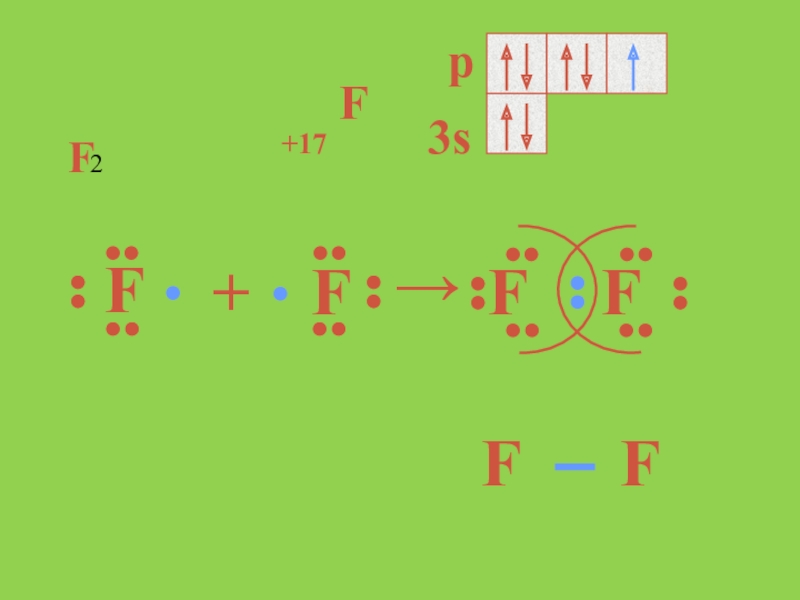
- 10. +17F F+ F→FFFF2F
- 11. α - байланыс дегеніміз электрон бұлттарының қабысу
- 12. Полюсті коваленттік байланыс дегеніміз байланыстырушы электрон жұбының
- 13. Cl +17 ) ) )
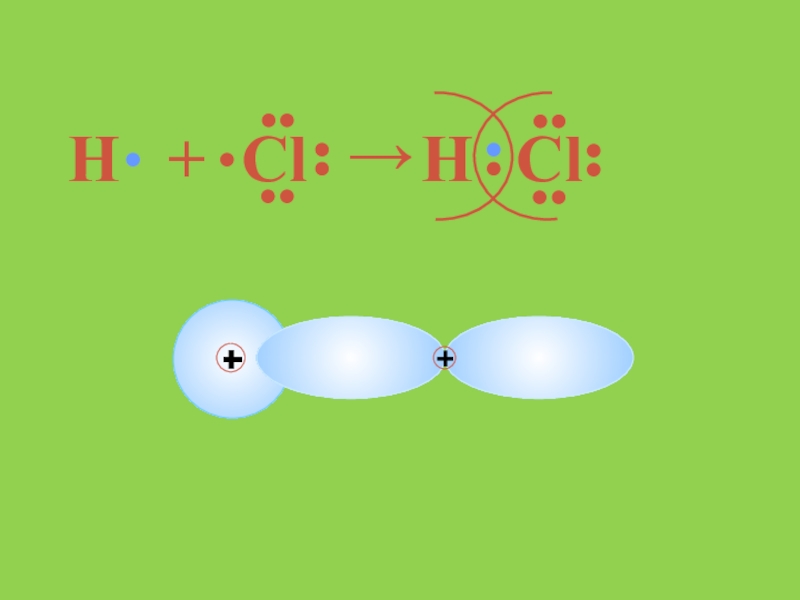
- 14. H+Cl→HCl
- 15. Химиялық байланыстың негізгі сипаттамалары: байланыс энергиясы байланыс
- 16. БасбармақБасбармақ жоғарыға қарай = Мен түсіндімБасбармақ көлденең = Мен түсінгендеймін. Басбармақ төмен қарай = Мен түсінбедім.
- 17. Назарларыңызға рахмет!
Қосылыстағы атомдардың бір-біріне әсері арқылы жүзеге асатын күш табиғатынының мәнін түсіндіру;Атомдар арасында химиялық байланыстың қалай түзілетінін анықтау;Молекуладағы байланыстың түзілуін шартты түрде жазып үйрету; Сабақтың мақсаты:
Слайд 2Қосылыстағы атомдардың бір-біріне әсері арқылы жүзеге асатын күш табиғатынының мәнін
түсіндіру;
Атомдар арасында химиялық байланыстың қалай түзілетінін анықтау;
Молекуладағы байланыстың түзілуін шартты түрде жазып үйрету;
Атомдар арасында химиялық байланыстың қалай түзілетінін анықтау;
Молекуладағы байланыстың түзілуін шартты түрде жазып үйрету;
Сабақтың мақсаты:
Слайд 3ХИМИЯЛЫҚ БАЙЛАНЫС
- химиялық қосылыстағы элемент атомдарының бір-біріне әсері арқылы жүзеге
асатын күштердің шоғырлануы
Слайд 4Химиялық байланыс түзілген кезде атомдардың электрондық құрылымы өзгеріске ұшырайды.
Сыртқы
электрондық қабаты ns2np6 типті болған жағдайда электронды октет және 1 s2 аяқталған, анағұрлым тұрақты болады.
Басқа элементтің атомдары химиялық байланыс түзу кезінде осындай электрондық құрылым түзуге ұмтылады.
Басқа элементтің атомдары химиялық байланыс түзу кезінде осындай электрондық құрылым түзуге ұмтылады.
Химиялық байланыс түзілуде ең басты рольді электрондар атқарады.
Слайд 7Полюссіз ковалентті химиялық байланысты молекулада электрон жұбы атомға ауыспай, симметриялы түрде
ортада орналасады. Полюссіз химиялық байланыстағы қосылыстардың қайнау және балқу температуралары төмен, полюсті еріткіштерде иондар түзбейді, электр тоғын өткізбейді.
Слайд 9
Н
+
Н
→
Н
Н
2ē
2ē
Бір ортақ электрон жұбы - бір химиялық байланыс
Молекуланың электрондық формуласы
Молекула
түзілуінің электрондық схемасы
Слайд 11α - байланыс дегеніміз электрон бұлттарының қабысу ауданы ядролардың қосылу сызығының
бойында жатқанда түзілетін байланыс (а). Ал π-байланыс — электрон бұлттарының қабысу ауданы ядроларды қосатын сызықтың екі жағында орналасқанда түзіледі. Оттегі молекуласында атомдар бір-бірімен екі байланыспен байланысқан, оның бірі - α болса, екіншісінің π-байланыс екендігін байқайсыңдар.
Олай болса π - байланыс, тек қайталанған байланыстарда болса, α -байланыс дара байланыс кезінде түзіледі.
Слайд 12Полюсті коваленттік байланыс дегеніміз байланыстырушы электрон жұбының бұлты электртерістігі басым элемент
атомына қарай ығыса орналасқан байланыс. Молекуланың полюстілігі диполь моменті арқылы көрсетіледі. Полюсті молекулалардың қайнау және балқу температурасы төмен, полюсті еріткіштерде үйектеліп иондарға ыдырайды.
Слайд 15Химиялық байланыстың негізгі сипаттамалары:
байланыс энергиясы
байланыс ұзындығы
валенттік бұрыш
Байланыс энергиясы –
өзара байланысқан атомдарды не иондарды бір – бірінен ажырату үшін жұмсалатын энергия.
Байланыс ұзындығы – химиялық байланыстағы
атомдар ядроларының арасындағы қашықтық,
валенттік бұрыш – байланысқан атомдар ядролары арқылы жүргізілетін жорамал сызықтар арасындағы бұрыш.
Бұл көрсеткіштер зат молекуласының құрылысын, пішінін және беріктігін сипаттайды.
Байланыс ұзындығы – химиялық байланыстағы
атомдар ядроларының арасындағы қашықтық,
валенттік бұрыш – байланысқан атомдар ядролары арқылы жүргізілетін жорамал сызықтар арасындағы бұрыш.
Бұл көрсеткіштер зат молекуласының құрылысын, пішінін және беріктігін сипаттайды.
Слайд 16Басбармақ
Басбармақ жоғарыға қарай = Мен түсіндім
Басбармақ көлденең = Мен түсінгендеймін.
Басбармақ
төмен қарай = Мен түсінбедім.