- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Классификация химических реакций. 11 класс.
Содержание
- 1. Классификация химических реакций. 11 класс.
- 2. Цель урока:Обобщить представления о химической реакции.Задачи:Рассмотреть некоторые
- 3. План урока1 Химическая реакция2. Классификация химических реакций2.1
- 4. Химические реакции- это процессы, в результате которых
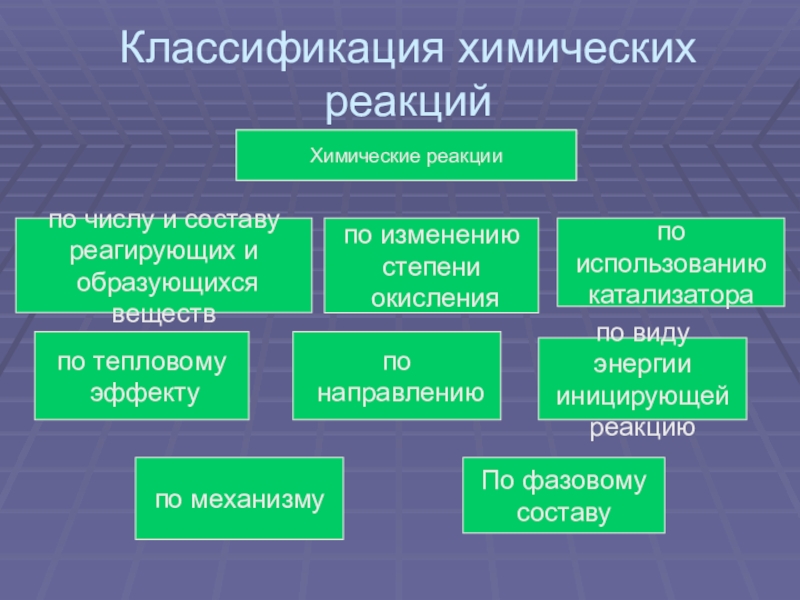
- 5. Классификация химических реакцийХимические реакциипо числу и составуреагирующих
- 6. I. По числу и составу реагирующих веществРеакции
- 7. В органической химии к этому типу реакций
- 8. Реакции идущие с изменением состава вещества.Реакции соединения:NO2
- 9. В органической химии реакции соединения принято называть
- 10. Реакции разложения.HI= H2 + I2KNO3 = KNO2 + O2 KClO3 = KCl + O2HgO =
- 11. РЕАКЦИИ РАЗЛОЖЕНИЯ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ1. РЕАКЦИИ ДЕГИДРАТАЦИИ.C2H5OH
- 12. Реакции замещения2Na + 2H2O = 2NaOH +
- 13. РЕАКЦИИ ЗАМЕЩЕНИЯ в органических соединениях СH4 + Cl2 CH3Cl + HClC6H6 + Br2
- 14. Реакции обмена NaOH + HNO3 = NaNO3
- 15. РЕАКЦИИ ОБМЕНА в органических соединенияхCH3COOH +
- 16. II По изменению степени окисления атомов.
- 17. Окислительно- восстановительные реакцииMg0 + H2+SO4 = Mg2+SO4
- 18. Реакции, идущие без изменения степеней окисления.Li2O +
- 19. III По тепловому эффекту.Экзотермические реакции.H2 + Cl2
- 20. III По тепловому эффекту.Эндотермические реакции.К ним относятся
- 21. IV По направлению.Необратимые реакции.К ним можно
- 22. Необратимые реакции.
- 23. Обратимые реакции. В органической химии признак обратимости
- 24. Обратимые реакции.
- 25. Дайте характеристику реакциям, предварительно расставив коэффициенты.Zn +
Слайд 2Цель урока:
Обобщить представления о химической реакции.
Задачи:
Рассмотреть некоторые из многочисленных классификаций химических
Показать применимость таких классификаций для неорганических и органических реакций.
Раскрыть относительный характер различных типов химических реакций и взаимосвязь различных классификаций химических процессов.
Слайд 3План урока
1 Химическая реакция
2. Классификация химических реакций
2.1 По числу и составу
2.2 По изменению степени окисления атомов.
2.3 По тепловому эффекту.
2.4 По направлению.
Слайд 4Химические реакции
- это процессы, в результате которых из одних веществ образуются
Слайд 5Классификация химических реакций
Химические реакции
по числу и составу
реагирующих и
образующихся веществ
по изменению
степени
окисления
по
использованию
катализатора
по
направлению
Химические реакции
по механизму
по тепловому
эффекту
по виду энергии
иницирующей
реакцию
По фазовому
составу
Слайд 6I. По числу и составу реагирующих веществ
Реакции идущие без изменения состава
C (графит) С (алмаз)
S (ромбическая) S (моноклинная)
Р (белый) Р (красный)
Sn (белое олово) Sn (серое олово)
3О2(кислород) 2O3(озон)
Слайд 7В органической химии к этому типу реакций могут быть отнесены реакции
CH3 – CH2 – CH2 – CH2 – CH3 H3C – CHCH3 – CH2 – CH3
CH3 – CH2 – CH = CH2
CH3 – CH2 – CH2 – Br CH3 – CHBr – CH3
AlCl3,t
SiO2
5000C
250oC
Al2O3
250OC
Слайд 8Реакции идущие с изменением состава вещества.
Реакции соединения:
NO2 + O2 + H2O
Н2 + О2 =
SO3 + H2O =
CaO + H2O =
Слайд 9В органической химии реакции соединения принято называть «реакциями присоединения».
1. Реакция гидрирования.
СН2=СН2+
2 .Реакция гидратации.
СН2=СН2 + Н2О
3. Реакция полимеризации.
n СН2=СН2
Ni , t
H3PO4, t
P, кат., t
Слайд 11РЕАКЦИИ РАЗЛОЖЕНИЯ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1. РЕАКЦИИ ДЕГИДРАТАЦИИ.
C2H5OH
2.
СН3- СН3
3. РЕАКЦИЯ КРЕКИНГА.
CH3 - CH2 - CH2 - CH3 CH2= CH2 + CH3 - CH3
H2SO4,t
Cr2O3,t
t
Слайд 14Реакции обмена
NaOH + HNO3 = NaNO3 + H2O
2NH4CL
CuSO4 + KOH =
H2SO4+ Ba (OH)2 =
Слайд 15РЕАКЦИИ ОБМЕНА
в органических соединениях
CH3COOH + NaOH Na(CH3COO) + H2O
2CH3COOH
2CH3COOH + K2SiO3
Слайд 16
II По изменению степени окисления атомов.
Окислительно- восстановительные реакции
Al + O2 =
Восстановитель
Al0 -2e Al3+
Окислитель
О2 +2е 2О2-
окисление
Восстановление
Слайд 17Окислительно- восстановительные реакции
Mg0 + H2+SO4 = Mg2+SO4 + H20
Восстановитель
Mg0-2e
Окислитель
H2+ +2е H20
окисление
восстановление
Слайд 18Реакции, идущие без изменения степеней окисления.
Li2O + H2O = 2Li OH
Fe(OH)3
Zn(OH)2 =
CaCO3 =
Слайд 19III По тепловому эффекту.
Экзотермические реакции.
H2 + Cl2 = 2 HCl +
H2 + N2 = NH3+ Q
Экзотермическими являются все реакции горения, подавляющее большинство реакций окисления и соединения
Р + О2 =
С2Н2 + О2=
Слайд 20III По тепловому эффекту.
Эндотермические реакции.
К ним относятся почти все реакции разложения.
MgCO3
CaCO3 =
H2O =
Слайд 21 IV По направлению.
Необратимые реакции.
К ним можно отнести все реакции обмена,
Слайд 23Обратимые реакции.
В органической химии признак обратимости отражают названия – анонимы процессов.
Гидрирование
Гидратация – дегидратация
Полимеризация – деполимеризация.
IV По направлению.
Слайд 25Дайте характеристику реакциям, предварительно расставив коэффициенты.
Zn + H2SO4 = ZnSO4 +
SO2 + O2 SO3 + Q
N2 + O2 NO - Q
Fe (OH)3 = Fe2O3 + H2O - Q