- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Изменения, происходящие с веществами
Содержание
- 1. Изменения, происходящие с веществами
- 2. Цель урокаОбобщить и систематизировать знания по теме «Изменения, происходящие с веществами»
- 3. Какую мы поставим перед собою цель?1. Повторить
- 4. Для успешного выполнения контрольной работы необходимоЗнать и
- 5. ДиктантУгадайте, о каком явлении: физическом или химическом
- 6. Унылая пора! Очей очарованье!Приятна мне твоя прощальная
- 7. 2. И трещат сухие сучья, Разгораясь
- 8. 3. В декабре, в декабре Все деревья
- 9. 4. А если медь в печи нагреть.
- 10. 5. Что за звездочки резные На пальто
- 11. 6. На рукомойнике моем Позеленела медь. Но
- 12. 7. Световых частиц поток Падает на зеленый
- 13. 8.Когда металл в крутые формы льем, Мне
- 14. СамопроверкаВыполнено без ошибок – оценка 5Допущено
- 15. Правильные ответы: (Х Х Ф Х Ф Х Х Ф)
- 16. "...Все перемены, в натуре случающиеся, такого суть
- 17. Задание 2. Закон сохранения массы веществ. Расстановка
- 18. Задание 2. Закон сохранения массы веществ. Расстановка
- 19. Задание 2. Закон сохранения массы веществ. Расстановка
- 20. Задание 2. Закон сохранения массы веществ. Расстановка
- 21. «Назови тип реакции».Сейчас вам предстоит отгадать загадки.
- 22. Нас было много, мы соединились,
- 23. Когда два сложных вещества в
- 24. А + В → АВ - соединениеАВ
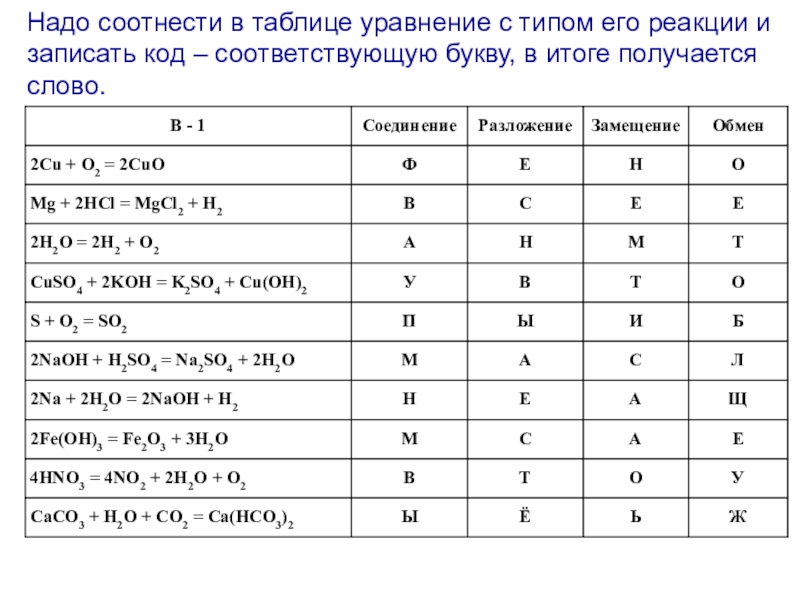
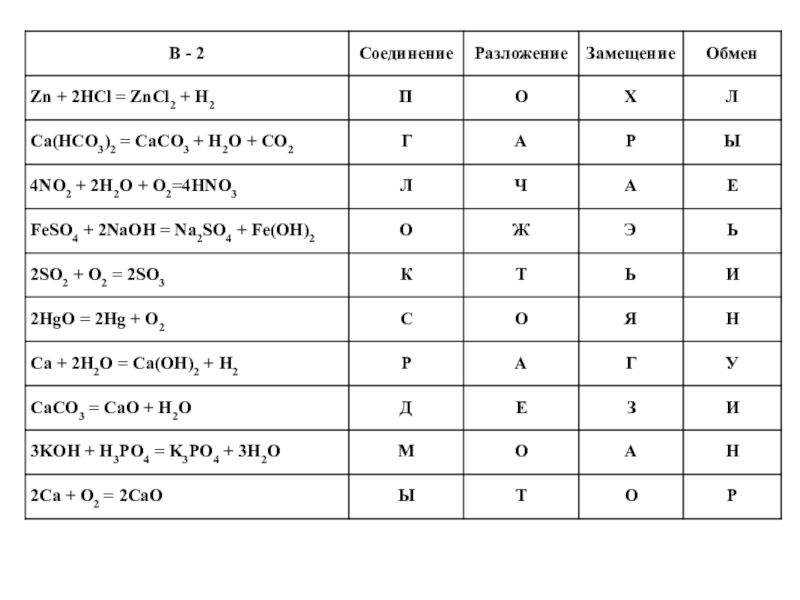
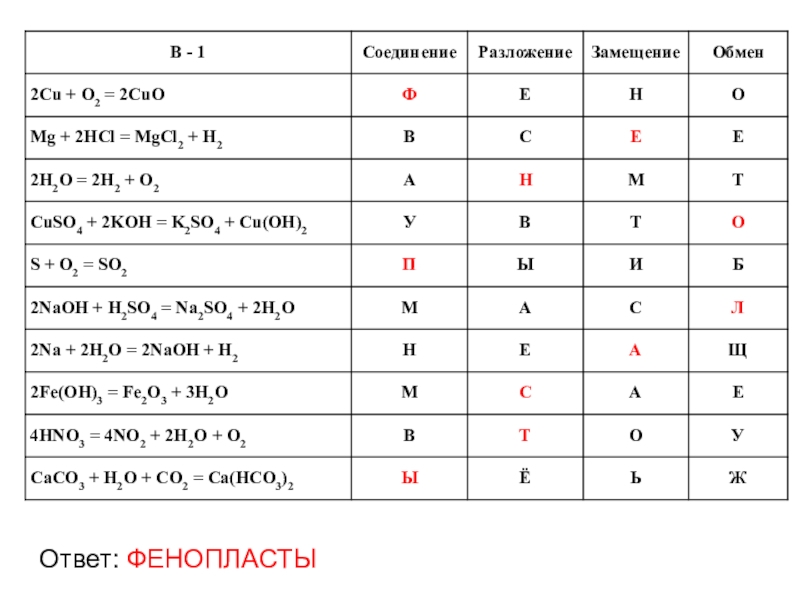
- 25. Надо соотнести в таблице уравнение с типом
- 26. Слайд 26
- 27. Ответ: ФЕНОПЛАСТЫ
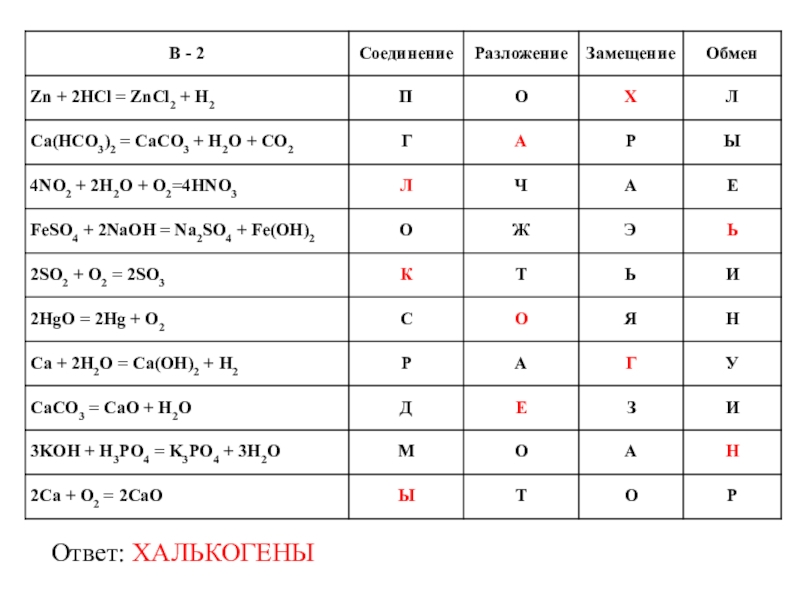
- 28. Ответ: ХАЛЬКОГЕНЫ
- 29. Задание 4. Решение задач.Железные опилки массой 28
- 30. 4) 400 г (20%
- 31. Задание 5. Уравнения.В – 1. По предложенной
- 32. В – 2. Дописать уравнения, если известен
- 33. Задание 5. Уравнения.В – 1. По предложенной
- 34. В – 2. Дописать уравнения, если известен
- 35. Что вам понравилось или не понравилось
- 36. Выставление оценок4,5 - 5 баллов -
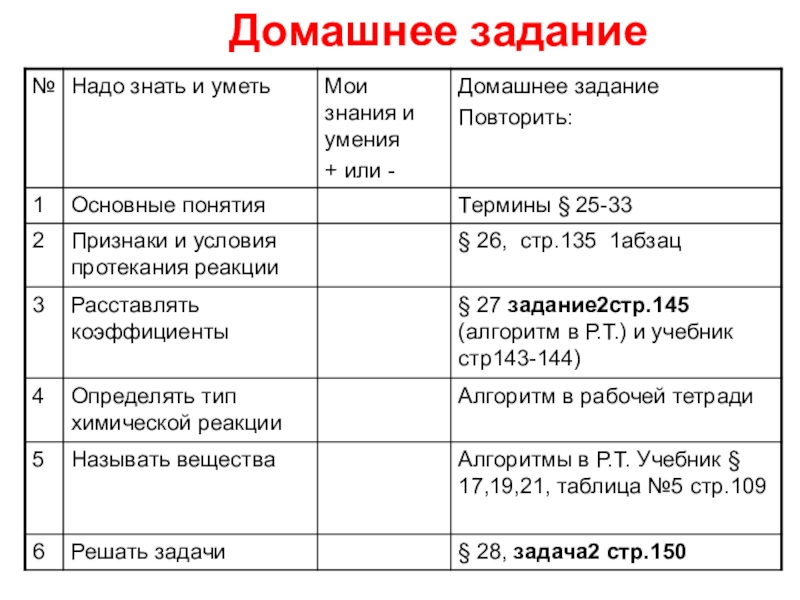
- 37. Домашнее задание
- 38. Спасибо!!!! !!!!
Слайд 1"Изменения, происходящие с веществами"
Урок обобщения и систематизации знаний.
Ношина Анна Владимировна, учитель
Слайд 3Какую мы поставим перед собою цель?
1. Повторить понятия о физических и
2. Вспомнить признаки химических реакций;
3. Закрепить умения записывать уравнения химических реакций и определять их тип;
4. Производить расчёты по химическим уравнениям;
Слайд 4Для успешного выполнения контрольной работы необходимо
Знать и применять понятия: химическая реакция,
Уметь записывать уравнения реакций по «словесной схеме» и по исходным веществам, расставлять коэффициенты, определять тип химических реакций, решать задачи на нахождение массы (объема) вещества по известной массе (объему) другого вещества.
Слайд 5Диктант
Угадайте, о каком явлении:
физическом или химическом
идет речь в стихотворениях.
Вам
Слайд 6Унылая пора!
Очей очарованье!
Приятна мне твоя прощальная краса-
Люблю я пышное
природы
В багрец и золото
одетые леса.
А.С.Пушкин
Слайд 83. В декабре, в декабре Все деревья в серебре. Нашу речку, словно в
С.Я.Маршак
Слайд 94. А если медь в печи нагреть. То станет тяжелее медь С окалиною
Е. Ефимовский
Слайд 105. Что за звездочки резные На пальто и на платке? Все сквозные, вырезные, А
Е. Благинина
Слайд 116. На рукомойнике моем Позеленела медь. Но так играет луч на нем, Что весело
А. Ахматова
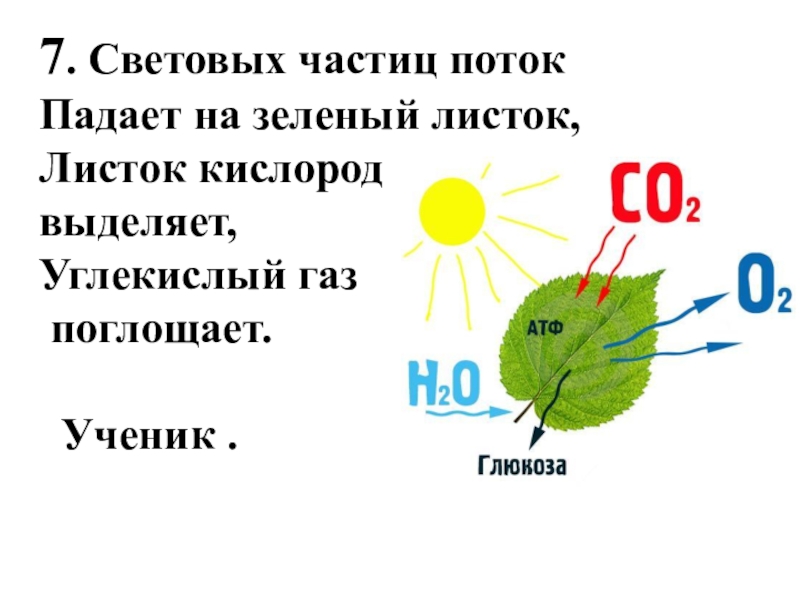
Слайд 127. Световых частиц поток
Падает на зеленый листок,
Листок кислород
выделяет,
Углекислый газ
поглощает.
Ученик .
Слайд 138.Когда металл в крутые формы льем, Мне верится, что оживут в металле Горячие
А. Кравцов
Слайд 14Самопроверка
Выполнено без ошибок – оценка 5
Допущено 1-2 ошибки
Допущено 3-4ошибки – оценка 3
Допущено более 4-х ошибок – оценка 2
Слайд 16"...Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего
Общие вопросы:
Что такое химическое уравнение?
Как он формулируется в настоящее время?
Какое отношение химическое уравнение имеет к этому закону?
Кто автор этого закона?
Как называется этот закон?
Слайд 17Задание 2. Закон сохранения массы веществ. Расстановка коэффициентов.
В – 1. Поставьте
К + О2 → К2О
Zn + H3PO4 → Zn3(PO4)2 + H2
Ca(OH)2 + H3 PO4 → Ca3(PO4)2 + H2O
C2H2 + O2 → CO2 + H2O
Слайд 18Задание 2. Закон сохранения массы веществ. Расстановка коэффициентов.
В – 2. Поставьте
Al + О2 → Al2О3
Ca + H3PO4 → Ca3(PO4)2 + H2
Fe(OH)3 + H2 SO4 → Fe2(SO4)3+ H2O
C3H6 + O2 → CO2 + H2O
Слайд 19Задание 2. Закон сохранения массы веществ. Расстановка коэффициентов.
В – 1. Поставьте
4К + О2 → 2К2О (3 б)
3Zn + 2H3PO4 → Zn3(PO4)2 + 3H2 (4 б)
3Ca(OH)2 + 2H3PO4→Ca3(PO4)2 + 3H2O (4б)
2C2H2 + 5O2 → 4CO2 + 2H2O (4б)
Слайд 20Задание 2. Закон сохранения массы веществ. Расстановка коэффициентов.
В – 2. Поставьте
4Al + 3О2 → 2Al2О3 (3 б)
3Ca + 2H3PO4 → Ca3(PO4)2 + 3H2 (4 б)
2Fe(OH)3 + 3H2 SO4 → Fe2(SO4)3+6H2O (4 б)
2C3H6 + 9O2 → 6CO2 + 6H2O (4 б)
Слайд 21«Назови тип реакции».
Сейчас вам предстоит отгадать загадки.
В тебе я атом заместил, мы подружились даже.
И сразу изменился мир: я сложным стал, а ты простым….
А + ВС → АС + В
В какую реакцию вступили вещества?
Слайд 22 Нас было много, мы соединились,
Такой процесс объединения – реакция
А + В → АВ
Слайд 23 Когда два сложных вещества в реакцию вступают,
И происходят с ними тут сплошные перемены
Такой процесс мы назовем реакцией___________
АВ + СД → АД + СВ
Слайд 24А + В → АВ - соединение
АВ → А + В
А + ВС → АС + В - замещение
АВ + СД → АД + СВ - обмен
Задание 3. Типы химических реакций.
Постарайтесь найти главные признаки по которым можно классифицировать эти реакции.
Слайд 25Надо соотнести в таблице уравнение с типом его реакции и записать
Слайд 29Задание 4. Решение задач.
Железные опилки массой 28 г. опустили в раствор
Петя задачу решил так:
28 г. X г.
Fe + CuCl2 → FeCl2+Cu
1 моль 1 моль
Составил пропорцию
28:1=Х:1, Х=28 г.
ОТВЕТ: 28 грамм меди выделится.
Найдите ошибку.
Слайд 304) 400 г (20% примесей)
2NaOH + H2SO4 = Na2SO4 + 2H2O
Общая задача:
5) В реакцию вступило 300 г силиката магния и соляная кислота. Найдите количество вещества получившейся кремниевой кислоты.
1) 20 моль Х моль
4P + 5O2 = 2P2O5
2) 320 г Х г
2SO2 + O2 = 2SO3
3) 448 л Х л
2N2 + 3H2 = 2NH3
Ответ: 25 моль
Ответ: 400 г.
Ответ: 672 л.
Ответ: 568 г.
Ответ: 3 моль.
Слайд 31Задание 5. Уравнения.
В – 1. По предложенной схеме написать уравнение реакции,
ВОДОРОД + КИСЛОРОД = ВОДА
НАТРИЙ + ВОДА = ГИДРОКСИД НАТРИЯ + ВОДОРОД
СОЛЯНАЯ КИСЛОТА + ГИДРОКСИД НАТРИЯ = ХЛОРИД НАТРИЯ + ВОДА
ГИДРОКСИД ЦИНКА → ОКСИД ЦИНКА + ВОДА
Слайд 32В – 2. Дописать уравнения, если известен тип реакции:
а) Реакция соединения:
Na + Cl2 = б) Реакция замещения:
Zn + HCl = в) Реакция обмена:
KОН + H3PO4 = г) Реакция разложения (получаются два оксида):
Al(OH)3 →
Задание 5. Уравнения.
Слайд 33Задание 5. Уравнения.
В – 1. По предложенной схеме написать уравнение реакции,
ВОДОРОД + КИСЛОРОД = ВОДА
2H2 + O2 = 2H2O -р. соединения (6б)
НАТРИЙ + ВОДА = ГИДРОКСИД НАТРИЯ +
ВОДОРОД
2Na + 2H2O = 2NaOH + H2 - р. Замещения (8б)
СОЛЯНАЯ КИСЛОТА + ГИДРОКСИД НАТРИЯ =
ХЛОРИД НАТРИЯ + ВОДА
HCl + NaOH = NaCl + H2O - р. Обмена (6б)
4. ГИДРОКСИД ЦИНКА → ОКСИД ЦИНКА + ВОДА
Zn(OH)2 = ZnO + H2O - р. Разложения (6б)
Слайд 34В – 2. Дописать уравнения, если известен тип реакции:
а) Реакция соединения:
2Na + Cl2 = 2NaCl - ( 6б) б) Реакция замещения:
Ca + 2HCl = CaCl2 + H2 - (6б) в) Реакция обмена:
3KOH + H3PO4= K3PO4 +3H2O – (8б) г) Реакция разложения (получаются два оксида):
2Al(OH)3 → Al2O3 +3H2O - (6б)
Задание 5. Уравнения.
Слайд 35 Что вам понравилось
или не понравилось
на уроке?
Какие коррективы вы
Над какими умениями вам еще предстоит работать дома?