- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Исходная презентация Подгруппа углерода для подготовки урока химии на повышенном уровне
Содержание
- 1. Исходная презентация Подгруппа углерода для подготовки урока химии на повышенном уровне
- 2. Элементы 14 группыС – углерод, Si –
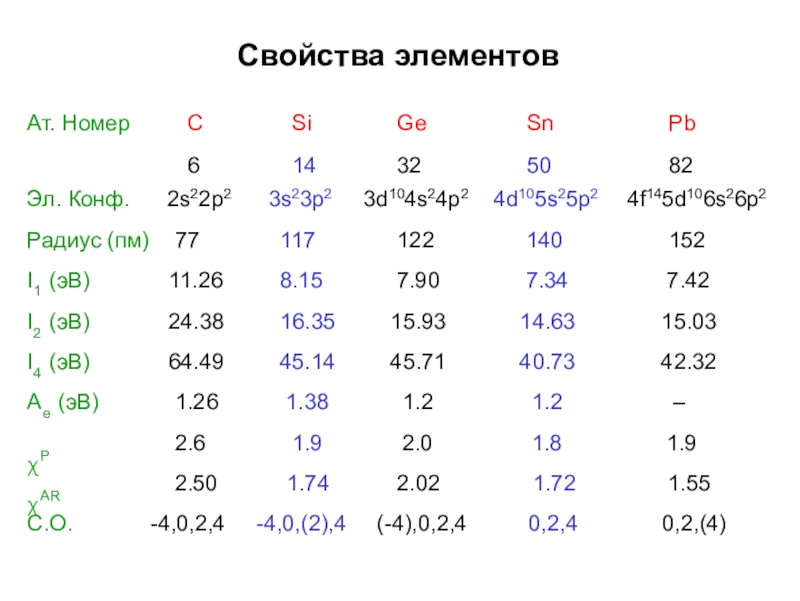
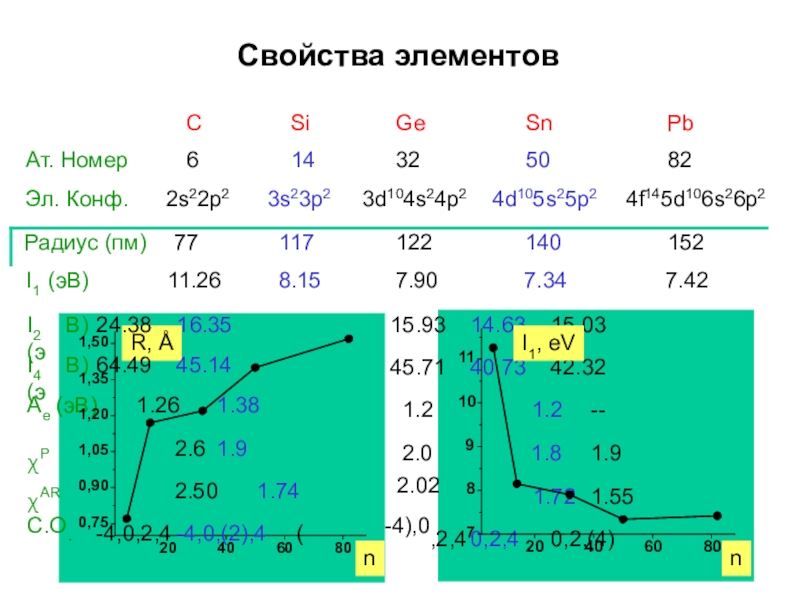
- 3. Свойства элементов
- 4. I2 (эВ) 24.38 16.35В) 64.49 45.14(эВ) 1.26 1.382.6 1.92.50 1.74. -4,0,2,4 -4,0,(2),4 (15.945.71.22.03 14.63 15.031 40.73 42.321.2 --1.8 1.91.72 1.55,2,4 0,2,4 0,2,(4)I4 (эAeχPχAR2.02С.О-4),0Свойства элементов204060800,750,901,051,201,351,50R, Å204060807891011I1, eVnn
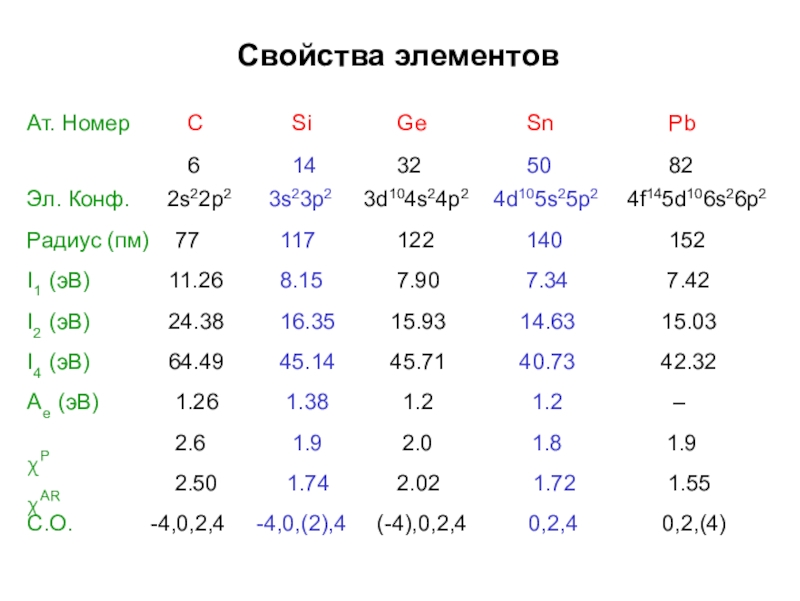
- 5. Свойства элементов
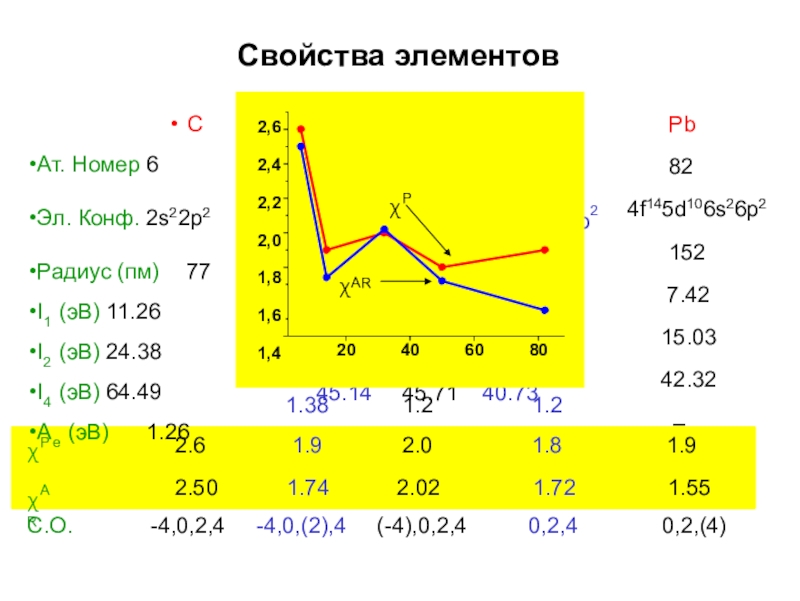
- 6. Свойства элементовСАт. Номер 6Эл. Конф. 2s22p2Радиус (пм) 77I1 (эВ) 11.26I2 (эВ) 24.38I4 (эВ) 64.49Ae (эВ) 1.26Siχ Ge Sn14 32 503s23p2 3d104s24p2 4d105s25117 122 1408.15 7.90 7.3416.35 15.93 14.6345.14 45.71 40.73Pb824f145d106s26p21527.4215.0342.32–p21.381.21.2χP χAR2.62.501.91.742.02.021.81.721.91.55С.О.-4,0,2,4-4,0,(2),4(-4),0,2,40,2,40,2,(4)204060802,62,42,22,01,81,61,4χPχAR
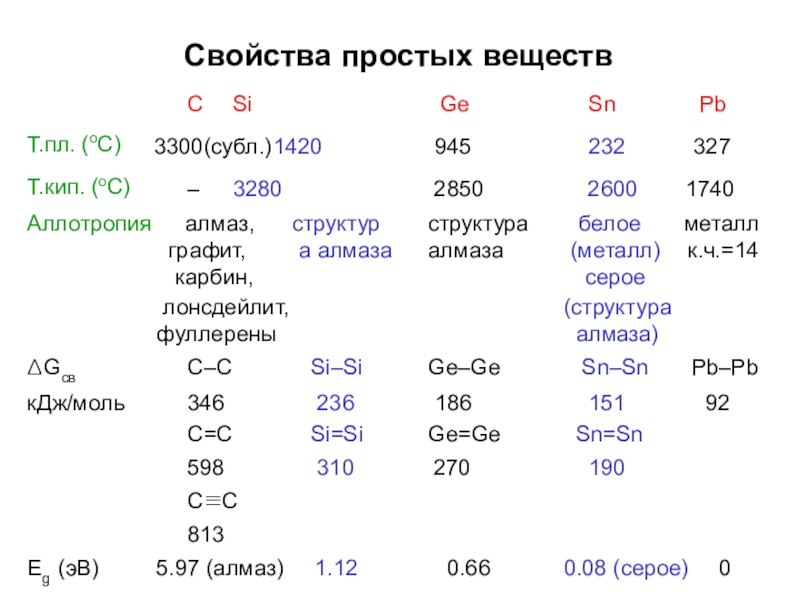
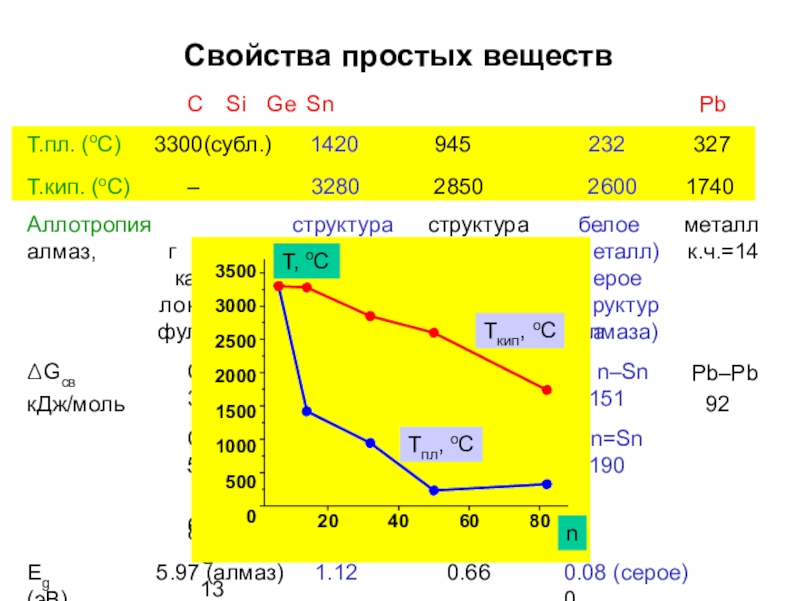
- 7. Свойства простых веществС Si3300(субл.) 1420– 3280Ge9452850Sn2322600Pb3271740Т.пл. (оС)Т.кип. (оС)
- 8. Свойства простых веществС Si Ge SnPbТ.пл. (оС)Т.кип. (оС)3300(субл.)–14203280945285023226003271740Аллотропия алмаз,структураструктурабелоеметалл к.ч.=14гк ло
- 9. Свойства простых веществС3300(субл.)–Si14203280структура алмазаGe9452850структура алмазаSn2322600белое (металл) серое
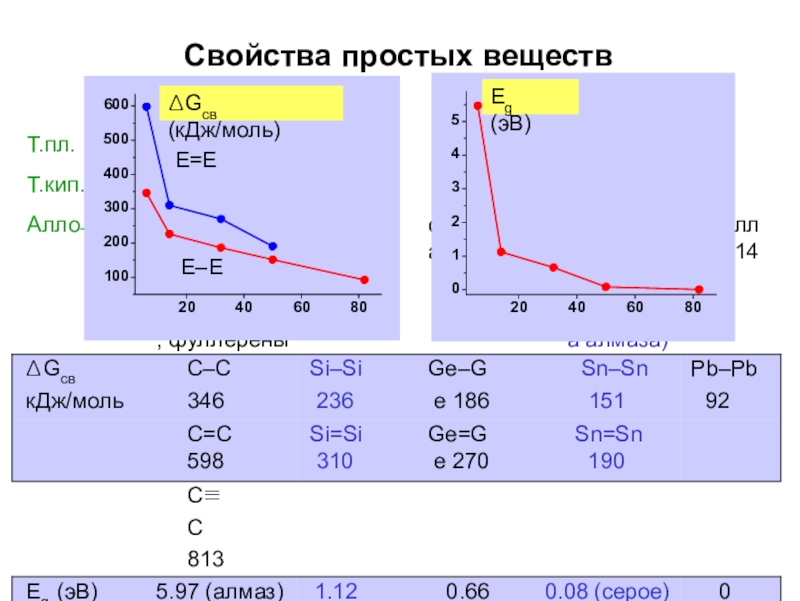
- 10. Свойства простых веществС Si(оС) 3300(субл.) 1420(оС) -- 3280тропия алмаз, структура графит, алмаза карбин,лонсдейлит, фуллереныGe Sn Pb945 232 3272850 2600 1740труктура белое мета лмаза (металл) к.ч.=серое (структура алмаза)Т.пл.Т.кип.Аллослла142040608010020030040050060020406080012345Eg (эВ)ΔGсв (кДж/моль)E–EE=E
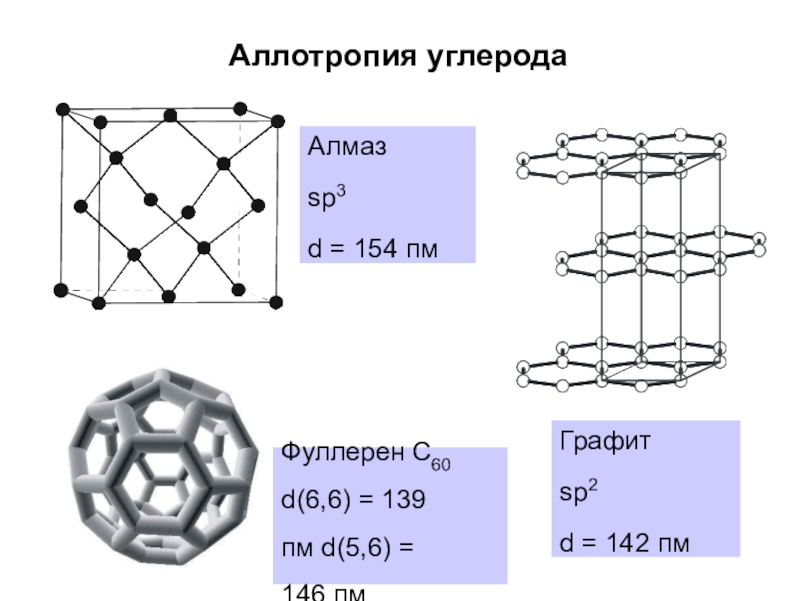
- 11. Аллотропия углеродаАлмазsp3d = 154 пмГрафитsp2d = 142
- 12. Аллотропия углерода
- 13. Новые формы углеродаУглеродная нанотрубкаДлина до 10 мкм, диаметр 10-15 нмГрафен –один слой графитаГрафан –гидрированный графен+Н2плазма
- 14. Новые формы углеродаАндрей ГеймКонстантин НовоселовНобелевская премия по физике 2010 года«за новаторские экспериментыс двумерным материалом – графеном»
- 15. Свойства углерода1. ГорениеC (алмаз) + О2 =
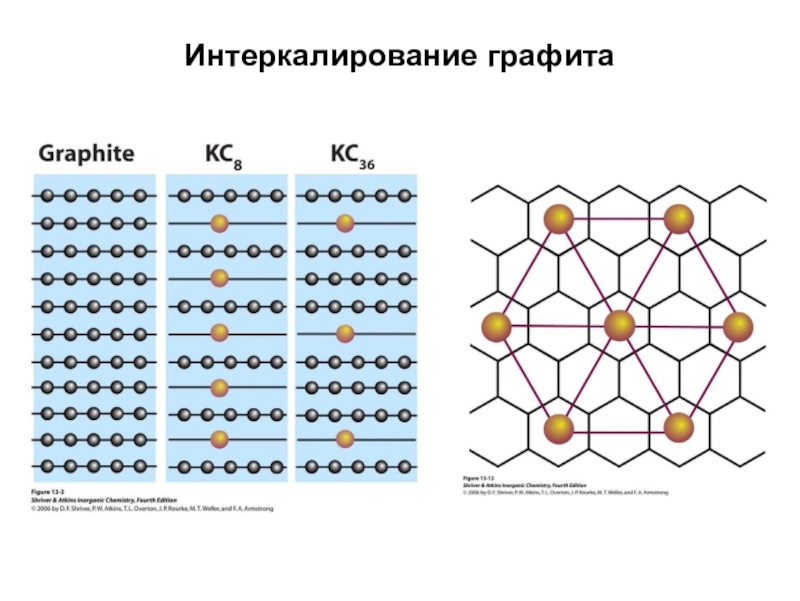
- 16. Интеркалирование графита
- 17. Свойства фуллерена С60С60С60Br24С60F60С60F46 + C60F48[K(crypt-222)]2С60IClCHBr2 (ж)F2, τ70 oCF, NaF200oO2 C6H6LiNHROHK 350 oCK, DMFCrypt-222С60Cl6С60OС60H16 … C60H36K3С60
- 18. Свойства фуллерена С6060 24С60F42) NaFM ж , oC F Br ( F220022F2, τС60 70 oC6 CICl62 HO C 6HH 6С Br6 + C60F48С60F60С60Cl6С60OС60H16 … C60H36K3С60[K(crypt-222)]2С60LiNHROK 350 oCK, DCrypt-2
- 19. Свойства кремния1. Si имеет бóльшую реакционную способность,
- 20. Свойства Ge, Sn, Pb1. Реагируют при нагревании
- 21. Свойства Ge, Sn, PbGe, Sn, Pb окисляются
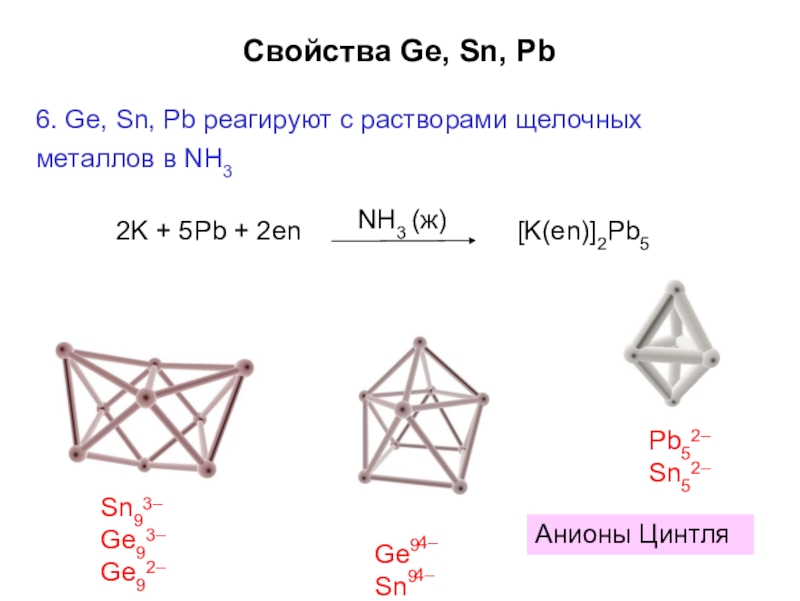
- 22. Свойства Ge, Sn, Pb6. Ge, Sn, Pb
- 23. Получение C, Si, Ge, Sn, PbС добывают
- 24. Применение CАлмаз: украшения, абразивы, резцыГрафит: смазка, электроды,
- 25. Применение Si, Ge, Sn, PbSi: полупроводники, фотовольтаики,
- 26. Гидриды C, Si, Ge, Sn, Pb1.CH4, C2H6,
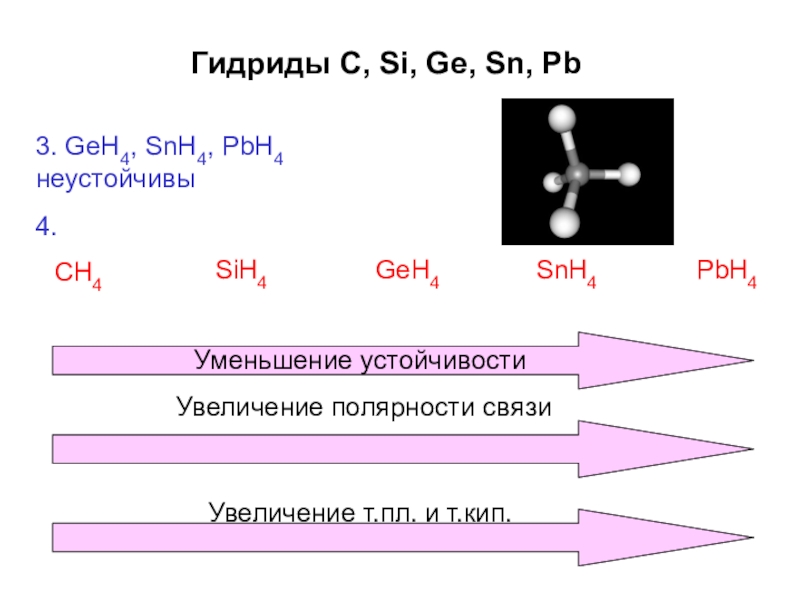
- 27. Гидриды C, Si, Ge, Sn, Pb3. GeH4,
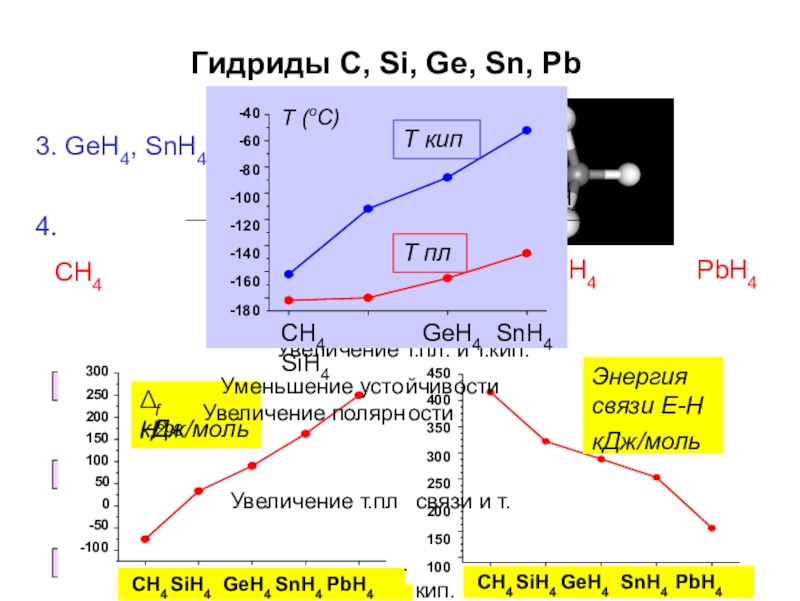
- 28. Гидриды C, Si, Ge, Sn, Pb3. GeH4,
- 29. ионныеионныеметаллическиемолекулярныенеизвестныметаллоидныеКарбиды!
- 30. КарбидыКарбиды активных металлов реагируют с водойCaC2 +
- 31. 200150100500-50-100-150-200-800-600-200-4000200CF4 CCl4CBr4CI4ΔfGo298кДж/мольГалогениды углеродаCF4-184CCl4-23CBr494CI4171Т.пл., оС(разл)кДж/мольCF4CCl4CBr4CI4Т (оС) Т.кип.Т.пл.
- 32. 500-50-100-150-200200150100-800-600-200-400-184 -23 94-128 77 187136 176 194-888 -61 67кип. 200 ΔfGo2980 кДж/мольГалогениды углеродаCF4 CCl4 CBr4CI4Т.пл., оС(разл)Т.кип., оСd(C-X), пм171– 215260ΔfGo298кДж/мольCF4CCl4CBr4CI4CF4 CCl4CBr4CI4Т (оС)Т.пл.Т.0.00.51.01.52.00.00.51.01.52.0Δχd(C-X), ÅCF4CCl4CBr4CI4
- 33. Галогениды углеродаПолучение:SiC + 4F2 = SiF4 +
- 34. Галогениды углеродаCCl4 – хлорирующий агентLa2O3 + 3CCl4
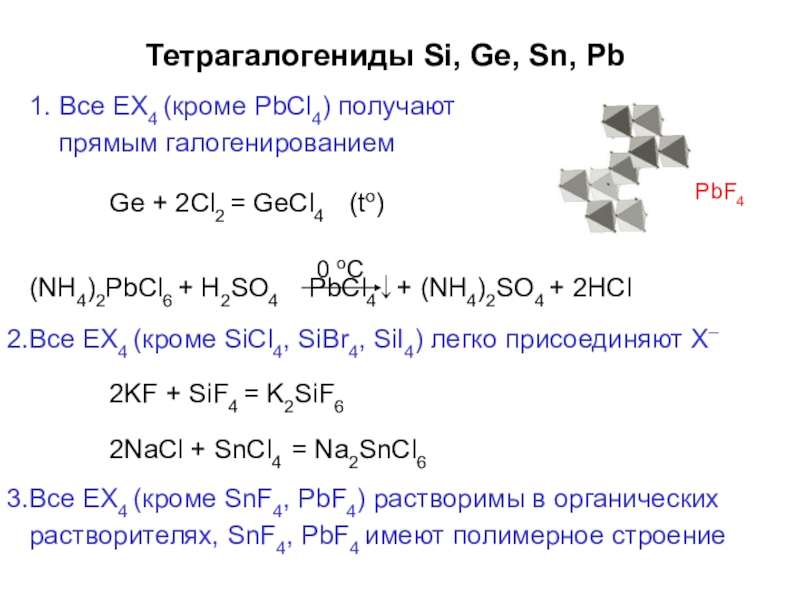
- 35. Тетрагалогениды Si, Ge, Sn, Pbжелтый
- 36. Тетрагалогениды Si, Ge, Sn, PbSiCl4GeCl4 SnCl4С т.пл. –50оС т.пл. -36оС
- 37. PbF4Тетрагалогениды Si, Ge, Sn, Pb1. Все ЕХ4
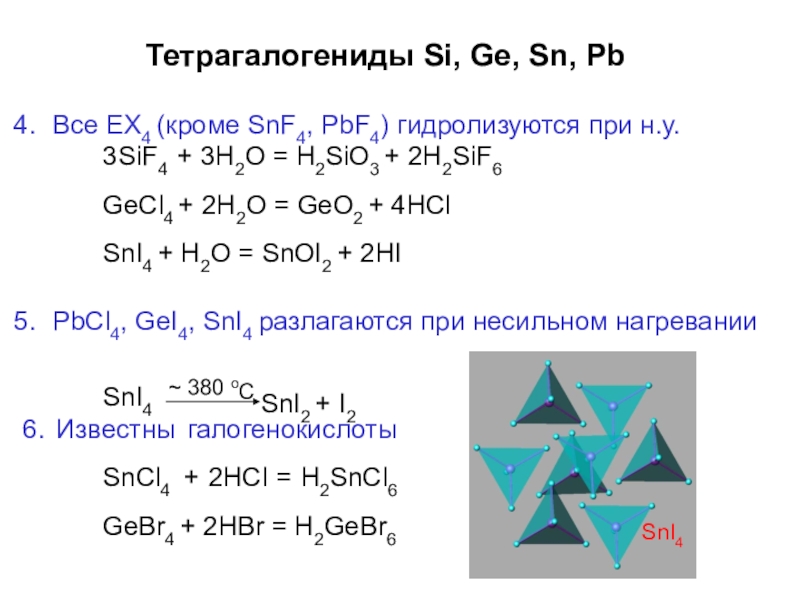
- 38. Тетрагалогениды Si, Ge, Sn, PbВсе ЕХ4 (кроме
- 39. Кислота H2SiF6Гексафторокремниевая кислота H2SiF6 pKa1 = -0.6существует
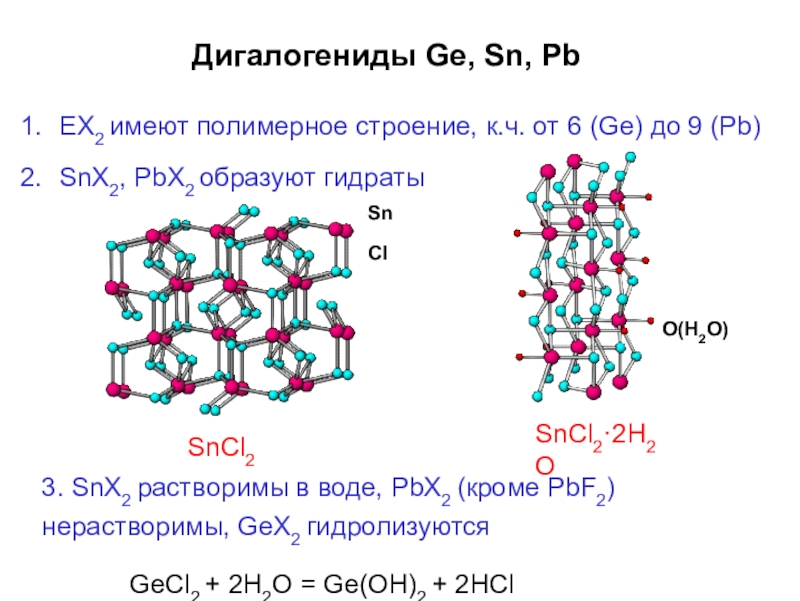
- 40. Дигалогениды Ge, Sn, PbGeF2т.пл. 111 оСGeCl2диспропорц.GeBr2т.пл. 143 оСGeI2т.субл. 240 оСкоричневыйSnF2SnCl2SnBr2SnI2красныйPbF2PbCl2PbBr2PbI2желтый
- 41. Дигалогениды Ge, Sn, PbЕХ2 имеют полимерное строение,
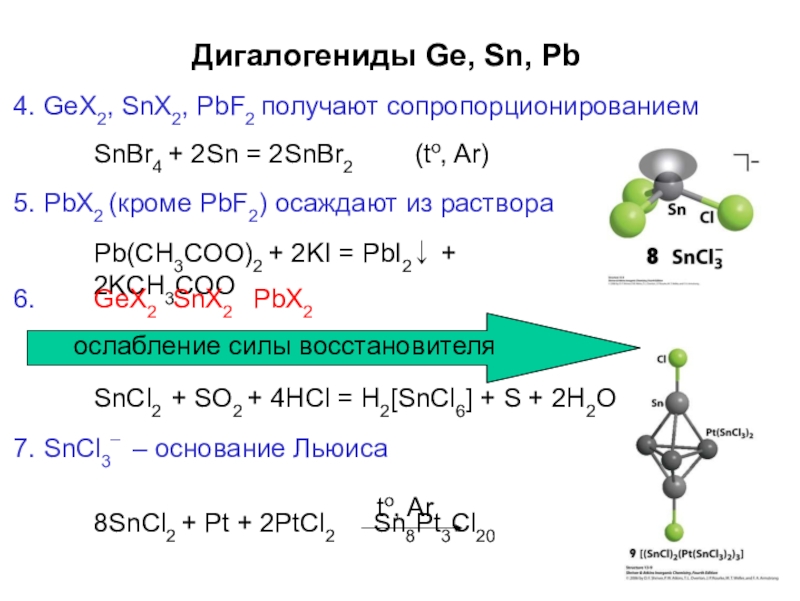
- 42. Дигалогениды Ge, Sn, Pb4. GeX2, SnX2, PbF2
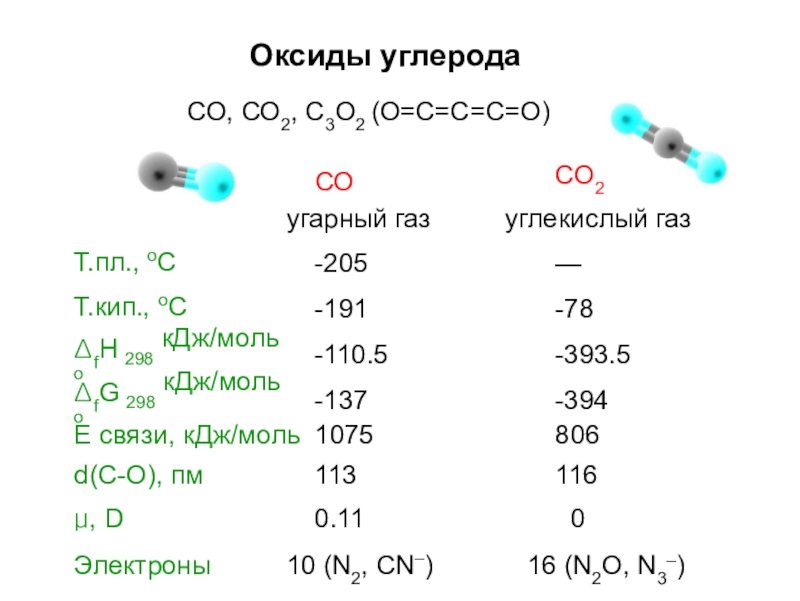
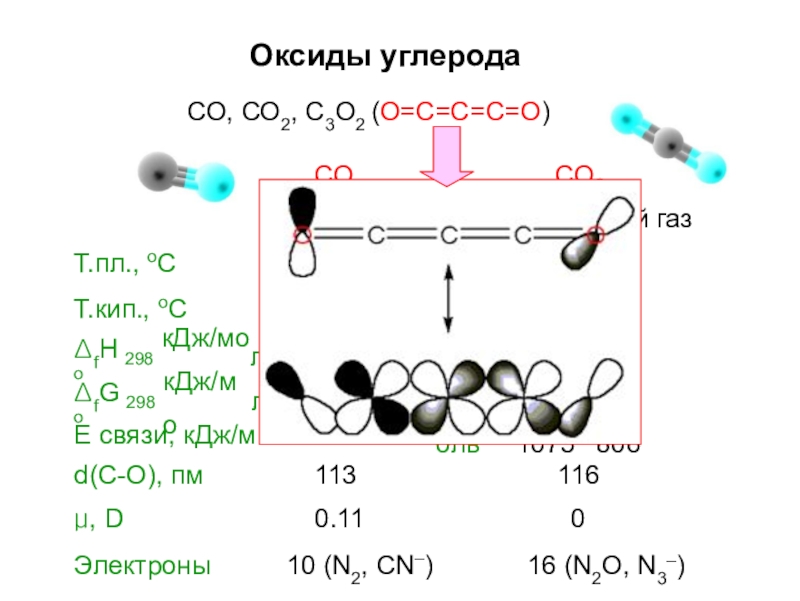
- 43. Оксиды углеродаСО, СО2, С3О2 (О=С=С=С=О)СОСО2угарный газ-205-191-110.5-137углекислый газ—-78-393.5-394Т.пл., оСТ.кип., оСΔfHo298кДж/моль кДж/мольΔfGo298Электроны10 (N2, CN–)16 (N2O, N3 )–
- 44. Оксиды углеродаСОСО2угарный газ углекислы-205 —-191 -78ль -110.5 -393.5ль -137 -394оль 1075 806й газТ.пл., оСТ.кип., оСΔfHo298кДж/мо кДж/моΔfGo298Электроны10 (N2, CN–)16 (N2O, N3 )–СО, СО2, С3О2 (О=С=С=С=О)
- 45. Строение СОσz* π*σz πσs*σs3σ (ВЗМО) – определяет донорные свойства2π (НВМО) – определяет акцепторные свойстваСравнение с N2
- 46. Свойства СОПолучениеCO2 + C = 2COНерастворим в
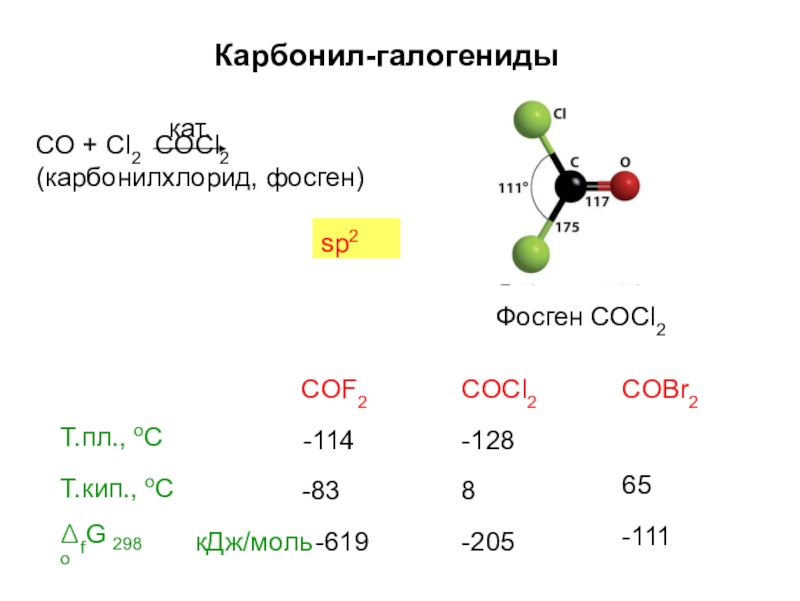
- 47. Карбонил-галогенидыCO + Cl2 COCl2COF2-114-83кДж/моль -619COCl2-1288-205COBr2Т.пл., оСТ.кип., оС65-111ΔfGo298(карбонилхлорид, фосген)sp2Фосген COCl2кат.
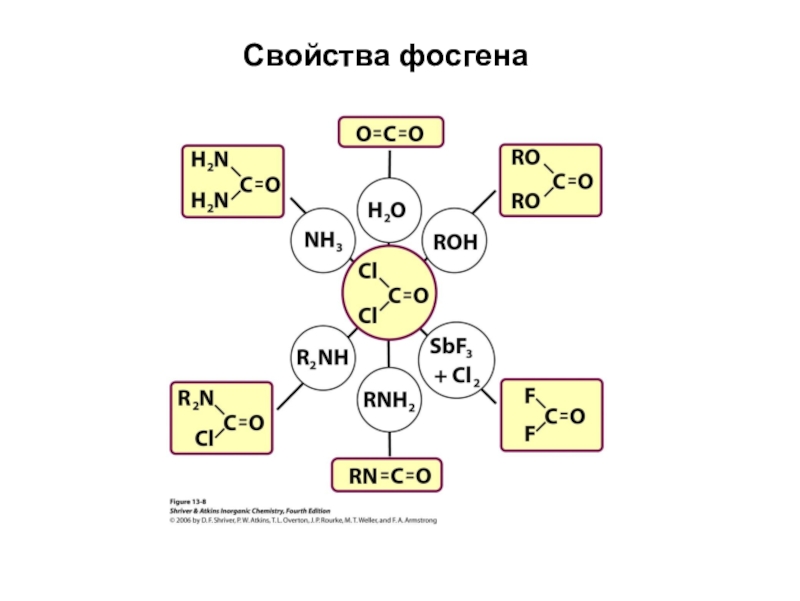
- 48. Свойства фосгена
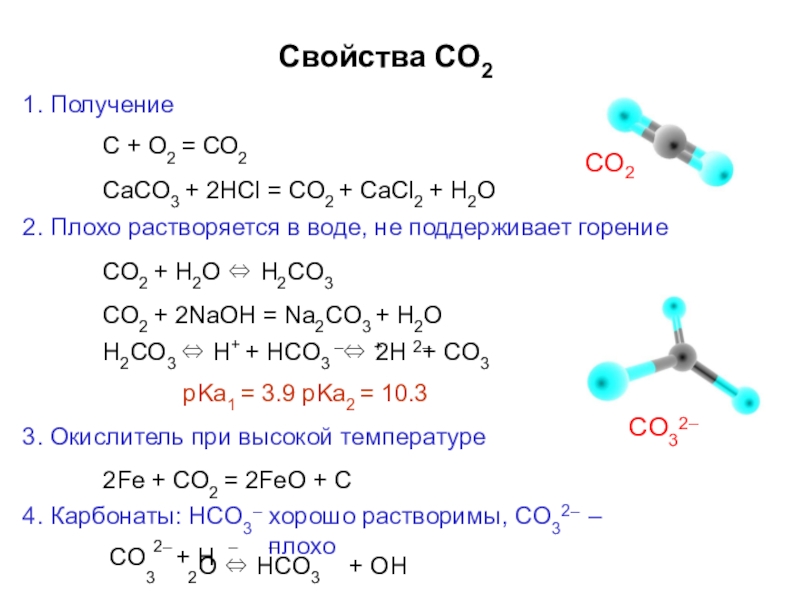
- 49. Свойства СО21. ПолучениеС + О2 = СО2CaCO3
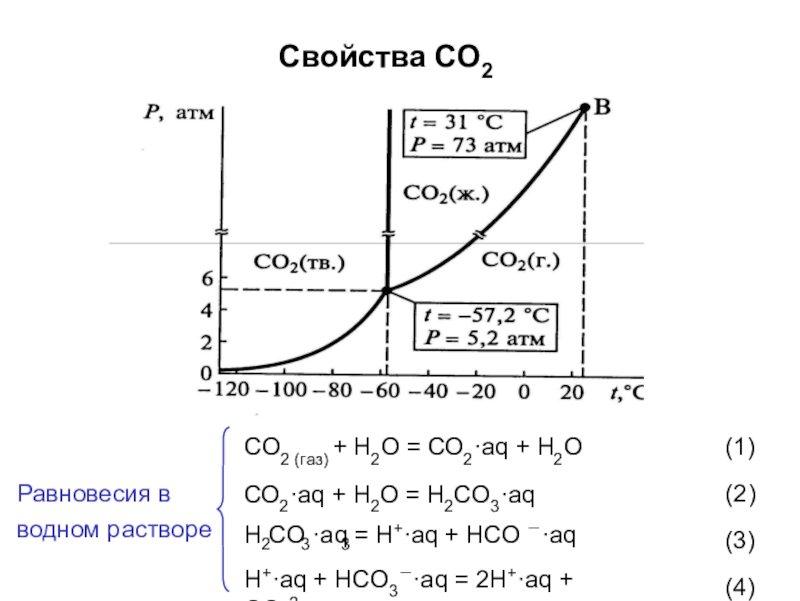
- 50. Свойства СО2Равновесия в водном раствореCO2 (газ) +
- 51. Оборот CO2 : парниковый газCO2ЖивотныеМетаболизм, пожарыCaCO3:известняк, мрамор,
- 52. Оксиды Si, Ge, Sn, PbSiOGeO SnOPbOТакже известны:Pb3O4 (2PbO·PbO2)«сурик»
- 53. Свойства оксидов Si, Ge, Sn, Pb1.SiO GeO SnO PbO2SiO =
- 54. Свойства оксидов Si, Ge, Sn, Pb2.SiO2GeO2SnO2PbO2уменьшение устойчивости
- 55. Особенности SiO21. Кварц (Q), тридимит (T), кристобаллит (С)575oC 870oC 1470oC 1728oCα-Q β-Q β-T β-C163oC 230oCα-T α-C120oCLγ-T2. Низкий коэффициент термического расширения Высокий пьезоэлектрический коэффициент α-Q
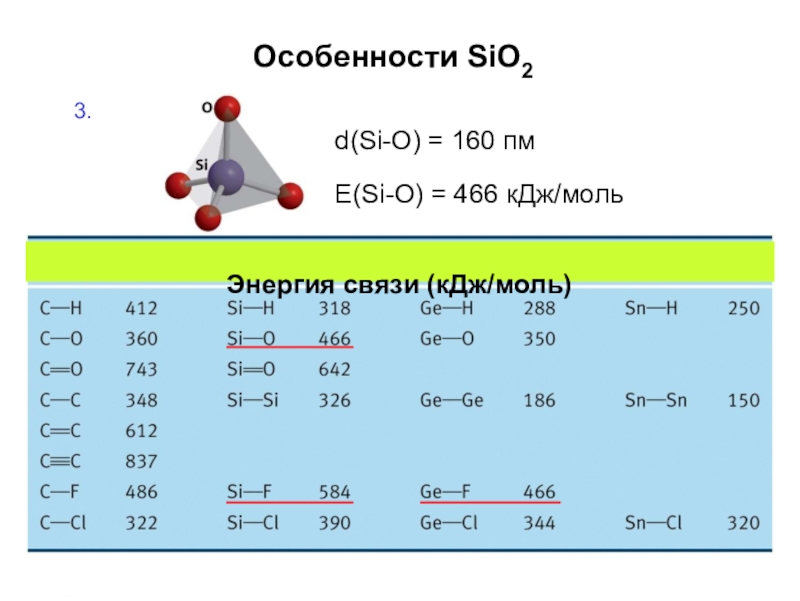
- 56. Особенности SiO23.d(Si-O) = 160 пмE(Si-O) = 466 кДж/мольЭнергия связи (кДж/моль)
- 57. Особенности SiO24. Химически инертенSiO2 + H2O ≠SiO2
- 58. Особенности SiO2Ортокремниевая кислота H4SiO4растворима в воде, pKa1
- 59. Силикаты1. Объединение тетраэдров вбитетраэдры Si2O76–Циклические силикатыЦепочечные силикаты:Be3Al2Si6O18– изумруд, берилл- 2 общие вершины 1 [SiO ]2–∞ 3(сподумен)LiAl(SiO3)2- разветвленные цепи1∞[Si2O5]2–(асбесты)
- 60. Силикаты4. Слоистые силикаты3 общие вершины у каждого
- 61. Цеолиты
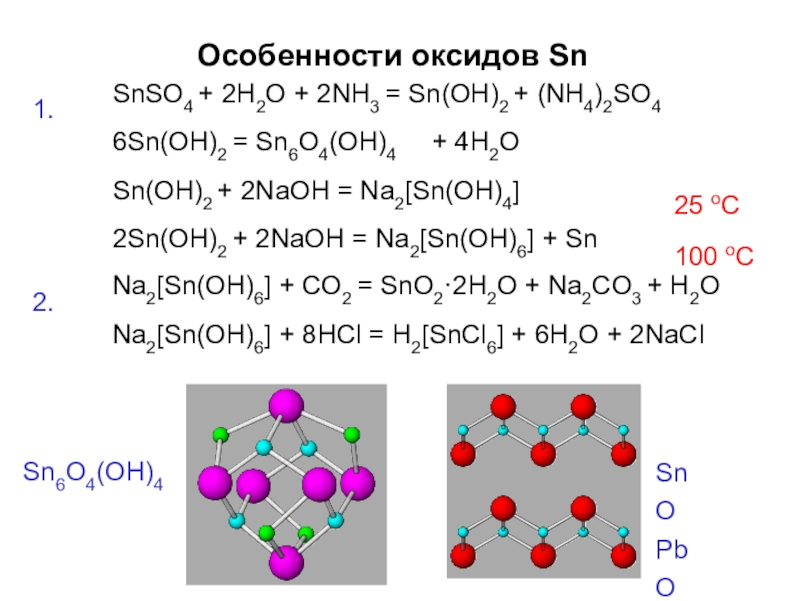
- 62. Особенности оксидов Sn1.SnSO4 + 2H2O + 2NH3
- 63. Сульфиды C, Si, Ge, Sn, PbCS2SiS2 GeS2SnS21. Особые
- 64. Сульфиды C, Si, Ge, Sn, PbGeS SnS PbSПолучениеSnCl2 +
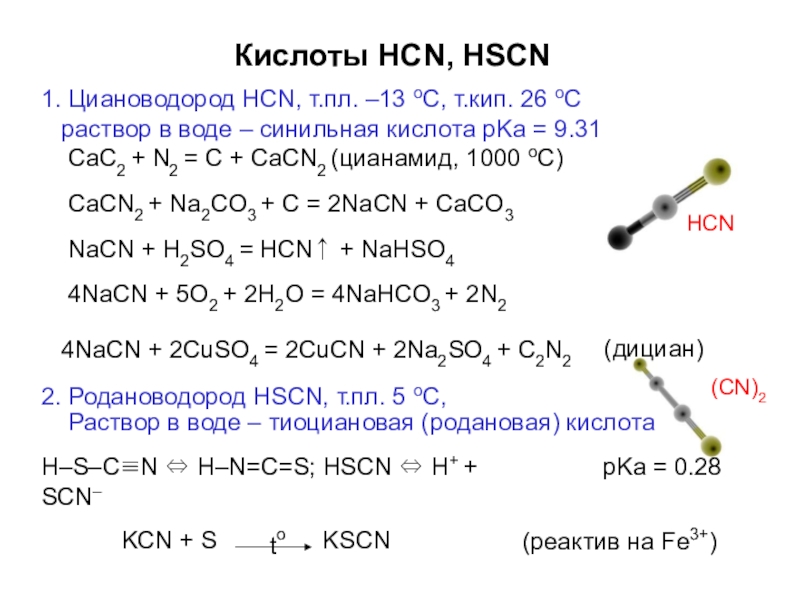
- 65. Кислоты HCN, HSCN1. Циановодород HCN, т.пл. –13
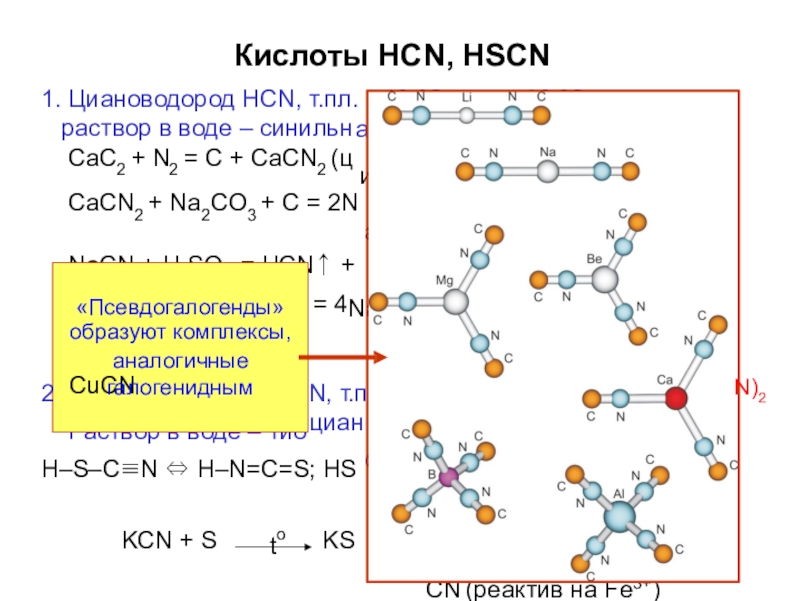
- 66. Кислоты HCN, HSCN1. Циановодород HCN, т.пл. раствор
- 67. Общие закономерностиВ группе усиливается «металлический» характер элементов.Олово
Слайд 4I2 (э
В) 24.38 16.35
В) 64.49 45.14
(эВ) 1.26 1.38
2.6 1.9
2.50 1.74
. -4,0,2,4 -4,0,(2),4 (
15.9
45.7
1.2
2.0
3 14.63 15.03
1 40.73 42.32
1.2 --
1.8 1.9
1.72 1.55
,2,4 0,2,4 0,2,(4)
I4 (э
Ae
χP
χAR
2.02
С.О
-4),0
Свойства элементов
20
40
60
80
0,75
0,90
1,05
1,20
1,35
1,50
R, Å
20
40
60
80
7
8
9
10
11
I1, eV
n
n
Слайд 6Свойства элементов
С
Ат. Номер 6
Эл. Конф. 2s22p2
Радиус (пм) 77
I1 (эВ) 11.26
I2 (эВ) 24.38
I4 (эВ) 64.49
Ae (эВ) 1.26
Siχ Ge Sn
14 32 50
3s23p2 3d104s24p2 4d105s25
117 122 140
8.15 7.90 7.34
16.35 15.93 14.63
45.14 45.71 40.73
Pb
82
4f145d106s26p2
152
7.42
15.03
42.32
–
p2
1.38
1.2
1.2
χP χAR
2.6
2.50
1.9
1.74
2.0
2.02
1.8
1.72
1.9
1.55
С.О.
-4,0,2,4
-4,0,(2),4
(-4),0,2,4
0,2,4
0,2,(4)
20
40
60
80
2,6
2,4
2,2
2,0
1,8
1,6
1,4
χP
χ
AR
Слайд 7Свойства простых веществ
С Si
3300(субл.) 1420
– 3280
Ge
945
2850
Sn
232
2600
Pb
327
1740
Т.пл. (оС)
Т.кип. (оС)
Слайд 8Свойства простых веществ
С Si Ge Sn
Pb
Т.пл. (оС)
Т.кип. (оС)
3300(субл.)
–
1420
3280
945
2850
232
2600
327
1740
Аллотропия алмаз,
структура
структура
белое
металл к.ч.=14
г
к ло фу
рафит, алмаза алмаза (м
арбин, с
нсдейлит, (ст
ллерены а
–C Si–Si Ge–Ge S
46 236 186
=C Si=Si Ge=Ge S
98 310 270
C≡C 13
еталл) ерое
лмаза)
ΔGсв
кДж/моль
C
n–Sn
Pb–Pb 92
3
151
C
n=Sn
5
190
8
Eg (эВ)
5.97 (алмаз)
1.12
0.66
0.08 (серое) 0
20
40
60
80
3500
3000
2500
2000
1500
1000
500
0
T, oC
Tпл, oC
Tкип, oC
n
Слайд 9Свойства простых веществ
С
3300(субл.)
–
Si
1420
3280
структура алмаза
Ge
945
2850
структура алмаза
Sn
232
2600
белое (металл) серое (структура алмаза)
Sn–Sn 151
Sn=Sn 190
Pb
327
1740
металл
Т.пл. (оС)
Т.кип. (оС)
Аллотропия алмаз,
графит, карбин, лонсдейлит, фуллерены
ΔGсв
кДж/моль
C–C 346
C=C 598
C≡C 813
5.97 (алмаз)
Si–Si 236
Si=Si 310
Ge–Ge 186
Ge=Ge 270
Pb–Pb 92
Eg (эВ)
1.12
0.66
0.08 (серое)
0
Слайд 10Свойства простых веществ
С Si
(оС) 3300(субл.) 1420
(оС) -- 3280
тропия алмаз, структура графит, алмаза карбин,
лонсдейлит, фуллерены
Ge Sn Pb
945 232 327
2850 2600 1740
труктура белое мета лмаза (металл) к.ч.=
серое (структура алмаза)
Т.пл.
Т.кип.
Алло
с
лл
а
14
20
40
60
80
100
200
300
400
500
600
20
40
60
80
0
1
2
3
4
5
Eg
ΔGсв (кДж/моль)
E–E
E=E
Слайд 11Аллотропия углерода
Алмаз
sp3
d = 154 пм
Графит
sp2
d = 142 пм
Фуллерен С60 d(6,6) =
Слайд 13Новые формы углерода
Углеродная нанотрубка
Длина до 10 мкм, диаметр 10-15 нм
Графен –
один
Графан –
гидрированный графен
+Н2
плазма
Слайд 14Новые формы углерода
Андрей Гейм
Константин Новоселов
Нобелевская премия по физике 2010 года
«за новаторские
с двумерным материалом – графеном»
Слайд 15Свойства углерода
1. Горение
C (алмаз) + О2 = СО2
С (графит) + О2
С (алмаз) ⇔ С (графит) Δф.пGo
298
= −2.8 кДж/моль
Окисление графита
to
12С (графит) + 18HNO3 (конц) → C6(CO2H)6 + 18NO2 + 6H2O
Интеркалирование графита
2C + F2 = 2CF (HF, 450 oC)
(sp2 → sp3)
8C + K = KC8 (180 oC) металл бронзового цвета
δ(С)<0
δ(С)>0
C + H2SO4 (к) = [C24+][HSO4 ]·2H2O (HNO3 конц)
–
Слайд 17Свойства фуллерена С60
С60
С60Br24
С60F60
С60F46 + C60F48
[K(crypt-222)]2С60
ICl
C
H
Br2 (ж)
F2, τ
70 oC
F
, NaF
200
o
O2 C6H6
LiNH
ROH
K 350
K, DMF
Crypt-222
С60Cl6
С60O
С60H16 … C60H36
K3С60
Слайд 18Свойства фуллерена С60
60 24
С60F4
2) NaF
M ж , oC F Br ( F2200
22
F2, τ
С60 70 oC
6 CICl
6
2 H
O C 6H
H 6
С Br
6 + C60F48
С60F60
С60Cl6
С60O
С60H16
K3С60
[K(crypt-222)]2С60
LiNH
RO
K 350 oC
K, D
Crypt-2
Слайд 19Свойства кремния
1. Si имеет бóльшую реакционную способность, чем C
Si + 2F2
Si + 2Cl2 = SiCl4 Si + O2 = SiO2
при н.у. 400 oC
600 oC
2. Si растворяется в щелочах, но не в кислотах
Si + 2KOH + H2O K2SiO3 + 2H2
Si окисляется в присутствии F–
3Si + 4HNO3 + 18HF = 3H2SiF6 + 4NO + 8H2O
Si реагирует с Br2, I2, S, P, N, B при нагревании
Si + 2P = SiP2
600 0C
to
Слайд 20Свойства Ge, Sn, Pb
1. Реагируют при нагревании с галогенами, кислородом, серой
2.
Sn + 2HCl = 2SnCl2 + H2
(Pb ?)
Слайд 21Свойства Ge, Sn, Pb
Ge, Sn, Pb окисляются кислотами-окислителями 3Pb + 8HNO3
Ge, Sn растворимы в щелочах при нагревании
Sn + 2KOH + 4H2O = K2[Sn(OH)6] + 2H2 Ge + 2KOH + 2H2O2 = K2[Ge(OH)6]
Ge, Sn реагируют с растворами галогенов в неполярных растворителях
Sn + 2I2 = SnI4 (60 oC, CCl4)
Слайд 22Свойства Ge, Sn, Pb
6. Ge, Sn, Pb реагируют с растворами щелочных
2K + 5Pb + 2en
[K(en)]2Pb5
NH3 (ж)
Pb5
2–
Sn5
2–
Sn9
3–
Ge9
3–
Ge9
2–
Ge 4–
9
Sn 4–
9
Анионы Цинтля
Слайд 23Получение C, Si, Ge, Sn, Pb
С добывают в виде угля, графита
Si – из песка и силикатов SiO2 + 2C = 2CO + Si SiO2 + 2Mg = 2MgO + Si
Ge – из обогащенных отходов производства Zn, Ni
GeO2 + 2H2 = Ge + 2H2O
Sn – из минерала касситерита
SnO2 + C = Sn + CO2
Pb – из сульфидных минералов (PbS – галенит)
2PbS + 3O2 = 2PbO + 2SO2 PbO + CO = Pb + CO2
Слайд 24Применение C
Алмаз: украшения, абразивы, резцы
Графит: смазка, электроды, тугоплавкие материалы, замедлители нейтронов,
Сажа: краски, резина
Активированный уголь: адсорбент, в медицине
Волокна: усилители полимеров
Слайд 25Применение Si, Ge, Sn, Pb
Si: полупроводники, фотовольтаики, преобразователи солнечной энергии, силиконы
SiO2:
Ge: полупроводники, ИК-оптика
Sn: покрытия, производство сплавов (бронза, припои), аналитические цели, полупроводники
SnO2: пигмент, сенсоры, прозрачные проводники
Pb: пигменты, свинцовые аккумуляторы
Слайд 26Гидриды C, Si, Ge, Sn, Pb
1.
CH4, C2H6, … sp3
d = 154
E = 346 кДж/моль E = 598 кДж/моль E = 813 кДж/моль
C2H4, … C2H2, …
Al4C3 + 12H2O = 3CH4 + 4Al(OH)3 CaC2 + 2H2O = C2H2 + Ca(OH)2
2.
Mg2Si + 4H2O = SiH4 + 2Mg(OH)2
(кат. H+)
SiCl4 + Li[AlH4] SiH4 + LiCl + AlCl3
SiH4 Si + 2H2
SiH4 + O2 = SiO2 + 2H2O
Et2O
500 C, Ar
o
SiH4
Слайд 27Гидриды C, Si, Ge, Sn, Pb
3. GeH4, SnH4, PbH4 неустойчивы
4.
CH4
SiH4
GeH4
SnH4
PbH4
Уменьшение устойчивости
Увеличение
Слайд 28Гидриды C, Si, Ge, Sn, Pb
3. GeH4, SnH4
4.
CH4
, PbH4 неустойчивы
CH4 SiH4 GeH4 SnH4 Pb
Уменьшение устойчивости
SiH4 GeH4 Sn
Увеличение
Увеличение т.пл. и т.кип.
H4
PbH4
Уменьшение усто
Увеличение полярн Увеличение т.пл
йчивости
ости связи и т.кип.
.
300
250
200
150
100
50
0
-50
-100
Δ Ho
f 298
кДж/моль
СH4 SiH4 GeH4 SnH4 PbH4
450
400
350
300
250
200
150
100
СH4 SiH4 GeH4 SnH4 PbH4
Энергия
связи E-H
кДж/моль
H4
-40
-60
-80
-100
-120
-140
-160
-180
СH4 SiH4
GeH4
SnH4
Т (oC)
Т кип
Т пл
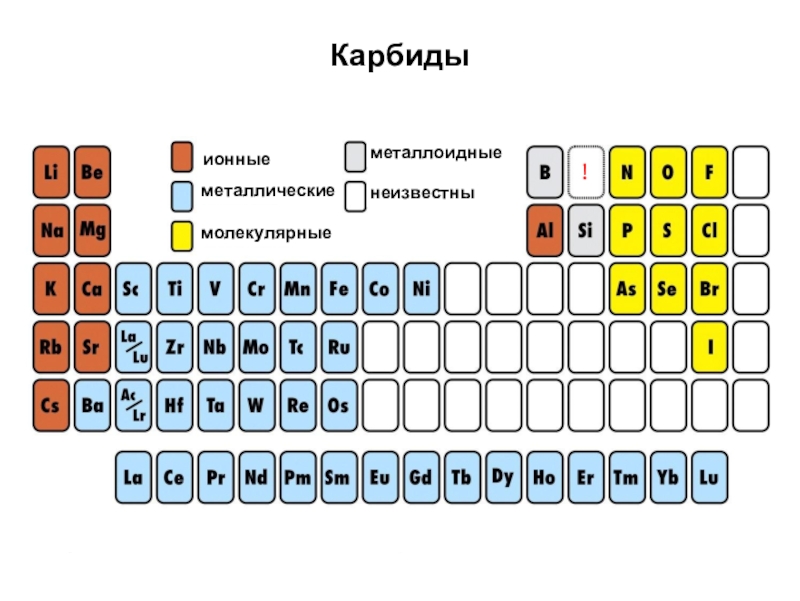
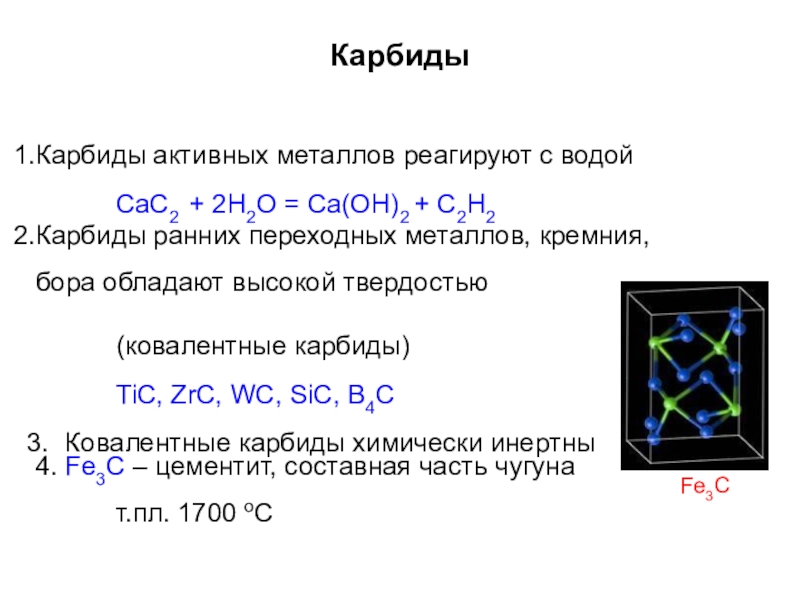
Слайд 30Карбиды
Карбиды активных металлов реагируют с водой
CaC2 + 2H2O = Ca(OH)2 +
Карбиды ранних переходных металлов, кремния, бора обладают высокой твердостью
(ковалентные карбиды)
TiC, ZrC, WC, SiC, B4C
Ковалентные карбиды химически инертны
4. Fe3C – цементит, составная часть чугуна т.пл. 1700 оС
Fe3C
Слайд 31200
150
100
50
0
-50
-100
-150
-200
-800
-600
-200
-400
0
200
CF4 CCl4
CBr4
CI4
ΔfGo
298
кДж/моль
Галогениды углерода
CF4
-184
CCl4
-23
CBr4
94
CI4
171
Т.пл., оС
(разл)
кДж/моль
CF4
CCl4
CBr4
CI4
Т (оС) Т.кип.
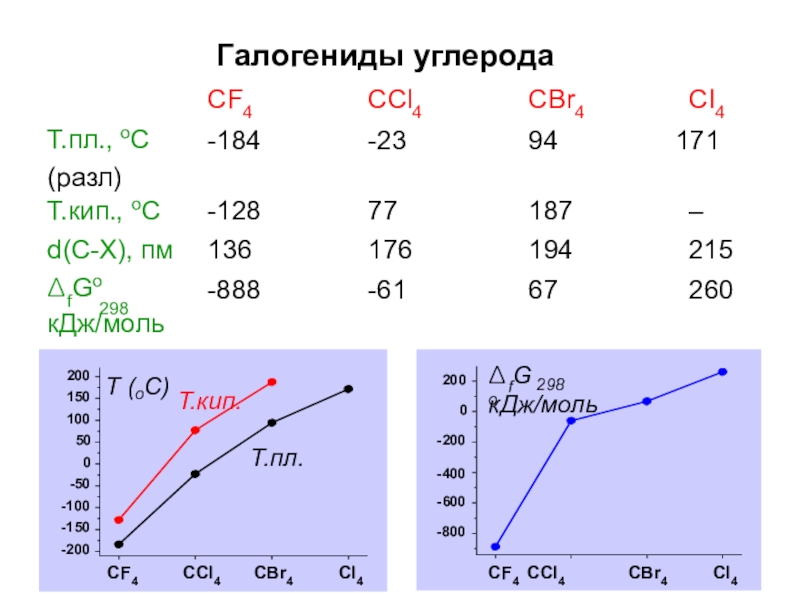
Т.пл.
Слайд 3250
0
-50
-100
-150
-200
200
150
100
-800
-600
-200
-400
-184 -23 94
-128 77 187
136 176 194
-888 -61 67
кип. 200 ΔfGo
298
0 кДж/моль
Галогениды углерода
CF4 CCl4 CBr4
CI4
Т.пл., оС
(разл)
Т.кип., оС
d(C-X), пм
171
– 215
260
ΔfGo
298
кДж/моль
CF4
CCl4
CBr4
CI4
CF4 CCl4
CBr4
CI4
Т (оС)
Т.пл.
Т.
0.0
0.5
1.0
1.5
2.0
0.0
0.5
1.0
1.5
2.0
Δχ
d(C-X), Å
CF
4
CCl
4
CBr
4
CI
4
Слайд 33Галогениды углерода
Получение:
SiC + 4F2 = SiF4 + CF4
(очистка NaOH)
CS2 + 2Cl2 CCl4
3CCl4 + 4AlBr3 = 3CBr4 + 4AlCl3
CCl4 + 4C2H5I CI4 + 4C2H5Cl
AlCl3
FeS
Свойства:
Низкая реакционная способность
Не реагируют с водой и не растворяются в ней
Не присоединяют Х–
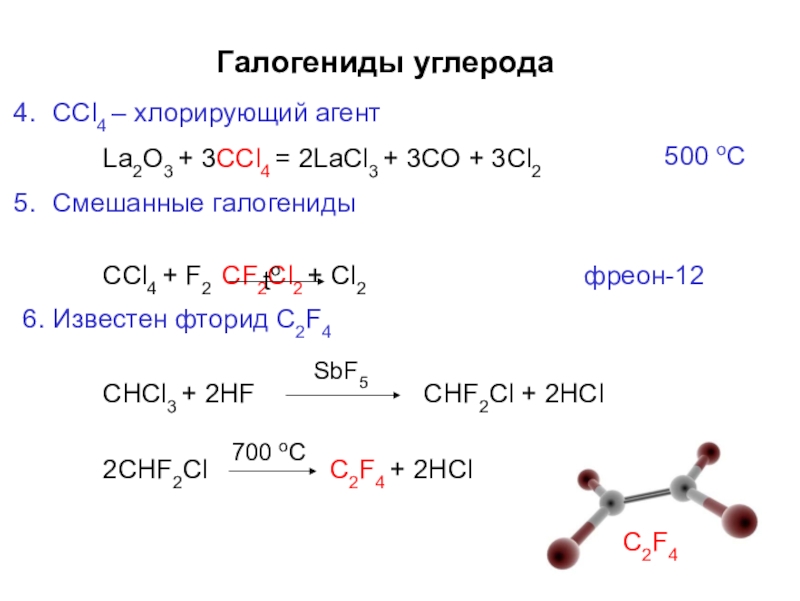
Слайд 34Галогениды углерода
CCl4 – хлорирующий агент
La2O3 + 3CCl4 = 2LaCl3 + 3CO
Смешанные галогениды
500 oC
CCl4 + F2 CF2Cl2 + Cl2
фреон-12
6. Известен фторид C2F4
CHCl3 + 2HF
CHF2Cl + 2HCl
2CHF2Cl
C2F4 + 2HCl
to
SbF5
700 oC
C2F4
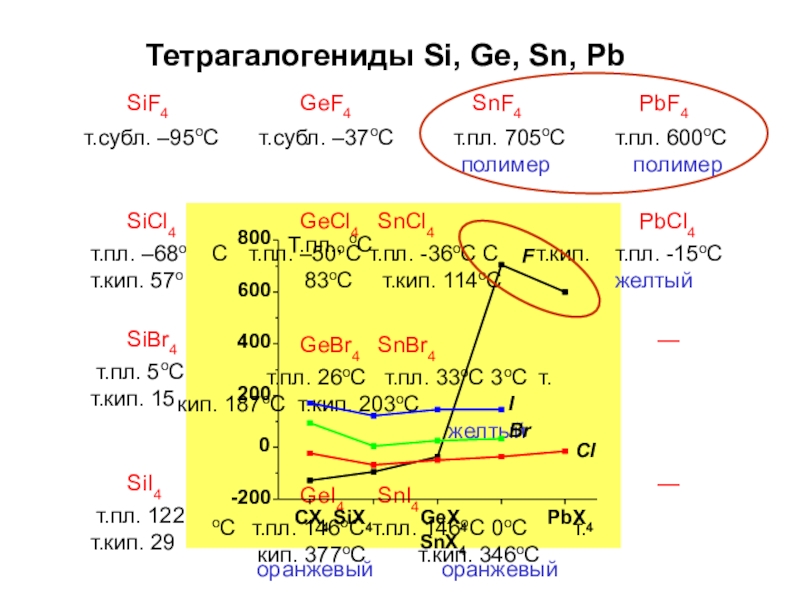
Слайд 36Тетрагалогениды Si, Ge, Sn, Pb
SiCl4
GeCl4 SnCl4
С т.пл. –50оС т.пл. -36оС С т.кип. 83оС т.кип.
GeBr4 SnBr4
т.пл. 26оС т.пл. 33оС 3оС т.кип. 187оС т.кип. 203оС
желтый
GeI4 SnI4
оС т.пл. 146оС т.пл. 146оС 0оС т.кип. 377оС т.кип. 346оС
PbCl4
т.пл. –68о
т.пл. -15оС
т.кип. 57о
желтый
SiBr4
—
т.пл. 5оС
т.кип. 15
SiI4
—
т.пл. 122
т.кип. 29
оранжевый
оранжевый
-200
0
200
400
600
800
CX4 SiX4
GeX4 SnX4
PbX4
T.пл., oC
F
I
Br
Cl
Слайд 37PbF4
Тетрагалогениды Si, Ge, Sn, Pb
1. Все ЕХ4 (кроме PbCl4) получают прямым
Ge + 2Cl2 = GeCl4 (to)
(NH4)2PbCl6 + H2SO4 PbCl4↓+ (NH4)2SO4 + 2HCl
Все ЕХ4 (кроме SiCl4, SiBr4, SiI4) легко присоединяют Х–
2KF + SiF4 = K2SiF6
2NaCl + SnCl4 = Na2SnCl6
Все ЕХ4 (кроме SnF4, PbF4) растворимы в органических растворителях, SnF4, PbF4 имеют полимерное строение
0 oC
Слайд 38Тетрагалогениды Si, Ge, Sn, Pb
Все ЕХ4 (кроме SnF4, PbF4) гидролизуются при
3SiF4 + 3H2O = H2SiO3 + 2H2SiF6 GeCl4 + 2H2O = GeO2 + 4HCl SnI4 + H2O = SnOI2 + 2HI
PbCl4, GeI4, SnI4 разлагаются при несильном нагревании
SnI4
6. Известны галогенокислоты SnCl4 + 2HCl = H2SnCl6 GeBr4 + 2HBr = H2GeBr6
C SnI2 + I2
~ 380
o
SnI4
Слайд 39Кислота H2SiF6
Гексафторокремниевая кислота H2SiF6 pKa1 = -0.6
существует только в водных растворах
d(Si–F) = 169
пм
Изоэлектронность:
SiF 2– ↔ PF 1–
6 6
— SF6
3SiF4 + 3H2O = H2SiO3↓ + 2H2SiF6 SiO2 + 6HF (р-р) = H2SiF6 + 2H2O SiF4 + 2NaF (р-р) = Na2SiF6
SiF6
2–
Слайд 40Дигалогениды Ge, Sn, Pb
GeF2
т.пл. 111 оС
GeCl2
диспропорц.
GeBr2
т.пл. 143 оС
GeI2
т.субл. 240 оС
коричневый
SnF2
SnCl2
SnBr2
SnI2
красный
PbF2
PbCl2
PbBr2
PbI2
желтый
Слайд 41Дигалогениды Ge, Sn, Pb
ЕХ2 имеют полимерное строение, к.ч. от 6 (Ge)
SnX2, PbX2 образуют гидраты
SnCl2
SnCl2·2H2O
Sn Cl
O(H2O)
3. SnX2 растворимы в воде, PbX2 (кроме PbF2)
нерастворимы, GeX2 гидролизуются
GeCl2 + 2H2O = Ge(OH)2 + 2HCl
Слайд 42Дигалогениды Ge, Sn, Pb
4. GeX2, SnX2, PbF2 получают сопропорционированием
SnBr4 + 2Sn
(to, Ar)
5. PbX2 (кроме PbF2) осаждают из раствора
Pb(CH3COO)2 + 2KI = PbI2↓ + 2KCH3COO
6.
GeX2 SnX2 PbX2
ослабление силы восстановителя
SnCl2 + SO2 + 4HCl = H2[SnCl6] + S + 2H2O
7. SnCl3 – основание Льюиса
–
8SnCl2 + Pt + 2PtCl2 Sn8Pt3Cl20
to, Ar
Слайд 43Оксиды углерода
СО, СО2, С3О2 (О=С=С=С=О)
СО
СО2
угарный газ
-205
-191
-110.5
-137
углекислый газ
—
-78
-393.5
-394
Т.пл., оС
Т.кип., оС
ΔfHo
298
кДж/моль кДж/моль
ΔfGo
298
Электроны
10 (N2,
16 (N2O, N3 )
–
Слайд 44Оксиды углерода
СО
СО
2
угарный газ углекислы
-205 —
-191 -78
ль -110.5 -393.5
ль -137 -394
оль 1075 806
й газ
Т.пл., оС
Т.кип., оС
ΔfHo
298
кДж/мо кДж/мо
ΔfGo
298
Электроны
10 (N2, CN–)
16 (N2O,
–
СО, СО2, С3О2 (О=С=С=С=О)
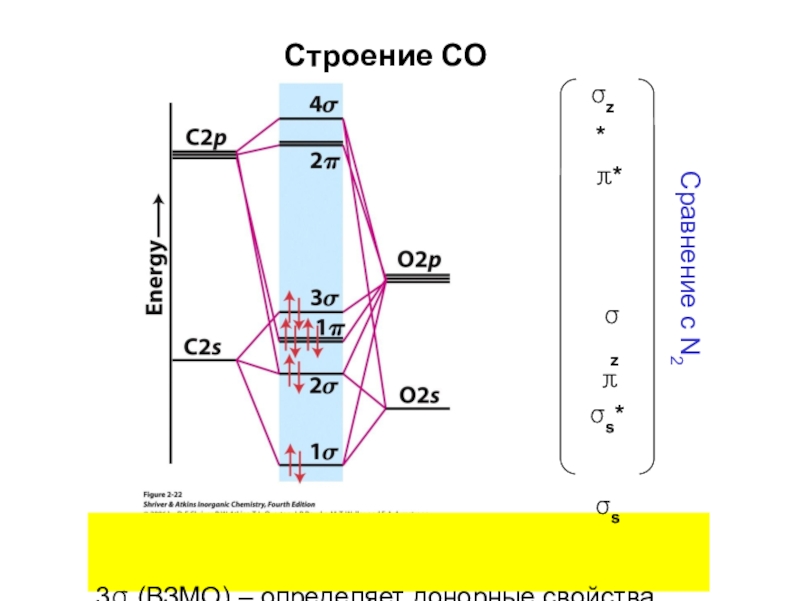
Слайд 45Строение СО
σz* π*
σz π
σs*
σs
3σ (ВЗМО) – определяет донорные свойства
2π (НВМО) –
Сравнение с N2
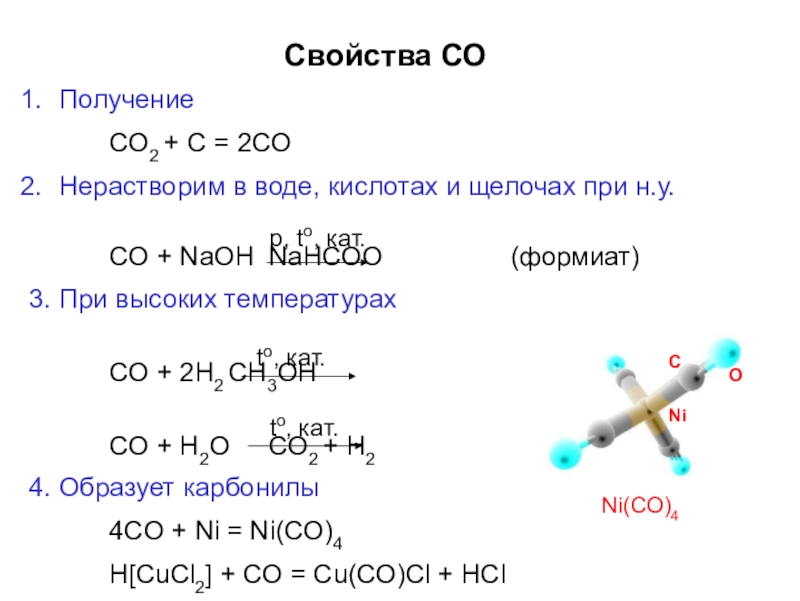
Слайд 46Свойства СО
Получение
CO2 + C = 2CO
Нерастворим в воде, кислотах и щелочах
CO + NaOH NaHCOO
(формиат)
3. При высоких температурах
CO + 2H2 CH3OH
CO + H2O CO2 + H2
4. Образует карбонилы
4CO + Ni = Ni(CO)4
H[CuCl2] + CO = Cu(CO)Cl + HCl
p, to, кат.
to, кат.
Ni(CO)4
Ni
C
O
to, кат.
Слайд 47Карбонил-галогениды
CO + Cl2 COCl2
COF2
-114
-83
кДж/моль -619
COCl2
-128
8
-205
COBr2
Т.пл., оС
Т.кип., оС
65
-111
ΔfGo
298
(карбонилхлорид, фосген)
sp2
Фосген COCl2
кат.
Слайд 49Свойства СО2
1. Получение
С + О2 = СО2
CaCO3 + 2HCl = CO2
2. Плохо растворяется в воде, не поддерживает горение
CO2 + H2O ⇔ H2CO3
CO2 + 2NaOH = Na2CO3 + H2O
H2CO3 ⇔ H+ + HCO3 ⇔ 2H + CO3
– + 2–
pKa1 = 3.9 pKa2 = 10.3
3. Окислитель при высокой температуре
2Fe + CO2 = 2FeO + C
4. Карбонаты: HCO3
–
хорошо растворимы, CO3 – плохо
2–
CO 2– + H – –
3 2O ⇔ HCO3 + OH
CO
2
CO3
2–
Слайд 50Свойства СО2
Равновесия в водном растворе
CO2 (газ) + Н2О = СО2·aq +
СО2·aq + H2O = H2CO3·aq
(1)
(2)
(3)
(4)
H CO ·aq = H+·aq + HCO −·aq
2 3 3
H+·aq + HCO3−·aq = 2H+·aq + CO32−·aq
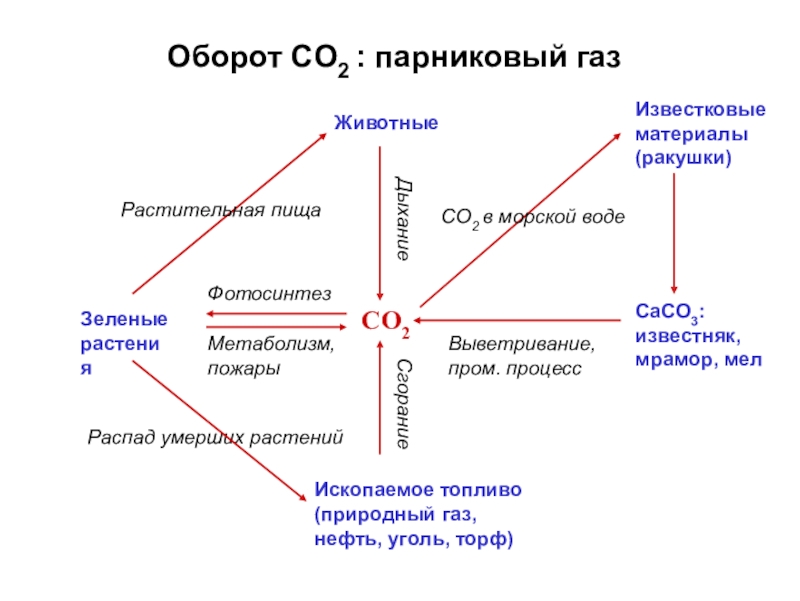
Слайд 51Оборот CO2 : парниковый газ
CO2
Животные
Метаболизм, пожары
CaCO3:
известняк, мрамор, мел
Известковые материалы (ракушки)
Зеленые растения
Распад
Ископаемое топливо (природный газ, нефть, уголь, торф)
Фотосинтез
Дыхание
Растительная пища
СО2 в морской воде
Сгорание
Выветривание, пром. процесс
Слайд 52Оксиды Si, Ge, Sn, Pb
SiO
GeO SnO
PbO
Также известны:
Pb3O4 (2PbO·PbO2)
«сурик» - красный
Pb2O3 (PbO·PbO2)
черный (α),
2Pb3O4
6PbO + O2 2Pb2O3
4PbO + O2
550 oC
520 oC
Слайд 53Свойства оксидов Si, Ge, Sn, Pb
1.
SiO GeO SnO PbO
2SiO = SiO2 + Si
(медленно при
SnO + 2HCl = SnCl2 + H2O
SnO + 2KOH + 3H2O = K2[Sn(OH)4(H2O)2]
3GeO + 12HCl + 2BiCl3 = 2Bi + 3H2[GeCl6] + 3H2O
увеличение устойчивости увеличение основности ослабление силы восстановителя
Слайд 54Свойства оксидов Si, Ge, Sn, Pb
2.
SiO2
GeO2
SnO2
PbO2
уменьшение устойчивости усиление окислительных свойств уменьшение
3PbO2 = Pb3O4 + O2
(280 oC)
5PbO2 + 2Mn(NO3)2 + 6HNO3 = 2HMnO4 + 5Pb(NO3)2 + 2H2O
2PbO2 + 2H2SO4 = 2PbSO4↓ + O2 + 2H2O SnO2 + 2KOH + 2H2O = K2[Sn(OH)6]
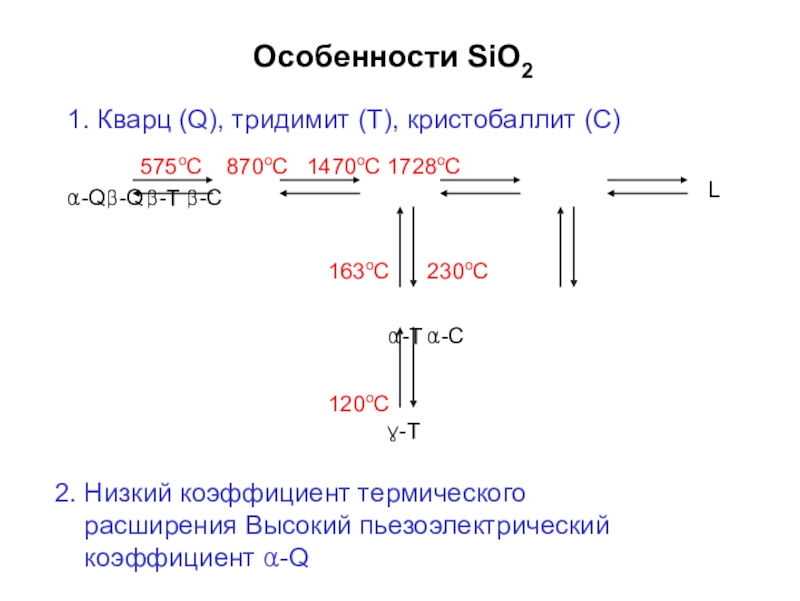
Слайд 55Особенности SiO2
1. Кварц (Q), тридимит (T), кристобаллит (С)
575oC 870oC 1470oC 1728oC
α-Q β-Q β-T β-C
163oC 230oC
α-T α-C
120oC
L
γ-T
2. Низкий коэффициент термического
Слайд 57Особенности SiO2
4. Химически инертен
SiO2 + H2O ≠
SiO2 + 2F2 = SiF4
SiO2 + 2NaOH (конц) Na2SiO3 + H2O
Горячая концентрированная щелочь медленно разъедает стекло
SiO2 + Mg = MgO + SiO SiO2 + 2Mg = 2MgO + Si SiO2 + 4Mg = Mg2Si + 2MgO
to
to
Слайд 58Особенности SiO2
Ортокремниевая кислота H4SiO4
растворима в воде, pKa1 = 9.65
Метакремниевая кислота H2SiO3
не
Силикаты – соли кремниевых кислот, растворимы только Li+, Na+
Na2CO3 + 6SiO2 + CaCO3 = Na2CaSi6O14 + CO2
(стекло)
SiO4 + H2O ⇔ HSiO4 + OH
4– 3–
–
H3SiO4 + H2O ⇔ H4SiO4 + OH 2H3SiO4 ⇔ H4Si2O7 + H2O
1– –
1– 2–
Гидролиз,
«Жидкое стекло»
Слайд 59Силикаты
1. Объединение тетраэдров в
битетраэдры Si2O7
6–
Циклические силикаты
Цепочечные силикаты:
Be3Al2Si6O18
– изумруд, берилл
- 2 общие
∞ 3
(сподумен)
LiAl(SiO3)2
- разветвленные цепи
1
∞[Si2O5]
2–
(асбесты)
Слайд 60Силикаты
4. Слоистые силикаты
3 общие вершины у каждого тетраэдра 2 [Si O ]2–
∞ 2 5
Mg3(OH)2(Si2O5)2
5. Каркасные силикаты
все вершины общие, часть Si замещена на Al или Be
3 n–
∞[AlnSi1-nO2] цеолиты
Na8(Al6Si6O24)S8 – ультрамарин
Слайд 62Особенности оксидов Sn
1.
SnSO4 + 2H2O + 2NH3 = Sn(OH)2 + (NH4)2SO4
Sn(OH)2 + 2NaOH = Na2[Sn(OH)4] 2Sn(OH)2 + 2NaOH = Na2[Sn(OH)6] + Sn
25 oC
100 oC
2.
Na2[Sn(OH)6] + CO2 = SnO2·2H2O + Na2CO3 + H2O Na2[Sn(OH)6] + 8HCl = H2[SnCl6] + 6H2O + 2NaCl
SnO PbO
Sn6O4(OH)4
Слайд 63Сульфиды C, Si, Ge, Sn, Pb
CS2
SiS2 GeS2
SnS2
1. Особые свойства CS2
Растворитель, токсичен, огнеопасен
CH4
(t = 900 K)
3CS2 + 6NaOH = Na2CO3 + 2Na2CS3 + 3H2O
Гидролиз только SiS2
SiS2 + H2O = H2SiO3↓ + H2S
Особенности SnS2
H2[SnCl6] + 2H2S = SnS2 + 6HCl SnS2 + Na2S = Na2SnS3
Слайд 64Сульфиды C, Si, Ge, Sn, Pb
GeS SnS PbS
Получение
SnCl2 + H2S = SnS +
Pb(CH3COO)2 + H2S = PbS + 2CH3COOH
Растворение в полисульфидах (кроме PbS)
SnS + (NH4)2S2 = (NH4)2SnS3
Окисление
3SnS + 4HNO3 = 3SnO2 + 3S + 4NO + 2H2O
Слайд 65Кислоты HCN, HSCN
1. Циановодород HCN, т.пл. –13 оС, т.кип. 26 оС
CaC2 + N2 = C + CaCN2 (цианамид, 1000 оС) CaCN2 + Na2CO3 + C = 2NaCN + CaCO3
NaCN + H2SO4 = HCN↑ + NaHSO4 4NaCN + 5O2 + 2H2O = 4NaHCO3 + 2N2
4NaCN + 2CuSO4 = 2CuCN + 2Na2SO4 + C2N2
2. Родановодород HSCN, т.пл. 5 оС,
(дициан)
Раствор в воде – тиоциановая (родановая) кислота
H–S–C≡N ⇔ H–N=C=S; HSCN ⇔ H+ + SCN–
pKa = 0.28
KCN + S
KSCN
(реактив на Fe3+)
to
HCN
(CN)2
Слайд 66Кислоты HCN, HSCN
1. Циановодород HCN, т.пл. раствор в воде – синильн
CaC2
NaCN + H SO = HCN↑ + N
–13 оС, т.кип. 26 оС ая кислота pKa = 9.31
ианамид, 1000 оС)
aCN + CaCO3 HCN
aHSO4 NaHCO3 + 2N2
+ 2Na2SO4 + C2N2 (дициан)
л. 5 оС, (C
овая (родановая) кислота
CN ⇔ H+ + SCN– pKa = 0.28
CN (реактив на Fe3+)
2 4
4NaCN + 5O2 + 2H2O
4NaCN + 2CuSO4 = 2
. Родановодород HSC
Раствор в воде – тио
= 4
N, т.п
циан
H–S–C≡N ⇔ H–N=C=S; HS
KCN + S
KS
to
образуют комплексы, CuCN
2
N)2
«Псевдогалогенды»
аналогичные галогенидным
Слайд 67Общие закономерности
В группе усиливается «металлический» характер элементов.
Олово и свинец – металлы.
Вниз
для свинца.
Углерод полиморфен. Способность образовывать кратные связи и способность к катенации изменяются по одному ряду (С>>Si>Ge>Sn>Pb).
Вниз по группе уменьшается термическая устойчивость гидридов, увеличивается ионность оксидов и галогенидов.
Вниз по группе уменьшается кислотность оксидов. В ряду Ge – Sn – Pb уменьшается устойчивость оксоанионов, увеличивается устойчивость катионов.
Только свинец проявляет сильные окислительные свойства в высшей степени окисления. В с.о. +2 все элементы, кроме свинца, проявляют восстановительные свойства.







![Исходная презентация Подгруппа углерода для подготовки урока химии на повышенном уровне Свойства фуллерена С60С60С60Br24С60F60С60F46 + C60F48[K(crypt-222)]2С60IClCHBr2 (ж)F2, τ70 oCF, NaF200oO2 C6H6LiNHROHK 350 oCK, DMFCrypt-222С60Cl6С60OС60H16 … C60H36K3С60 Свойства фуллерена С60С60С60Br24С60F60С60F46 + C60F48[K(crypt-222)]2С60IClCHBr2 (ж)F2, τ70 oCF, NaF200oO2 C6H6LiNHROHK 350 oCK, DMFCrypt-222С60Cl6С60OС60H16 … C60H36K3С60](/img/thumbs/60ac7731da4f5a843548a600b517e437-800x.jpg)
![Исходная презентация Подгруппа углерода для подготовки урока химии на повышенном уровне Свойства фуллерена С6060 24С60F42) NaFM ж , oC F Br ( F220022F2, τС60 70 oC6 CICl62 HO C 6HH 6С Br6 + C60F48С60F60С60Cl6С60OС60H16 … C60H36K3С60[K(crypt-222)]2С60LiNHROK 350 oCK, DCrypt-2 Свойства фуллерена С6060 24С60F42) NaFM ж , oC F Br ( F220022F2, τС60 70 oC6 CICl62 HO C 6HH 6С Br6 + C60F48С60F60С60Cl6С60OС60H16 … C60H36K3С60[K(crypt-222)]2С60LiNHROK 350 oCK, DCrypt-2](/img/tmb/7/673776/1e19982a367b06bc8e18f00d48ad24f5-800x.jpg)

















![Исходная презентация Подгруппа углерода для подготовки урока химии на повышенном уровне Силикаты1. Объединение тетраэдров вбитетраэдры Si2O76–Циклические силикатыЦепочечные силикаты:Be3Al2Si6O18– изумруд, берилл- 2 общие вершины 1 [SiO ]2–∞ 3(сподумен)LiAl(SiO3)2- разветвленные цепи1∞[Si2O5]2–(асбесты) Силикаты1. Объединение тетраэдров вбитетраэдры Si2O76–Циклические силикатыЦепочечные силикаты:Be3Al2Si6O18– изумруд, берилл- 2 общие вершины 1 [SiO ]2–∞ 3(сподумен)LiAl(SiO3)2- разветвленные цепи1∞[Si2O5]2–(асбесты)](/img/tmb/7/673776/42a4171a1c99ac99b4fe1e36ae508080-800x.jpg)
![Исходная презентация Подгруппа углерода для подготовки урока химии на повышенном уровне Силикаты4. Слоистые силикаты3 общие вершины у каждого тетраэдра 2 [Si O ]2–∞ 2 5Mg3(OH)2(Si2O5)2 Силикаты4. Слоистые силикаты3 общие вершины у каждого тетраэдра 2 [Si O ]2–∞ 2 5Mg3(OH)2(Si2O5)2 – тальк5. Каркасные силикатывсе вершины общие,](/img/thumbs/0c9b120ec93668a8dd982c0c817c0d15-800x.jpg)