- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Исходная презентация Бор и его соединения для подготовки урока химии на повышенном уровне
Содержание
- 1. Исходная презентация Бор и его соединения для подготовки урока химии на повышенном уровне
- 2. Элементы 13 группыB – бор, Al –
- 3. Свойства элементов
- 4. Свойства бораЕдинственный неметалл в 13 группеОчень высокие
- 5. Строение бораВ основе кристаллического строения бора лежит
- 6. Строение бора
- 7. Строение бора
- 8. Химические свойства бораБор химически инертен. Не реагирует
- 9. Получение бораБор встречается в виде оксидных минераловNa2B4O7·10H2O
- 10. ДиборанBH3 крайне неустойчив. Простейший боргидрид – B2H6MgB2
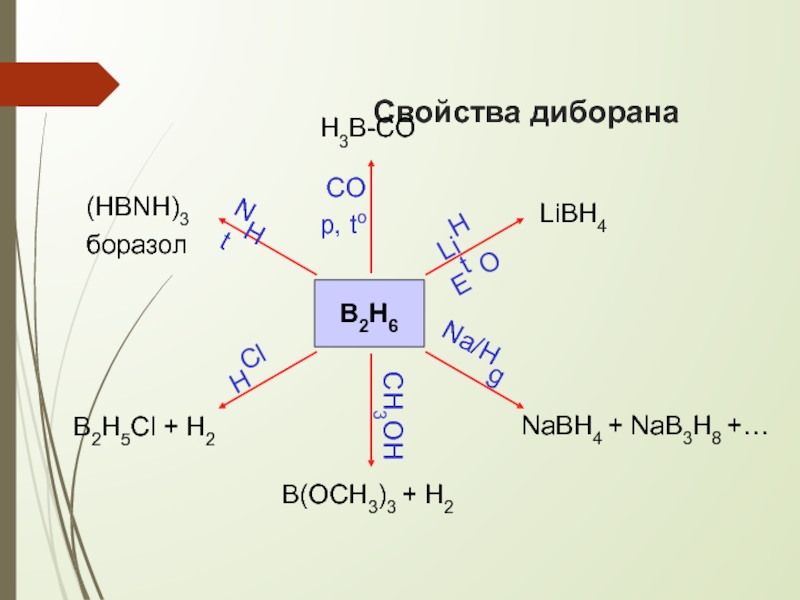
- 11. Свойства диборанаB2H6LiBH4NaBH4 + NaB3H8 +… B2H5Cl + H2NHtCOp, toHClCH3OHNa/HgLiHEtOB(OCH3)3 + H2H3B-CO(HBNH)3боразол
- 12. ТетрагидроборатыПолучениеB2H6 + 2LiH = 2Li[BH4]Na[BH4] растворим в
- 13. -BH+4H-2e–-BH+2HАрахно-B4H10Клозо- B6H62–Нидо-B5H9Ряды боргидридовКлозо-кластер26е– – 6×(B-H)7 СЭП n+1Нидо-кластер24е– –
- 14. БоридыОбразуются большинством металловБориды d-металлов тугоплавки, часто нестехиометричны
- 15. Галогениды бораBX3Плоская молекула∠(X-B-X) = 120o
- 16. Галогениды бораBF3 BCl3BBr3BI3Т.пл., оСТ.кип., оС-128-100-10713-469050210ΔfHo298(г) -1104-407-208-38кДж/мольΔfGo298(г) -1112-339-232+21кДж/мольd(B-X), пм 130 174 188 2BX3Плоская молекула∠(X-B-X) = 120o10200150100500-50-100-1500-200-400-600-800-1000-1200BF3 BCl3BBr3 BI3BF3 BCl3BBr3 BI3кДж/мольΔfG 298ΔfHo298oto, Cт.пл.т.кип.
- 17. Галогениды бораПолучениеB2O3 + 3CaF2 + 3H2SO4 =
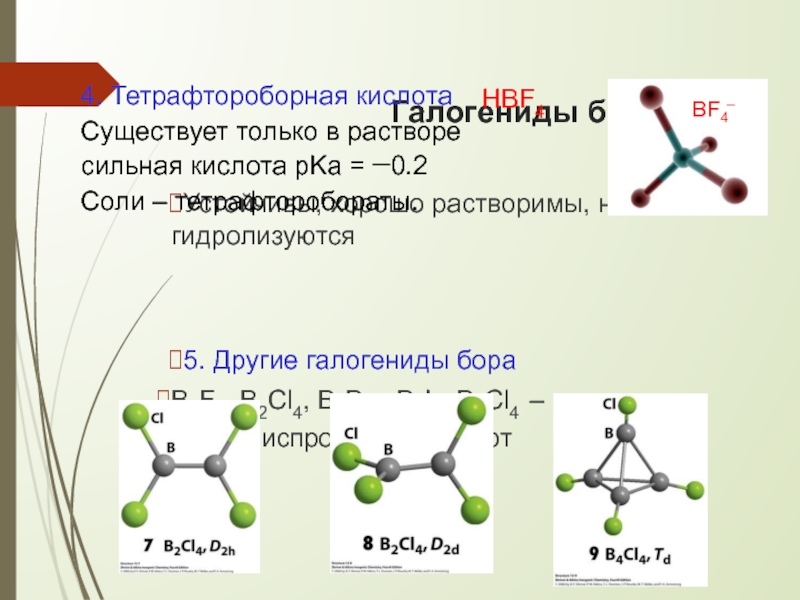
- 18. Галогениды бораУстойчивы, хорошо растворимы, не гидролизуются5. Другие
- 19. Кислородные соединения бора1. Оксид бора B2O3т.пл. 577
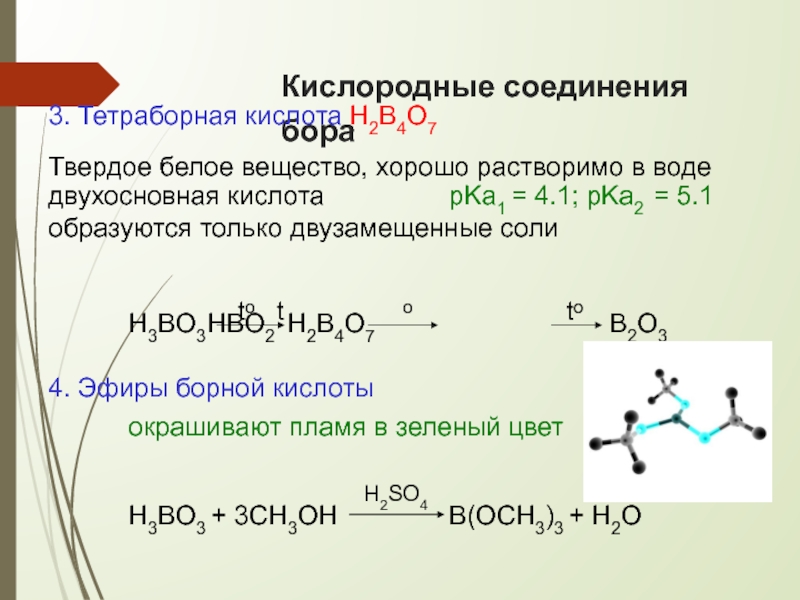
- 20. Кислородные соединения бора3. Тетраборная кислота H2B4O7Твердое белое
- 21. Кислородные соединения бора5. Бораты(в растворе только тетрабораты)4H3BO3
- 22. Борат-анионык.ч. = 3sp2d(B-O) = 136 пмк.ч. =
- 23. Соединения бора с азотомα-BNβ-BNα-BNβ-BNB2O3 (ж) + 2NH3
- 24. Соединения бора с азотом3B2H6 + 6NH3 =
Слайд 4Свойства бора
Единственный неметалл в 13 группе
Очень высокие т.пл. (2573 оС) и
d = 2.35 г/см3 – черный, кристаллический бор
d = 1.73 г/см3 – коричневый, аморфный бор
Кристаллический бор очень твердый
(9.5 по шкале Мооса)
Кристаллический бор – полупроводник, Еg = 1.55 эВ
Бор имеет 2 стабильных изотопа 10В, 11В
10 1
5В + 0n = 2He + 3Li замедление нейтронов
4 7
7. Бор – восстановитель, Е0(Н3ВО3/В) = -0.87 В
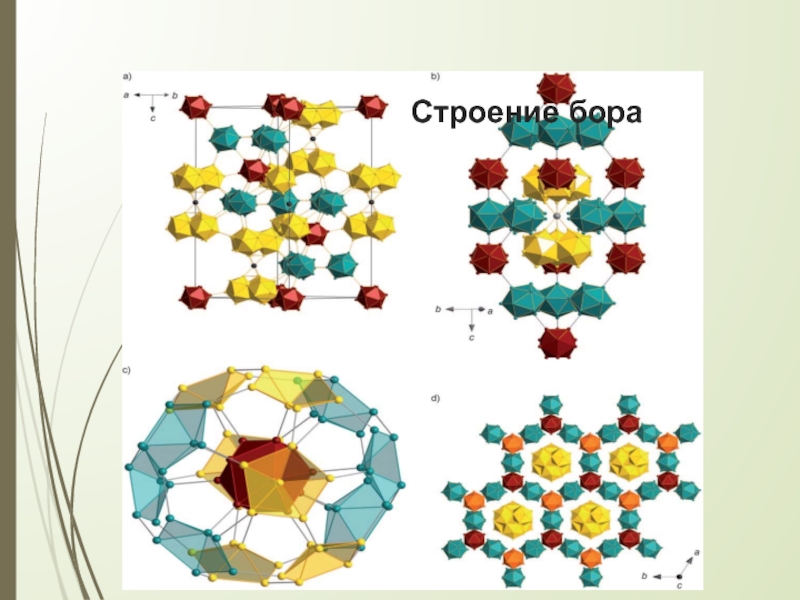
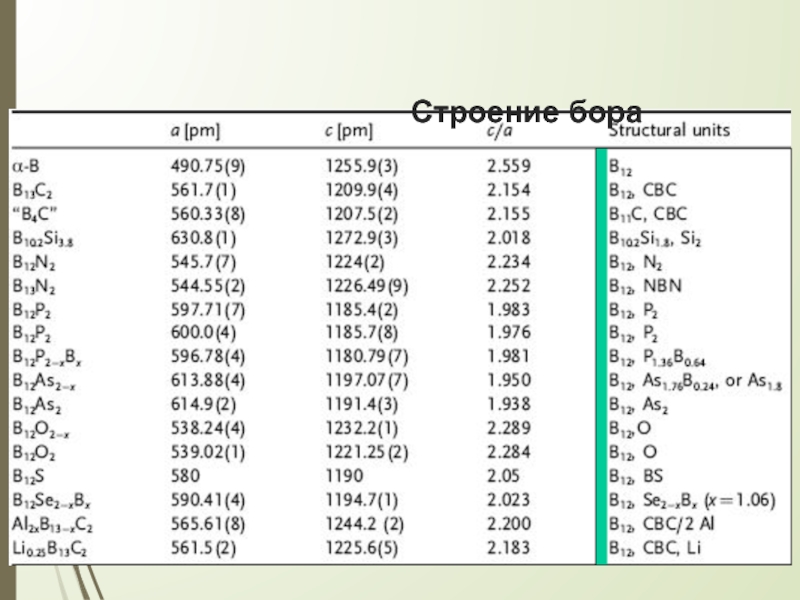
Слайд 5Строение бора
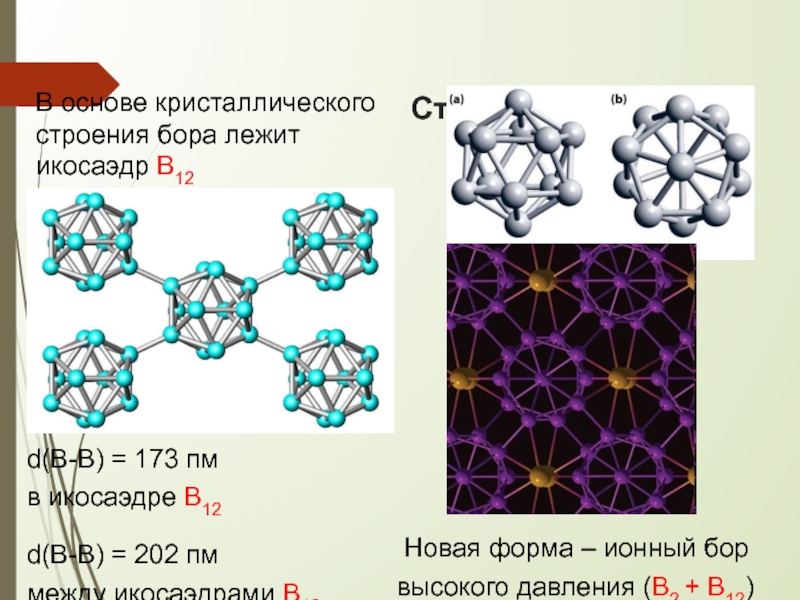
В основе кристаллического строения бора лежит икосаэдр В12
d(B-B) = 173
в икосаэдре В12
d(B-B) = 202 пм
между икосаэдрами В12
Новая форма – ионный бор высокого давления (В2 + В12)
Слайд 8Химические свойства бора
Бор химически инертен. Не реагирует с водой, кислотами и
При нагревании реагирует с неметаллами
oC
oC oC
При Т>1000 оС реагирует со многими
металлами и оксидами
2B + Al = AlB2
10B + 2P2O5 = P4 + 5B2O3
2B + 3H2O = 3H2 + B2O3
Окисляется кислотами-окислителями
и в щелочных расплавах
B + 3HNO3 (конц) = H3BO3 + 3NO2
∼100 oC
2B + KClO3 + 2KOH = 2KBO2 + KCl + H2O
Слайд 9Получение бора
Бор встречается в виде оксидных минералов
Na2B4O7·10H2O Na2B4O7·4H2O MgCaB6O11·6H2O
бура кернит
гидроборацит
Получение аморфного
MgCaB6O11·6H2O + 4HCl + H2O = 6H3BO3 + CaCl2 + MgCl2
to
2H3BO3 B2O3 + 3H2O
B2O3 + 3Mg = 3MgO + 2B
Na2B4O7 + 3Mg = 2NaBO2 + 3MgO + 2B
Получение кристаллического бора
2BBr3 + 3H2 = 6HBr + 2B
Слайд 10Диборан
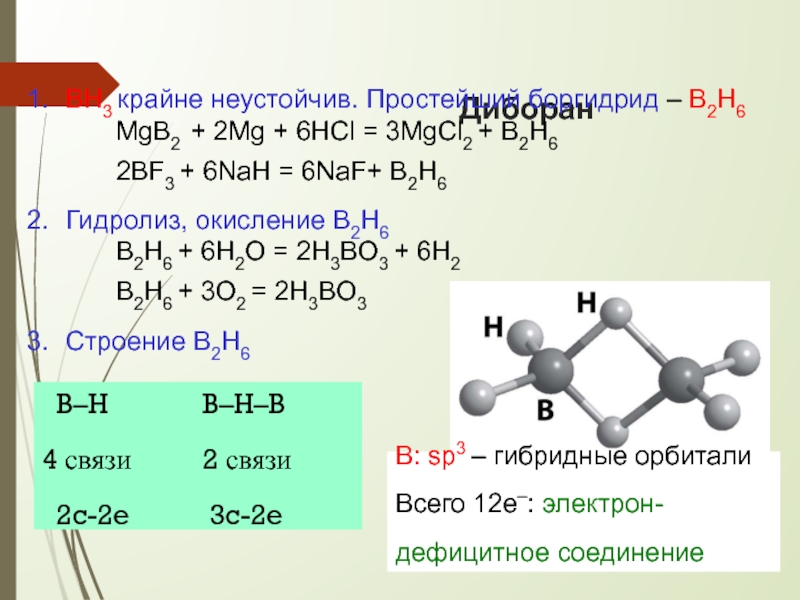
BH3 крайне неустойчив. Простейший боргидрид – B2H6
MgB2 + 2Mg + 6HCl
Гидролиз, окисление B2H6
B2H6 + 6H2O = 2H3BO3 + 6H2 B2H6 + 3O2 = 2H3BO3
Строение B2H6
В: sp3 – гибридные орбитали Всего 12е–: электрон-
дефицитное соединение
B–H
4 связи
2c-2e
B–H–B
2 связи
3c-2e
Слайд 11Свойства диборана
B2H6
LiBH4
NaBH4 + NaB3H8 +…
B2H5Cl + H2
NH
t
CO
p, to
HCl
CH3OH
Na/Hg
LiH
Et
O
B(OCH3)3 + H2
H3B-CO
(HBNH)3
боразол
Слайд 12Тетрагидробораты
Получение
B2H6 + 2LiH = 2Li[BH4]
Na[BH4] растворим в воде, Li[BH4] – гидролизуется
Li[BH4]
Восстановительные свойства
Li[BH4] + 2I2 = BI3 + LiI + 2H2
Li[BH4] + GeCl4 = GeH4 + BCl3 + LiCl
4Li[BH4] + 9H2O = Li2B4O7 + 16H2 + 2LiOH
Другие гидробораты
Na[B3H8], K[B9H14], K[B11H14]
BH –
4
Слайд 13-BH
+4H
-2e–
-BH
+2H
Арахно-B4H10
Клозо- B6H62–
Нидо-B5H9
Ряды боргидридов
Клозо-кластер
26е– – 6×(B-H)
7 СЭП n+1
Нидо-кластер
24е– – 5×(B-H)
7 СЭП n+2
Арахно-кластер
22е– – 4×(B-H)
7
BnHn анионный ряд
2–
B H 2–, B H
6 6 12 12
2–, …
BnHn+4 непредельный ряд Штока
B2H6, B5H9, …
BnHn+6 предельный ряд Штока
B4H10, B5H11, …
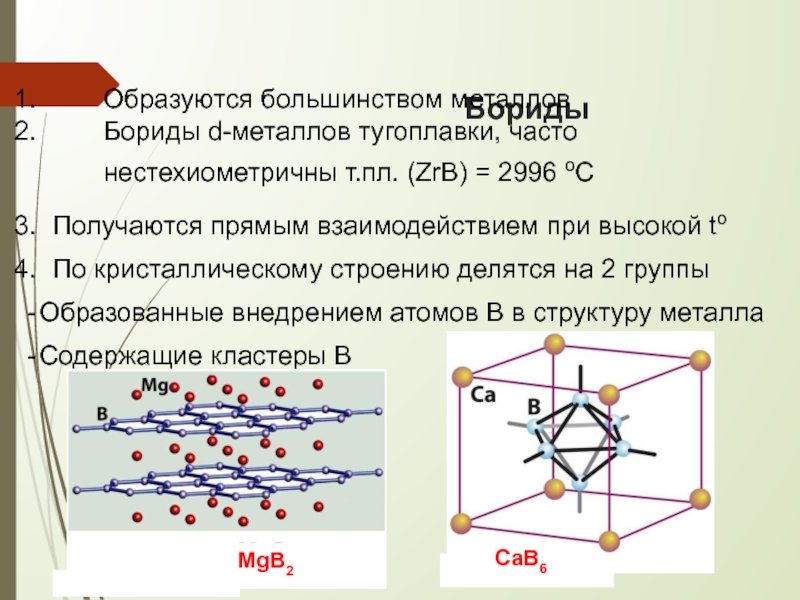
Слайд 14Бориды
Образуются большинством металлов
Бориды d-металлов тугоплавки, часто нестехиометричны т.пл. (ZrB) = 2996
Получаются прямым взаимодействием при высокой to
По кристаллическому строению делятся на 2 группы
Образованные внедрением атомов B в структуру металла
Содержащие кластеры В
MgB2
CaB6
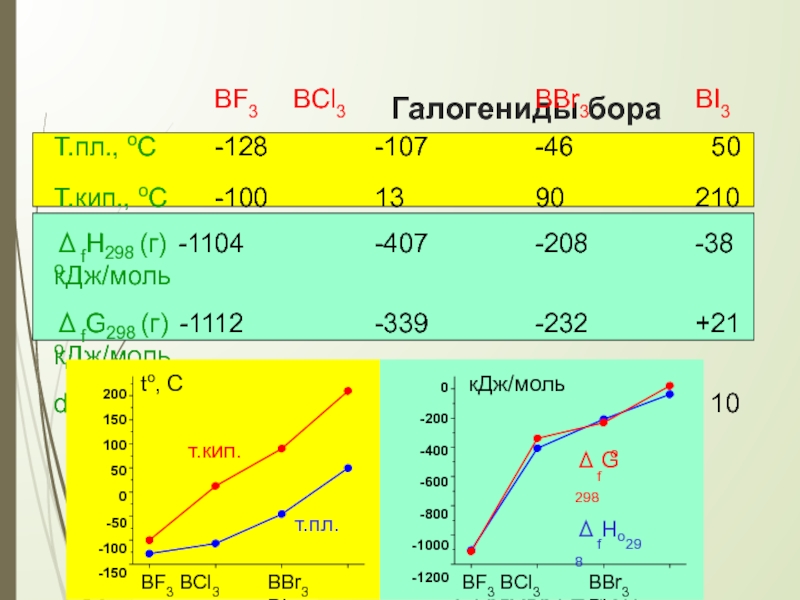
Слайд 16Галогениды бора
BF3 BCl3
BBr3
BI3
Т.пл., оС
Т.кип., оС
-128
-100
-107
13
-46
90
50
210
ΔfHo
298
(г) -1104
-407
-208
-38
кДж/моль
ΔfGo
298
(г) -1112
-339
-232
+21
кДж/моль
d
(B-X), пм 130 1
74 188 2
BX3
Плоская молекула
∠(X-B-X) = 120o
10
200
150
100
50
0
-50
-100
-150
0
-200
-400
-600
-800
-1000
-1200
BF3 BCl3
BBr3 BI3
BF3 BCl3
BBr3 BI3
кДж/моль
ΔfG 298
ΔfHo298
o
to, C
т.пл.
т.кип.
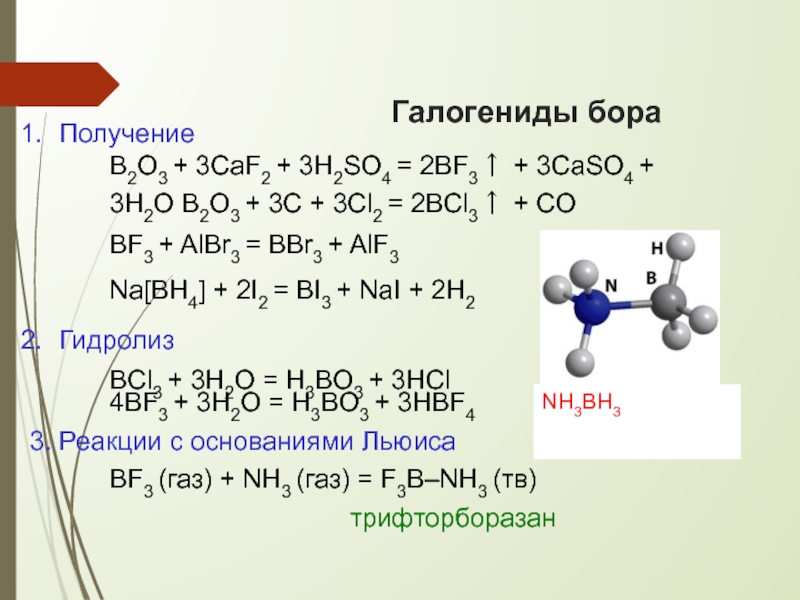
Слайд 17Галогениды бора
Получение
B2O3 + 3CaF2 + 3H2SO4 = 2BF3↑ + 3CaSO4 +
BF3 + AlBr3 = BBr3 + AlF3 Na[BH4] + 2I2 = BI3 + NaI + 2H2
Гидролиз
BCl3 + 3H2O = H3BO3 + 3HCl
4BF3 + 3H2O = H3BO3 + 3HBF4
3. Реакции с основаниями Льюиса
BF3 (газ) + NH3 (газ) = F3B–NH3 (тв)
трифторборазан
NH3BH3
Слайд 18Галогениды бора
Устойчивы, хорошо растворимы, не гидролизуются
5. Другие галогениды бора
B2F4, B2Cl4, B2Br4,
4. Тетрафтороборная кислота Существует только в растворе сильная кислота pKa = −0.2 Соли – тетрафторобораты.
HBF4
BF –
4
Слайд 19Кислородные соединения бора
1. Оксид бора B2O3
т.пл. 577 оС, т.кип. 1860 оС
ΔfG0
298
=
ангидрид борной кислоты,
легко переходит в аморфное состояние (стекло)
B2O3 + 3H2O = 2H3BO3
2. Ортоборная кислота H3BO3
твердое белое вещество растворимое в воде (∼15% при н.у.) одноосновная кислота
H3BO3 + H2O ⇔ H+ + [B(OH)4]–
pKa = 9.2
Слайд 20Кислородные соединения бора
3. Тетраборная кислота H2B4O7
Твердое белое вещество, хорошо растворимо в
двухосновная кислота
pKa1 = 4.1; pKa2 = 5.1
образуются только двузамещенные соли
H3BO3 HBO2 H2B4O7
B2O3
4. Эфиры борной кислоты
окрашивают пламя в зеленый цвет
B(OCH3)3
H3BO3 + 3CH3OH
B(OCH3)3 + H2O
t
o
t t
o
o
H2SO4
Слайд 21Кислородные соединения бора
5. Бораты
(в растворе только тетрабораты)
4H3BO3 + 2NaOH = Na2B4O7
гидролиз
Na2B4O7 + 2HCl + 5H2O = 4H3BO3↓ + 2NaCl
3Na2CO3(тв) + 2H3BO3(тв) 2Na3BO3 + 3H2O + 3CO2
Na2B4O7 + CoO
Co(BO2)2 + 2NaBO2
перлы буры
to
4NaBO2 + O2
2B2O3 + 2Na2O2
to
to
Слайд 22Борат-анионы
к.ч. = 3
sp2
d(B-O) = 136 пм
к.ч. = 4 sp3
d(B-O) = 148 пм
BO33–
Na3BO3
B2O54–
Mg2B2O5
B
3 6
NaBO
2
B(OH)4–
H3BO3
к.ч. = 3, 4
sp2, sp3
B4O5(OH)42–
Na2[B4O5(OH)4]·8H2O (Na2B4O7·10H2O)
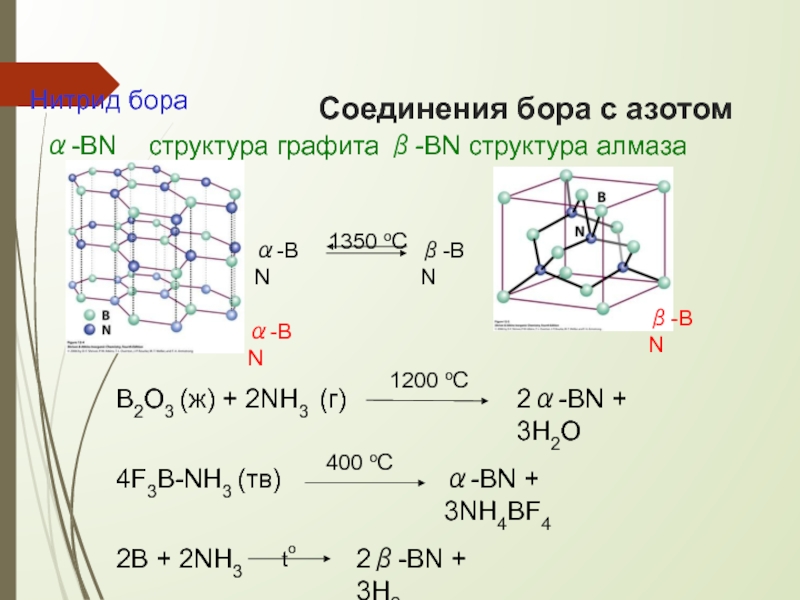
Слайд 23Соединения бора с азотом
α-BN
β-BN
α-BN
β-BN
B2O3 (ж) + 2NH3 (г)
2α-BN + 3H2O
Нитрид бора
α-BN структура
1350 oC
4F3B-NH3 (тв)
to
α-BN + 3NH4BF4
2B + 2NH3
2β-BN + 3H2
400 oC
1200 oC
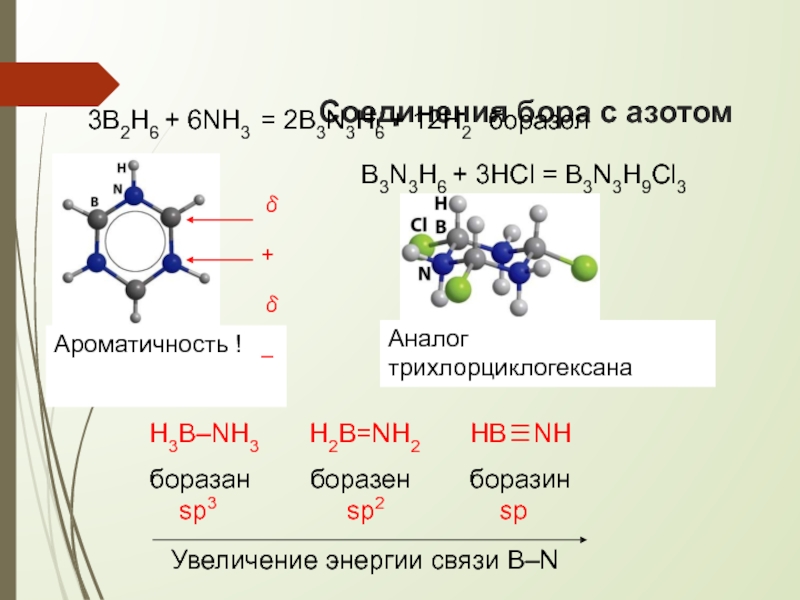
Слайд 24Соединения бора с азотом
3B2H6 + 6NH3 = 2B3N3H6 + 12H2
боразол
Ароматичность !
B3N3H6
δ+ δ–
Аналог трихлорциклогексана
Увеличение энергии связи B–N




![Исходная презентация Бор и его соединения для подготовки урока химии на повышенном уровне ТетрагидроборатыПолучениеB2H6 + 2LiH = 2Li[BH4]Na[BH4] растворим в воде, Li[BH4] – гидролизуетсяLi[BH4] ТетрагидроборатыПолучениеB2H6 + 2LiH = 2Li[BH4]Na[BH4] растворим в воде, Li[BH4] – гидролизуетсяLi[BH4] + 2H2O = 4H2 + LiBO2Восстановительные](/img/thumbs/801feb58c6e172fb776826b00391ab65-800x.jpg)




![Исходная презентация Бор и его соединения для подготовки урока химии на повышенном уровне Борат-анионык.ч. = 3sp2d(B-O) = 136 пмк.ч. = 4 sp3d(B-O) = 148 пмBO33–Na3BO3B2O54–Mg2B2O5B Борат-анионык.ч. = 3sp2d(B-O) = 136 пмк.ч. = 4 sp3d(B-O) = 148 пмBO33–Na3BO3B2O54–Mg2B2O5B O 3–3 6NaBO2B(OH)4–H3BO3к.ч. = 3, 4sp2, sp3B4O5(OH)42–Na2[B4O5(OH)4]·8H2O](/img/thumbs/7eaee88fbb0b4563bd1d0604a9ca8272-800x.jpg)