- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Интерактивное пособие по химии Соединения хрома
Содержание
- 1. Интерактивное пособие по химии Соединения хрома
- 2. шаг1шаг2шаг3шаг4шаг5шаг1шаг1шаг1шаг1шаг2шаг2шаг2шаг2шаг3шаг3шаг3шаг3шаг4шаг4шаг4шаг4шаг5шаг5шаг5шаг5+6+3
- 3. Получение оксида хрома (III) Напиши уравнение соответствующей
- 4. Получение оксида хрома (III) (NH4)2Cr2O7 −tºС→ Cr2O3 + N2↑+ 4H2OПроверь запись уравнения реакции
- 5. Изучение свойств оксида хрома (III)Запишите уравнения практически
- 6. Изучение свойств оксида хрома (III)Сr2О3 + 3H2SO4(р)−tºС→
- 7. Изучение свойств оксида хрома (III)Оксида хрома (III)
- 8. Получение гидроксида хрома (III) Напиши уравнение соответствующих
- 9. Получение гидроксида хрома (III) CrCl3 + 3NaOH→
- 10. Получение гидроксида хрома (III) Гидроксид хрома (III)
- 11. Кислотно-основные свойства гидроксида хрома (III)Напиши уравнение соответствующих
- 12. Кислотно-основные свойства гидроксида хрома (III)Cr(OH)3↓ + 3HCl
- 13. Кислотно-основные свойства гидроксида хрома (III)гидроксид хрома (III) проявляет амфотерные свойства, реагирует с кислотами и щелочами
- 14. Напиши уравнение соответствующих реакций и проверь себя
- 15. 2NaCrO2 + 3H2O2 + 2KOH → 2K2CrO4
- 16. Окисление солей хрома (III)соли хрома (III) при
- 17. Соединения хрома (VI)Смещение химического равновесия между хроматами
- 18. 2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4
- 19. Соединения хрома (VI) в зависимости от среды возможен переход хроматов в бихроматы и обратно
- 20. Соединения хрома (VI)Окислительные свойства дихроматов Напиши уравнение
- 21. Соединения хрома (VI)Окислительные свойства дихроматов Проверь запись уравнений реакций K2CrO4К3[Cr(OH)6]K2Cr2O7Cr2(SO4)3Cr(OH)3
- 22. Соединения хрома (VI)
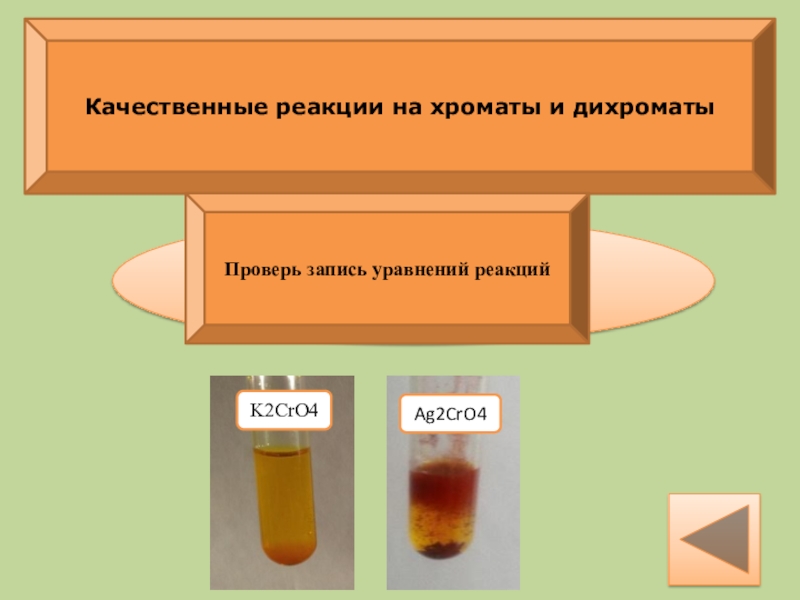
- 23. Качественные реакции на хроматы и дихроматыНапиши уравнение
- 24. Качественные реакции на хроматы и дихроматыK2CrO4 + 2AgNO3 → Ag2CrO4↓ + 2KNO3Проверь запись уравнений реакций K2CrO4Ag2CrO4
- 25. Качественные реакции на хроматы и дихроматыреакция сопровождается
- 26. В одной пробирке смешиваем 1-2 мл раствора
- 27. K2CrO4 + BaCl2 → BaCrO4↓ + 2KClK2Cr2O7
- 28. образование желтого осадка BaCrO4 указывает на присутствие
- 29. В ходе проведенной исследовательской работы был изучен
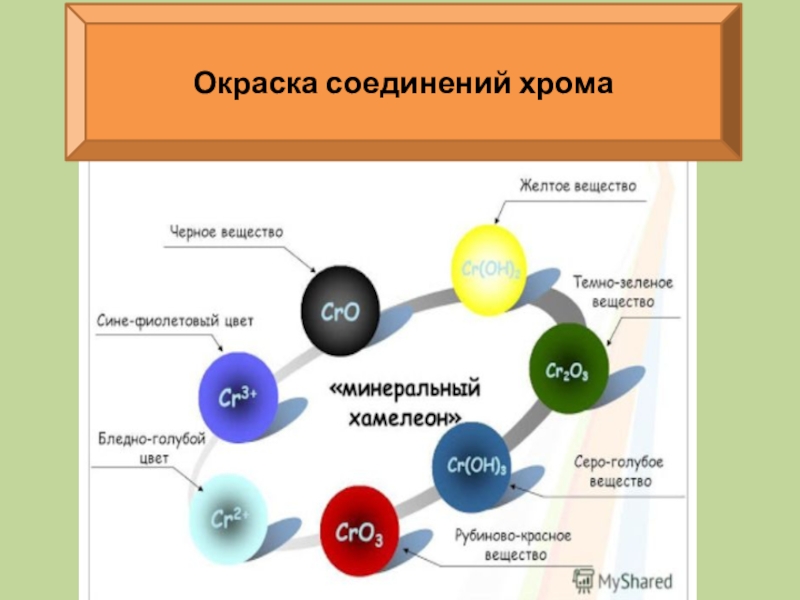
- 30. Окраска соединений хрома
Слайд 1Интерактивное пособие по теме
«Соединения хрома»
Составитель: Корнева Софья-учащаяся 11 класса
МБОУ
Руководитель: Кунгурова И А – учитель химии и биологии МБОУ «Онохойская СОШ №2»
Слайд 2шаг1
шаг2
шаг3
шаг4
шаг5
шаг1
шаг1
шаг1
шаг1
шаг2
шаг2
шаг2
шаг2
шаг3
шаг3
шаг3
шаг3
шаг4
шаг4
шаг4
шаг4
шаг5
шаг5
шаг5
шаг5
+6
+3
Слайд 3Получение оксида хрома (III)
Напиши уравнение соответствующей реакции и проверь себя
В
Слайд 4Получение оксида хрома (III)
(NH4)2Cr2O7 −tºС→ Cr2O3 + N2↑+ 4H2O
Проверь запись
Слайд 5Изучение свойств оксида хрома (III)
Запишите уравнения практически осуществимых реакций и проверь
В пять чистых пробирок помещаем по одному микро шпателю полученного оксида хрома (III), затем указанные в таблице объёмы (порции) других веществ:
Подогреваем содержимое пробирок №1-3, не доводя до кипения. Смеси в пробирках № 4 и 5 сплавляем на спиртовке. Охлаждаем продукт сплавления и растворяем его в воде.
Слайд 6Изучение свойств оксида хрома (III)
Сr2О3 + 3H2SO4(р)−tºС→ Cr2(SO4)3 + 3H2O
Cr2O3
Cr2O3 + Na2CO3 −tºС → 2NaCrO2 + CO2↑
Проверь записи уравнений реакций
Сделай вывод
Cr2(SO4)3
NaCrO2
Cr2O3+H2O
Слайд 7Изучение свойств оксида хрома (III)
Оксида хрома (III) – амфотерный оксид –
ВЫВОД
Слайд 8
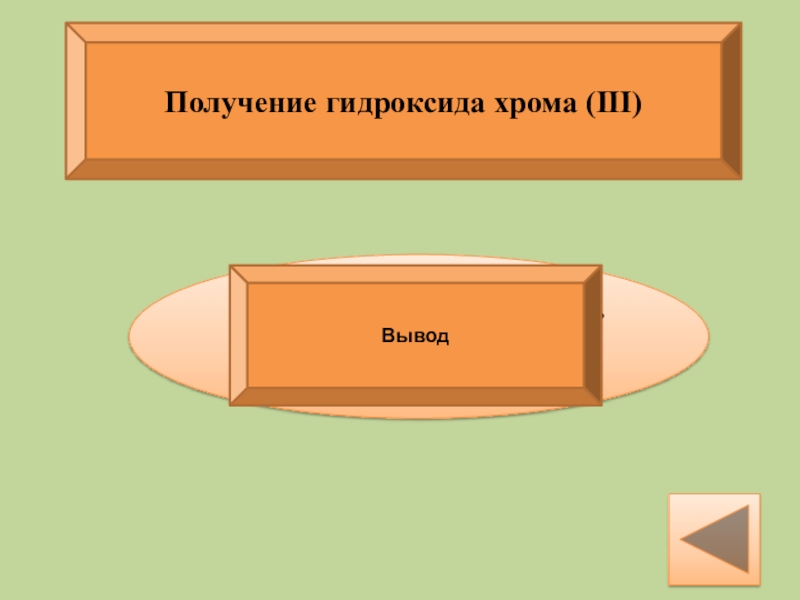
Получение гидроксида хрома (III)
Напиши уравнение соответствующих реакций и проверь себя
К 5-6 каплям раствора соли Cr3+ приливают 5-6 капель раствора NaOH. Испытывают полученный осадок на растворимость в избытке NaOH с последующим нагреванием.
Слайд 9Получение гидроксида хрома (III)
CrCl3 + 3NaOH→ Cr(OH)3↓+3NаCl
Cr(OH)3 + 3NaOH (изб)
Проверь запись уравнений реакций
Cr(OH)3
CrCl3
Na3[Cr(OH)6]
Слайд 10Получение гидроксида хрома (III)
Гидроксид хрома (III) можно получить при действии
Вывод
Слайд 11Кислотно-основные свойства гидроксида хрома (III)
Напиши уравнение соответствующих реакций и проверь себя
В две чистые пробирки наливаем по 1-2 мл раствора хлорида хрома CrCl3 и приливаем понемногу раствор щелочи до образования осадка гидроксида хрома Cr(OH)3. В одну из пробирок приливаем избыток едкого кали, в другую – раствор соляной кислоты до растворения осадка.
Слайд 12Кислотно-основные свойства гидроксида хрома (III)
Cr(OH)3↓ + 3HCl → CrCl3 + 3H2O
Cr(OH)3↓
Проверь запись уравнений реакций
Сделай вывод
Cr(OH)3
CrCl3
Na3[Cr(OH)6]
Слайд 13Кислотно-основные свойства гидроксида хрома (III)
гидроксид хрома (III) проявляет амфотерные свойства, реагирует
Слайд 14Напиши уравнение соответствующих реакций и проверь себя
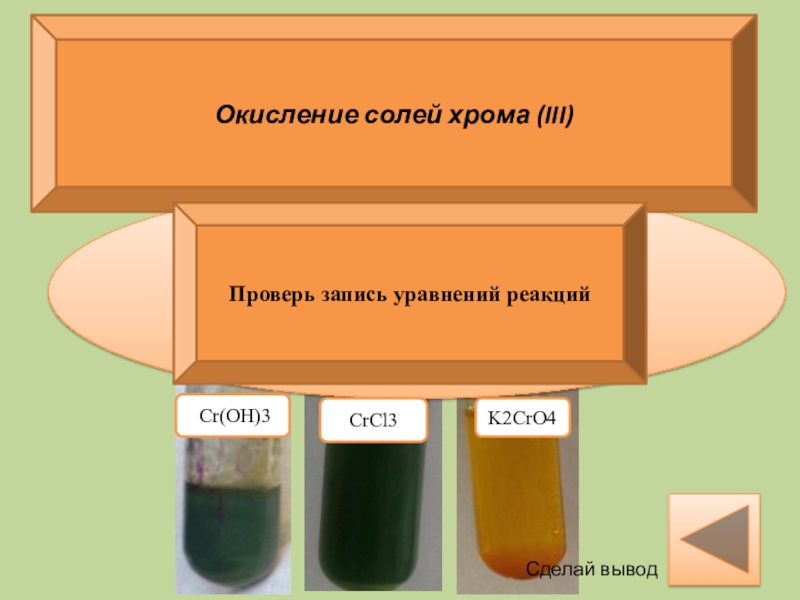
Окисление солей хрома (III)
Наливаем
Слайд 152NaCrO2 + 3H2O2 + 2KOH → 2K2CrO4 + 4H2O.
Окисление солей
Сделай вывод
CrCl3 + 3NaOH→ Cr(OH)3↓+3NаCl
Cr(OH)3 + NaOH= NaCrO2 + 2H2O
Проверь запись уравнений реакций
Cr(OH)3
CrCl3
K2CrO4
Слайд 16Окисление солей хрома (III)
соли хрома (III) при взаимодействии с пероксидом водорода
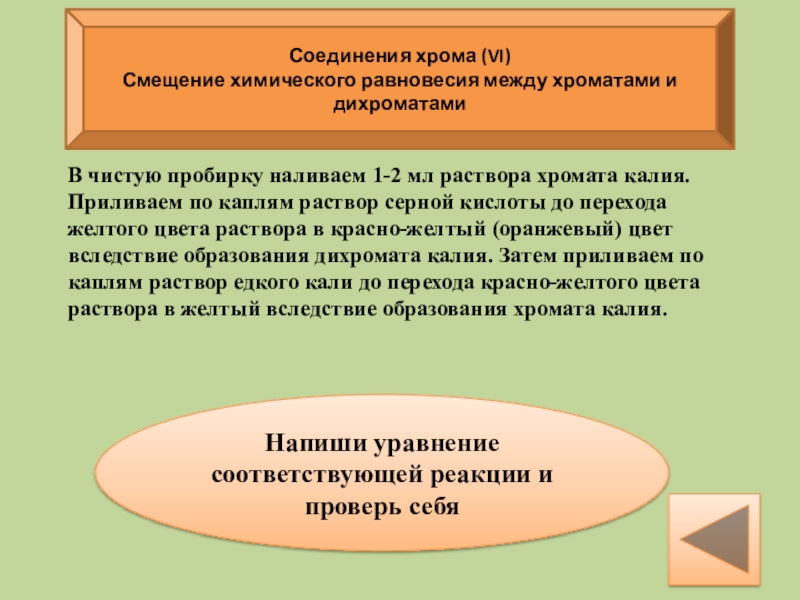
Слайд 17Соединения хрома (VI)
Смещение химического равновесия между хроматами и дихроматами
Напиши уравнение
В чистую пробирку наливаем 1-2 мл раствора хромата калия. Приливаем по каплям раствор серной кислоты до перехода желтого цвета раствора в красно-желтый (оранжевый) цвет вследствие образования дихромата калия. Затем приливаем по каплям раствор едкого кали до перехода красно-желтого цвета раствора в желтый вследствие образования хромата калия.
Слайд 182K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O
K2Cr2O7
Соединения хрома (VI)
Проверь запись уравнений реакций
Сделай вывод
K2CrO4
K2Cr2O7
Слайд 19Соединения хрома (VI)
в зависимости от среды возможен переход хроматов в
Слайд 20Соединения хрома (VI)
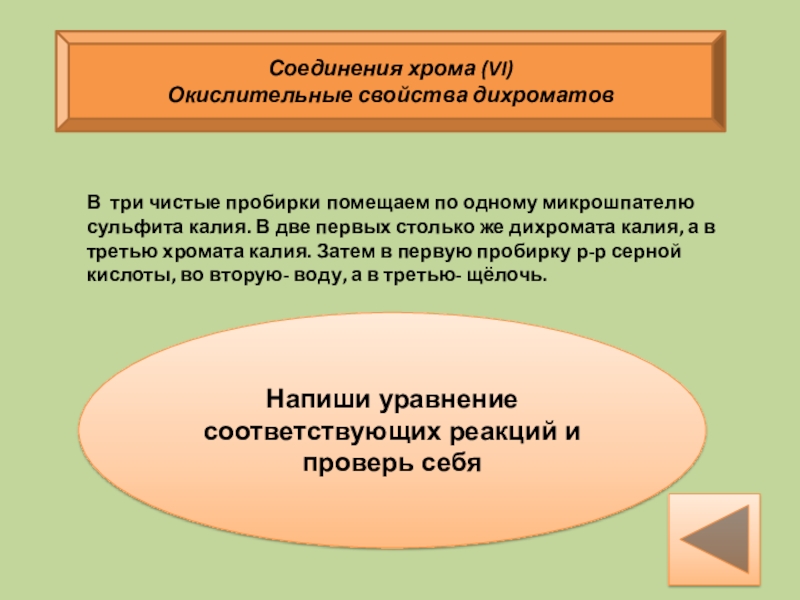
Окислительные свойства дихроматов
Напиши уравнение соответствующих реакций и проверь
В три чистые пробирки помещаем по одному микрошпателю сульфита калия. В две первых столько же дихромата калия, а в третью хромата калия. Затем в первую пробирку р-р серной кислоты, во вторую- воду, а в третью- щёлочь.
Слайд 21Соединения хрома (VI)
Окислительные свойства дихроматов
Проверь запись уравнений реакций
K2CrO4
К3[Cr(OH)6]
K2Cr2O7
Cr2(SO4)3
Cr(OH)3
Слайд 23Качественные реакции на хроматы и дихроматы
Напиши уравнение соответствующих реакций и проверь
Наливаем в одну пробирку раствор хромата калия и добавляем по 2-3 капли раствора нитрата серебра.
Слайд 24Качественные реакции на хроматы и дихроматы
K2CrO4 + 2AgNO3 → Ag2CrO4↓ +
Проверь запись уравнений реакций
K2CrO4
Ag2CrO4
Слайд 25Качественные реакции на хроматы и дихроматы
реакция сопровождается образованием красно-бурого осадка, что
Слайд 26В одной пробирке смешиваем 1-2 мл раствора хромата калия и хлорид
Качественные реакции на хроматы и дихроматы
Напиши уравнение соответствующих реакций и проверь себя
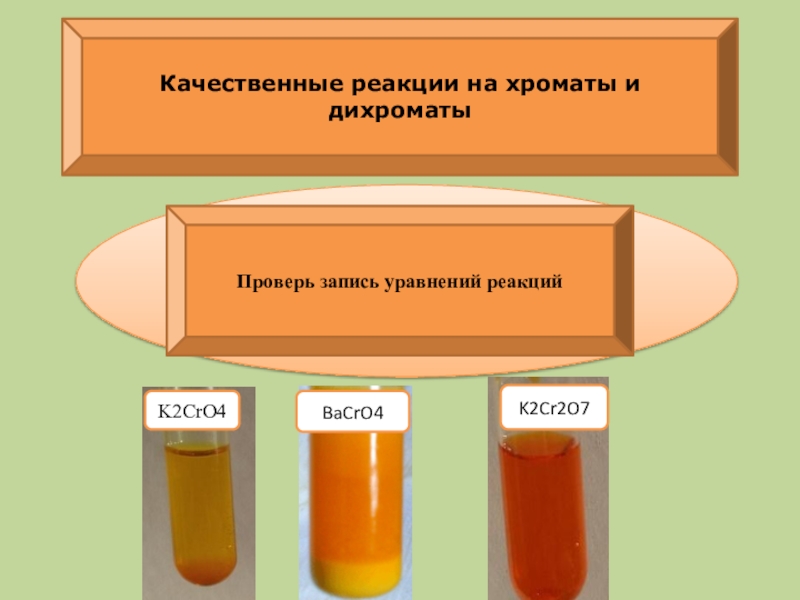
Слайд 27K2CrO4 + BaCl2 → BaCrO4↓ + 2KCl
K2Cr2O7 + 2BaCl2 + H2O
Проверь запись уравнений реакций
Качественные реакции на хроматы и дихроматы
K2CrO4
K2Cr2O7
BaCrO4
Слайд 28образование желтого осадка BaCrO4 указывает на присутствие в растворе ионов CrO42-:
Качественные реакции на хроматы и дихроматы
Слайд 29В ходе проведенной исследовательской работы был изучен и обобщен материал по
1. С увеличением степени окисления металла основные свойства оксидов и гидроксидов ослабевают, а кислотные усиливаются.
2. Окислительные свойства последовательно усиливаются с изменением степени окисления в ряду: Сr+2 → Сr+3 → Сr+6.
3. Соединения хрома весьма разнообразны по окраске.
4. Проведены необходимые реакции с участием соединений хрома (III) и соединений хрома (VI) на практике, проанализированы результаты опытов и сделаны выводы;
5. Разработано и апробировано на уроках химии и элективных занятиях интерактивное пособие «Соединения хрома»







![Интерактивное пособие по химии Соединения хрома Получение гидроксида хрома (III) CrCl3 + 3NaOH→ Cr(OH)3↓+3NаCl Cr(OH)3 + 3NaOH (изб) Получение гидроксида хрома (III) CrCl3 + 3NaOH→ Cr(OH)3↓+3NаCl Cr(OH)3 + 3NaOH (изб) −tºС → Na3[Cr(OH)6]](/img/thumbs/1cc0e9db65ceb480128e6c0304def308-800x.jpg)

![Интерактивное пособие по химии Соединения хрома Кислотно-основные свойства гидроксида хрома (III)Cr(OH)3↓ + 3HCl → CrCl3 + 3H2OCr(OH)3↓ Кислотно-основные свойства гидроксида хрома (III)Cr(OH)3↓ + 3HCl → CrCl3 + 3H2OCr(OH)3↓ + 3NaOH → Na3[Cr(OH)6]Проверь запись уравнений](/img/thumbs/256e16e64336d059614101960e85c2fb-800x.jpg)


![Интерактивное пособие по химии Соединения хрома Соединения хрома (VI)Окислительные свойства дихроматов Проверь запись уравнений реакций K2CrO4К3[Cr(OH)6]K2Cr2O7Cr2(SO4)3Cr(OH)3 Соединения хрома (VI)Окислительные свойства дихроматов Проверь запись уравнений реакций K2CrO4К3[Cr(OH)6]K2Cr2O7Cr2(SO4)3Cr(OH)3](/img/thumbs/a4a2532cf33c9417ff577b323c41fb88-800x.jpg)