- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Химия пәнінен презентация Фосфор тақырыбы (9 сынып)
Содержание
- 1. Химия пәнінен презентация Фосфор тақырыбы (9 сынып)
- 2. ФОСФОР –ЖАРЫҚ ШЫҒАРҒЫШ ЭЛЕМЕНТ
- 3. Сабақтың мақсаты: Білімділік: Оқушыларға фосфордың периодты жүйедегі
- 4. Фосфордың ашылу тарихыҚазақстандағы фосфор
- 5. Фосфор аталу тарихыМен жарық беруші элементСірінкені жағамын мен оп-оңайАстында судың мені жақса егер,Қышқылға айналады оксидім меніңV
- 6. Слайд 6
- 7. Периодтық жүйедегі орны?
- 8. 3 периодV топНегізгі топтопшасы (А) Р +15 )2)8)5+3, +5, -3
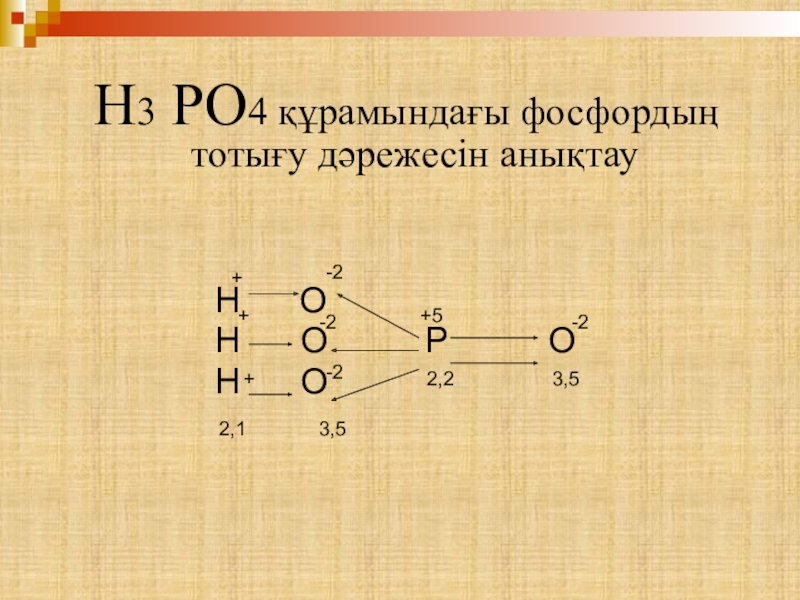
- 9. H3 PO4 құрамындағы фосфордың тотығу дәрежесін
- 10. РАҒЗАДАМИНЕРАЛДАРФОСФОЛИПИДТЕР,ФЕРМЕНТТЕР, КАЛЬЦИЙФОСФАТы ЭФИРЛЕР ОРТОФОСФОР ҚЫШҚЫЛЫТІС пен СҮЙЕКТЕАПАТИТФОСФОРИТБИРЮЗАТабиғатта таралуы
- 11. Слайд 11
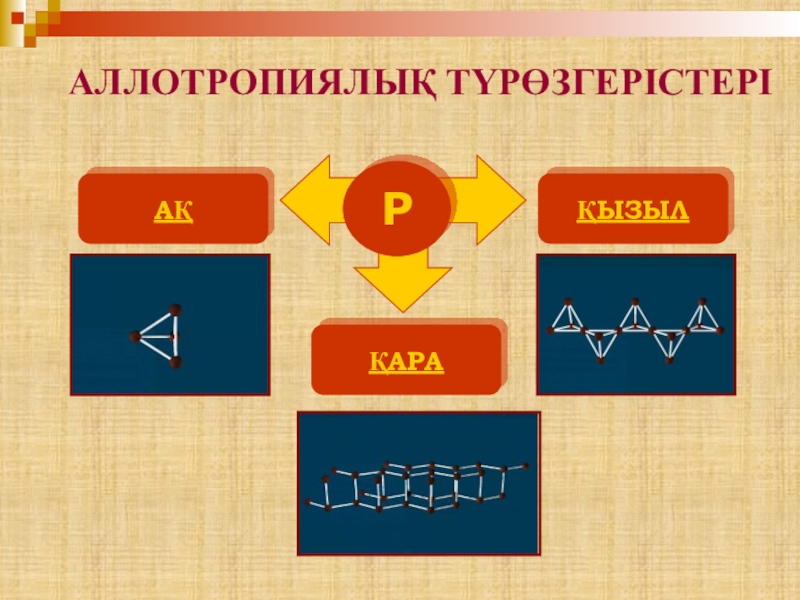
- 12. АЛЛОТРОПИЯЛЫҚ ТҮРӨЗГЕРІСТЕРІРАҚҚЫЗЫЛҚАРА
- 13. Фосфор түрөзгерісі:Р (ақ) Р (қызыл) Р (қара)
- 14. P4 молекуласы тетраэдр пішінді. Оңай балқиды t(б)=44,1оС,
- 15. Қызыл фосфордың бірнеше түрі белгілі.
- 16. Қара фосфордың кристалдық торы атомдық.
- 17. Металдармен: 3 Ca+ 2P =
- 18. Зертханалық тәжірибе:: Фосфордың жануы
- 19. Фосфордың азот қышқылымен әрекеттесуі:P(қ.) + 5HNO3 (конц.)
- 20. Сірінке басын қорап сыртына үйкелеу кезінде
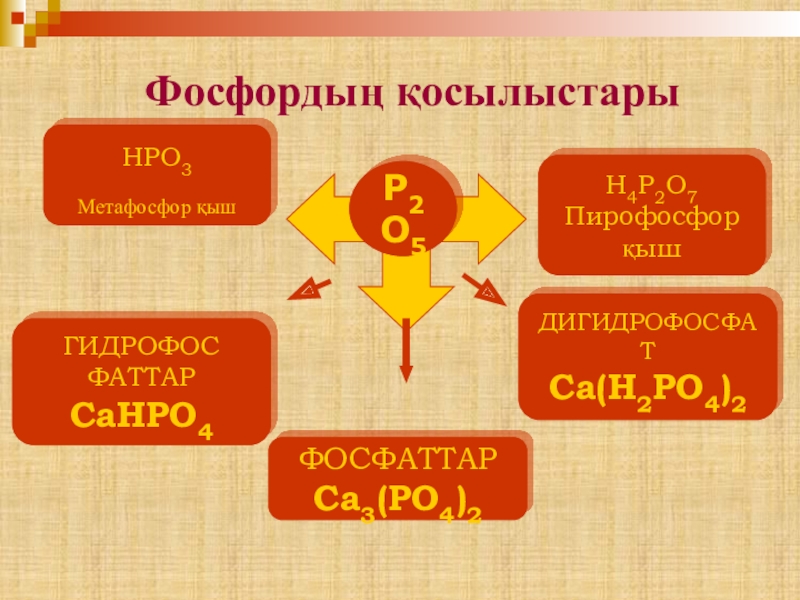
- 21. Фосфордың қосылыстарыР2O5HPO3Метафосфор қыш H4P2O7 Пирофосфор қышФОСФАТТАРCa3(PO4)2ГИДРОФОСФАТТАРCaНPO4ДИГИДРОФОСФАТCa(Н2PO4)2
- 22. Фосфор оксидінің сумен әрекеттесуі:Р2 О5 + 3H2O = 2 H3PO4
- 23. Фосфорды алу:Ca3 (PO4)2 + 5C + 3SiO2 = 3CaSiO3 + 2P + 5CO↑
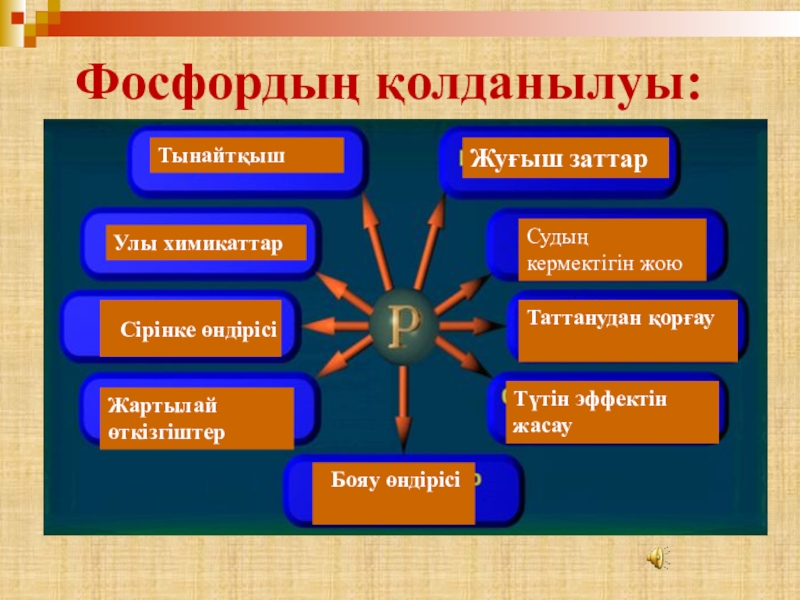
- 24. ТынайтқышУлы химикаттарСірінке өндірісіЖартылай өткізгіштерЖуғыш заттарСудың кермектігін жоюТаттанудан қорғауТүтін эффектін жасау Бояу өндірісі Фосфордың қолданылуы:
- 25. ЕСЕП: Ғалымдар есептеулері бойынша адам денесінің
- 26. Тест фосфор1.Хеккинг Бранд қай жылы фосфорды ашты?А)1667
- 27. 5.Фосфордың электронды конфигурациясыA) 1s22s22p63s23p1B) 1s22s22p63s23p2C). 1s22s22p63s23p3D) 1s22s22p63s23p46.Фосфордың
- 28. 8.Фосфордың болуы мүмкін тотығу дәрежелері?A) – 2,
- 29. Бағалау1- “5”2-3- “4”4-5- “3”
- 30. Слайд 30
- 31. Үйге тапсырма§18,19 № 6,7
- 32. Назарларыңызға рахмет!
Слайд 3Сабақтың мақсаты:
Білімділік: Оқушыларға фосфордың периодты жүйедегі орнына сипаттама берумен қатар
Дамытушылық: Оқушылардың химиялық білімін одан әрі дамыту, тез ойлауға, шапшаңдыққа , өз бетімен ізденуге үйрету. Ой-өрісін, шығармашылық мүмкіндігін, ғылымы көзқарасын қалыптастыру.
Тәрбиелік:Өздігінен талпынып, жауапкершілікті сезінетін саналы, өнегелі ұрпақ тәрбиелеу.
Слайд 4
Фосфордың ашылу тарихы
Қазақстандағы фосфор өндіру саласы
Фосфордың
Табиғата таралуы
Аллотропиялық түрөзгерістері
Физикалық және химиялық қасиеттері
Фосфорды алу әдістері
Фосфордың қолданылуы
Сабақтың барысы:
Слайд 5Фосфор аталу тарихы
Мен жарық беруші элемент
Сірінкені жағамын мен оп-оңай
Астында судың мені
Қышқылға айналады оксидім менің
V
Слайд 9 H3 PO4 құрамындағы фосфордың тотығу дәрежесін анықтау
Н О Р О
Н О
-2
3,5
2,2
+5
+
+
+
2,1
-2
-2
-2
3,5
Слайд 10Р
АҒЗАДА
МИНЕРАЛДАР
ФОСФОЛИПИДТЕР,
ФЕРМЕНТТЕР,
КАЛЬЦИЙ
ФОСФАТы
ЭФИРЛЕР
ОРТОФОСФОР
ҚЫШҚЫЛЫ
ТІС пен СҮЙЕКТЕ
АПАТИТ
ФОСФОРИТ
БИРЮЗА
Табиғатта таралуы
Слайд 14P4 молекуласы тетраэдр пішінді. Оңай балқиды t(б)=44,1оС, t(қайн)=275оС, жұмсақ, түссіз аморфты
АҚ ФОСФОР
Ақ фосфор тұрақсыз түрі.
Слайд 15 Қызыл фосфордың бірнеше түрі белгілі. Олардың құрылымы дұрыс дәлелденбеген.
585-600оС, түсі қара қоңырдан қызыл болады. Улы емес.
ҚЫЗЫЛ ФОСФОР
Слайд 16 Қара фосфордың кристалдық торы атомдық. Графитке ұқсас, жартылай өткізгіш
Қара фосфор
Қара фосфор өте сирек кездеседі.
Слайд 17 Металдармен:
3 Ca+ 2P =
Бейметалдармен:
4 P + 5O2
2P + 3S = P2 S3
=2P+52O-25
Ca+23P-32
ХИМИЯЛЫҚ ҚАСИЕТТЕРІ:
Слайд 19Фосфордың азот қышқылымен әрекеттесуі:
P(қ.) + 5HNO3 (конц.) = 2H3PO4 + 5NO2
Фосформен жұмыс істегенде қауіпсіздік ережелерін қатаң сақтау керек. Ф осфор улы
Слайд 20 Сірінке басын қорап сыртына үйкелеу
кезінде сірінке тұтанады:
Қалыпты жағдайда
6P + 5KCLO3 = 5KCL + 3P2O5
Слайд 21 Фосфордың қосылыстары
Р2O5
HPO3
Метафосфор қыш
H4P2O7
Пирофосфор
қыш
ФОСФАТТАР
Ca3(PO4)2
ГИДРОФОС
ФАТТАР
CaНPO4
ДИГИДРОФОСФАТ
Ca(Н2PO4)2
Слайд 24Тынайтқыш
Улы химикаттар
Сірінке өндірісі
Жартылай өткізгіштер
Жуғыш заттар
Судың кермектігін жою
Таттанудан қорғау
Түтін эффектін жасау
Бояу
Фосфордың қолданылуы:
Слайд 25ЕСЕП: Ғалымдар есептеулері бойынша адам денесінің салмағының 1 пайызы фосфор болады
Слайд 26Тест фосфор
1.Хеккинг Бранд қай жылы фосфорды ашты?
А)1667 жылы
В)1668 жылы
С)1669 жылы
д)1670
2.Игон Куккель
а)1979
В)1780
С)1681
д)1682
3.Қай жылы Маркугод фосфордың құпиясын жариялады?
А)1743
В)1744
С)1745
д)1746
4.Қай ғасырда араб алхимиктері фосфорды жасады?
А)ІХ-ғасыр
В)Х-ғасыр
С)ХІ-ғасыр
д)ХІІ-ғасыр
Слайд 275.Фосфордың электронды конфигурациясы
A) 1s22s22p63s23p1
B) 1s22s22p63s23p2
C). 1s22s22p63s23p3
D) 1s22s22p63s23p4
6.Фосфордың табиғаттағы қоры ...түрінде болады
A)
B) .3Ca3(PO4)2 * CaF2
C) Ba3(PO4)2
D) H3PO4
7.Фосформен әрекеттесетін заттар
A) KCl, H2, BaO
B) NaCl, Al, Li2O
C) .O2, S, Ca, Cl2
D) MgO, N2O5, Cl2O7
Слайд 288.Фосфордың болуы мүмкін тотығу дәрежелері?
A) – 2, + 4
B). – 3,
C) – 1, + 7
D) + 2, + 4
9.Фосфиннің формуласы:
A) .PH3
B) NH3
C) AsH3
D) PCl3
10.Натрий дигидрофосфаты формуласы:
A) Na3PO4
B) Na2HPO4
C) .NaH2PO4
D) NaHCO3
11.Фосфор (V) оксидімен әрекеттесетін заттар қатары:
A) .NaOH, H2O, BaO
B) CO2, Cl2O7, Al(OH)3
C) SO3, N2O5, HCl
D) Ag, Cu(OH)2, H3BO3
12Фосфорды қай жерлерде алады?
А.Өскемен; В.Семей; С.Көкшетау; Д.Қаратау
13.Суперфосфат өндіру заводы қайда орналасқан?
А.Таразда; В.Тлдықорғанда; С.Алматы; С.Қостанай
14. Фосфордың ірі кен орындары:
А.Құмкөл-Теңіз; В.Ембі-Мақат; С.Қаратау-Шолақтау; Д.Лепсі-Қаратал.
15. Қазақстандағы ірі фосфор заводтары:
А.Тараз, Алға; В .Шымкент, Қызылорда; С. Талдықорған, Шымкент; Д.Семей, Атырау