Д.И. Менделеева в свете электронной теории
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Химия 10 класс. Профильный уровень. Периодический закон Д.И. Менделеева и Периодическая система химических элементов в свете строения атома
Содержание
- 1. Химия 10 класс. Профильный уровень. Периодический закон Д.И. Менделеева и Периодическая система химических элементов в свете строения атома
- 2. I. Предпосылки открытия периодического закона. Как все
- 3. Триады Деберейнера (1816 г.)Немецкий химик И.В. Деберейнер
- 4. Спираль Шанкуртуа (1862 г.)Профессор парижской высшей
- 5. Классификация Мейера (1864 г.) Немецкий исследователь Л.
- 6. Раздумья днем и ночью…До Д.И. Менделеева было
- 7. 17 февраля 1869 годаСтатья Менделеева "Опыт системы
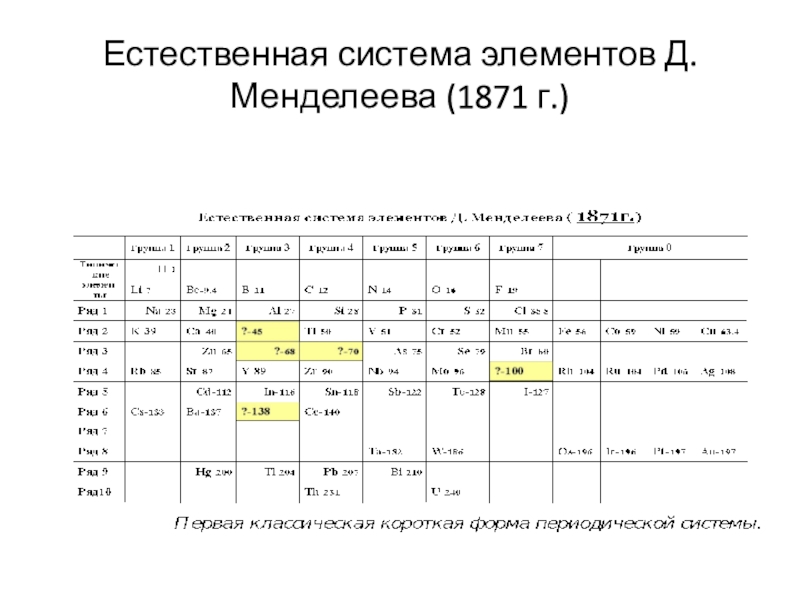
- 8. Естественная система элементов Д.Менделеева (1871 г.)
- 9. Слайд 9
- 10. II. Открытие Д.И.Менделеевым Периодического закона. Д.И.Менделеев: «Надо
- 11. III. Периодический закон и строение атома.
- 12. IV. Периодическая система химических элементов Д.И.Менделеева. Периодическая
- 13. Закон Мозли - эмпирически установлена зависимость частоты
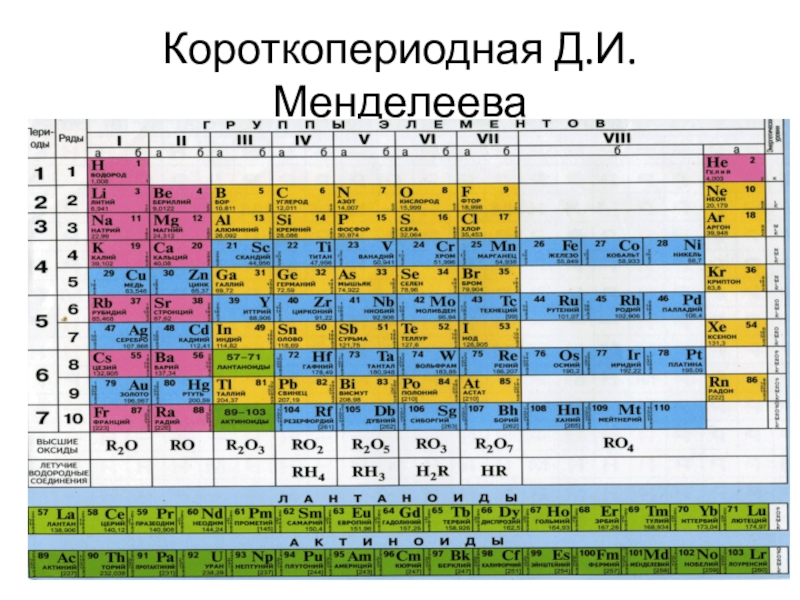
- 14. Короткопериодная Д.И. Менделеева
- 15. Длиннопериодная Г. Сиборг
- 16. Слайд 16
- 17. V. Периодичность.Горизонтальная периодичность: в пределах одного и
- 18. Слайд 18
- 19. Слайд 19
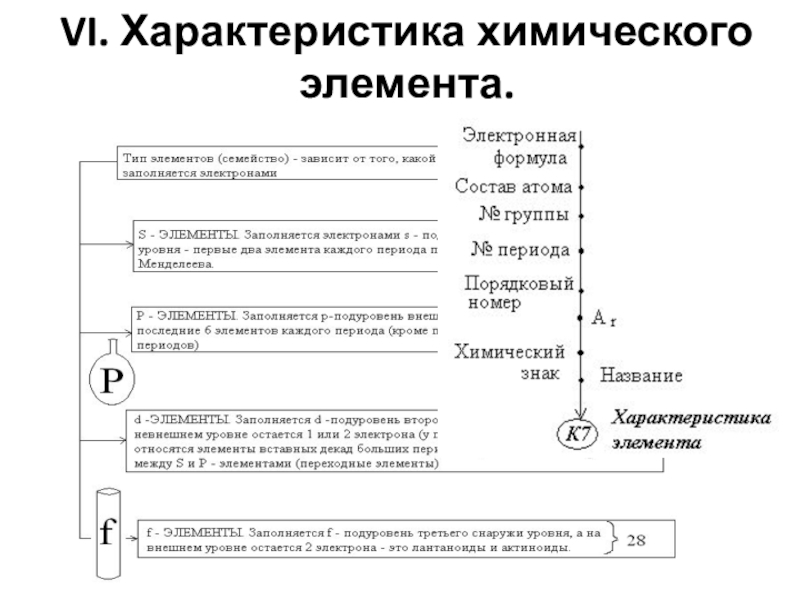
- 20. VI. Характеристика химического элемента.
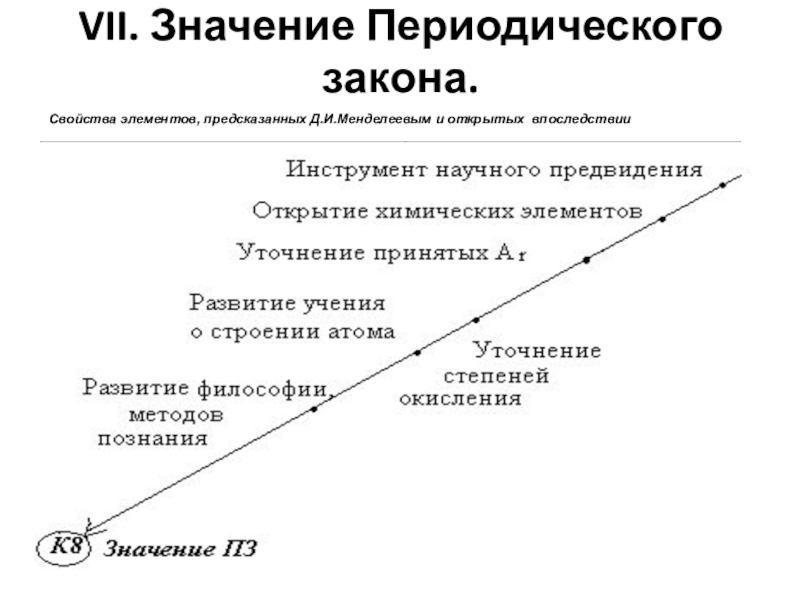
- 21. VII. Значение Периодического закона.Свойства элементов, предсказанных Д.И.Менделеевым и открытых впоследствии
- 22. Слайд 22
I. Предпосылки открытия периодического закона. Как все начиналось… Выдающийся шведский химик Берцелиус разделил все элементы на металлы и неметаллы на основе различий в свойствах, образованных ими простых веществ и соединений. Он определил, что металлам соответствуют основные
Слайд 2I. Предпосылки открытия периодического закона.
Как все начиналось…
Выдающийся шведский химик Берцелиус
разделил все элементы на металлы и неметаллы на основе различий в свойствах, образованных ими простых веществ и соединений. Он определил, что металлам соответствуют основные оксиды и основания, а неметаллам – кислотные оксиды и кислоты.
Слайд 3Триады Деберейнера (1816 г.)
Немецкий химик И.В. Деберейнер разделил элементы по три
на основе сходства в свойствах образуемых веществ и так, чтобы величина, которую мы сейчас понимаем как относительную атомную массу среднего элемента, была равна среднему арифметическому двух крайних. Пример триад:
Li Ca Cl S Mn
Na Sr Br Se Sr
K Ba I Te Fe
Li Ca Cl S Mn
Na Sr Br Se Sr
K Ba I Te Fe
Слайд 4Спираль Шанкуртуа (1862 г.)
Профессор парижской высшей
Li F
школы Шанкуртуа предложил
располагать элементы по спирали Na Cl
образующей цилиндр в
порядке возрастания их атомных K Br
масс и указал, что в этом случае
можно заметить сходство свойств Rb I
образуемых элементами веществ,
если они попадают на одну и ту же
вертикальную линию цилиндра,
располагаясь один под другим, например:
школы Шанкуртуа предложил
располагать элементы по спирали Na Cl
образующей цилиндр в
порядке возрастания их атомных K Br
масс и указал, что в этом случае
можно заметить сходство свойств Rb I
образуемых элементами веществ,
если они попадают на одну и ту же
вертикальную линию цилиндра,
располагаясь один под другим, например:
Слайд 5Классификация Мейера (1864 г.)
Немецкий исследователь Л. Мейер расположил химические элементы
также в порядке увеличения их атомных масс.
Слайд 6Раздумья днем и ночью…
До Д.И. Менделеева было предпринято более 50 попыток
классифицировать химические элементы. Большинство учёных пытались выявить связь между химическими свойствами и их соединений и атомной массой.
Слайд 717 февраля 1869 года
Статья Менделеева "Опыт системы элементов, основанной на их
атомном весе и химическом сходстве" датирована "17 февраля 1869 года" (это по старому стилю).
Так был открыт Периодический закон, современная формулировка которого такова:
«Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядер их атомов».
Так был открыт Периодический закон, современная формулировка которого такова:
«Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядер их атомов».
Слайд 10II. Открытие Д.И.Менделеевым Периодического закона.
Д.И.Менделеев: «Надо искать функционального соответствия между индивидуальными
свойствами элементов и их атомными массами.… Искать же чего-либо – хотя бы грибов или какую-либо зависимость – нельзя иначе, как смотря и пробуя. Вот и я стал подбирать, написав на отдельных карточках элементы с их атомными массами и коренными свойствами, сходные элементы и близкие атомные массы…»
Что же он обнаружил?
Что же он обнаружил?
Слайд 11III. Периодический закон и строение атома.
Д.И. Менделеев, оценивая свое
открытие, писал: «Сомневаясь во многих неясностях, я ни на минуту не сомневался в общности сделанного вывода…».
Неясности действительно были. Прежде всего некоторые элементы размещались не по порядку возрастания атомных масс: Ar-K, Te-I, Co-Ni. Объяснить это не мог и Менделеев. Это была научная проблема. Как ее решать?
Ответ подсказал сам Менделеев, когда в своих поздних трудах писал о «сложной природе атома», которую еще предстоит изучить.
Неясности действительно были. Прежде всего некоторые элементы размещались не по порядку возрастания атомных масс: Ar-K, Te-I, Co-Ni. Объяснить это не мог и Менделеев. Это была научная проблема. Как ее решать?
Ответ подсказал сам Менделеев, когда в своих поздних трудах писал о «сложной природе атома», которую еще предстоит изучить.
Слайд 12IV. Периодическая система химических элементов Д.И.Менделеева.
Периодическая система - это графическое отображение
Периодического закона.
История химии знает не одну сотню попыток графического отображения периодической системы элементов. Ни одна из этих попыток никоем образом не изменяет идеи Д.И.Менделеева.
История химии знает не одну сотню попыток графического отображения периодической системы элементов. Ни одна из этих попыток никоем образом не изменяет идеи Д.И.Менделеева.
Слайд 13Закон Мозли - эмпирически установлена зависимость частоты и длины волны серий
характеристического рентгеновского излучения от атомного номера химического элемента.
Историческое значение
Закон Мозли сыграл очень важную роль в идентификации химических элементов и определение их места в периодической таблице. Составляя периодическую таблицу, Дмитрий Менделеев опирался на известные значения атомных масс элементов. Однако ему пришлось переставить некоторые элементы местами и допустить существование других, еще неизвестных. В отличие от атомной массы, закон Мозли не имеет исключений - спектральные линии характеристического рентгеновского излучения расположены в строгой закономерности. Анализ их частот позволил точно установить места в периодической таблице переходных элементов, которые имеют схожие химические свойства и не сильно различаются по массе. Анализ спектров помог также убедиться в том, что в периодической таблице нет лакун - от Водорода в Урана ровно 92 химических элемента.
Историческое значение
Закон Мозли сыграл очень важную роль в идентификации химических элементов и определение их места в периодической таблице. Составляя периодическую таблицу, Дмитрий Менделеев опирался на известные значения атомных масс элементов. Однако ему пришлось переставить некоторые элементы местами и допустить существование других, еще неизвестных. В отличие от атомной массы, закон Мозли не имеет исключений - спектральные линии характеристического рентгеновского излучения расположены в строгой закономерности. Анализ их частот позволил точно установить места в периодической таблице переходных элементов, которые имеют схожие химические свойства и не сильно различаются по массе. Анализ спектров помог также убедиться в том, что в периодической таблице нет лакун - от Водорода в Урана ровно 92 химических элемента.
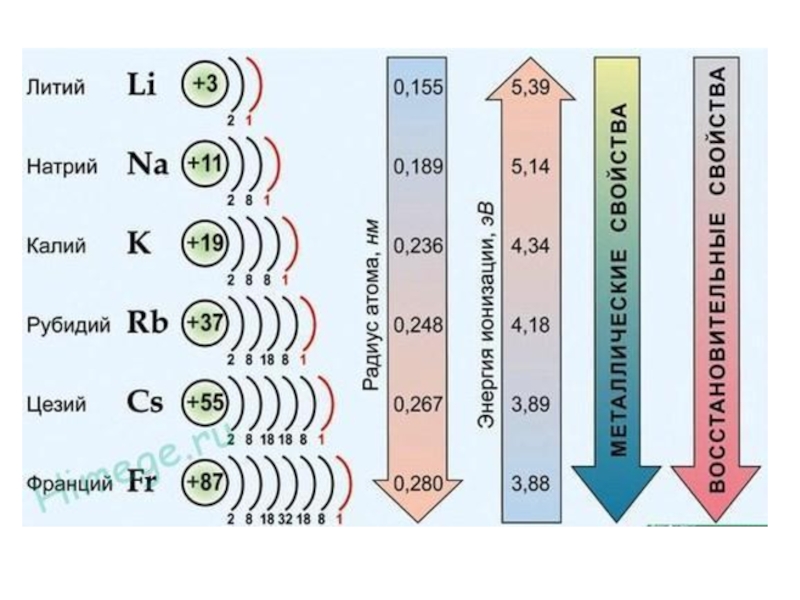
Слайд 17V. Периодичность.
Горизонтальная периодичность: в пределах одного и того же периода металлические
свойства уменьшаются, а неметаллические свойства – увеличиваются, так как:
а) увеличиваются заряды атомных ядер;
б) число энергетических уровней постоянно;
г) радиус атома уменьшается.
Вертикальная периодичность: в пределах одной и той же группы (в главной подгруппе) металлические свойства увеличиваются, неметаллические свойства уменьшаются, так как:
а) увеличиваются заряды атомных ядер;
б) число электронов на внешнем уровне постоянно;
в) увеличивается число энергетических уровней;
г) увеличивается радиус атома.
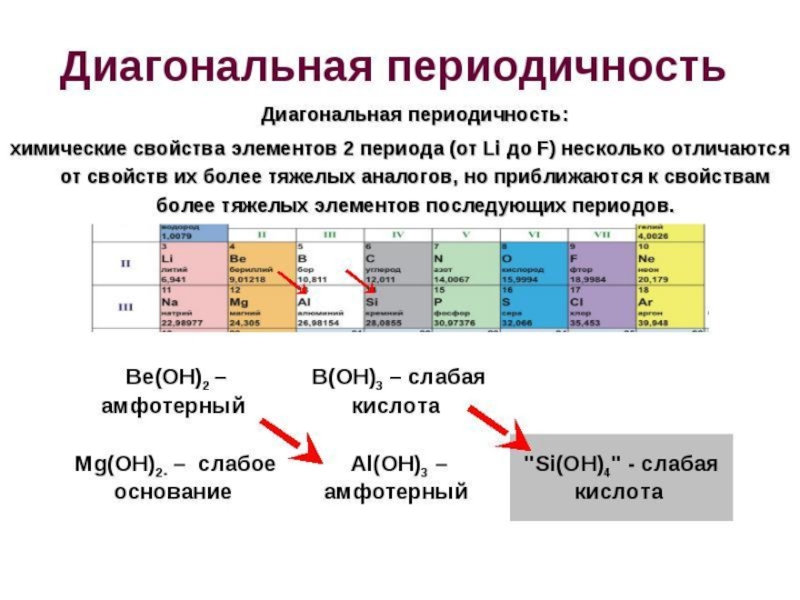
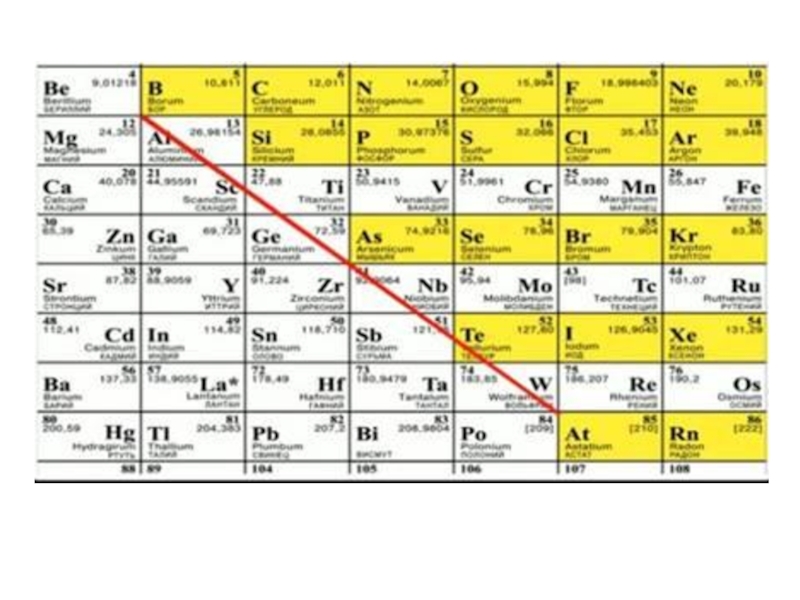
Диагональная периодичность - повторяемость сходства химических свойств простых веществ и соединений элементов, расположенных по диагонали друг от друга в Периодической системе.
«Звездная периодичность»
а) увеличиваются заряды атомных ядер;
б) число энергетических уровней постоянно;
г) радиус атома уменьшается.
Вертикальная периодичность: в пределах одной и той же группы (в главной подгруппе) металлические свойства увеличиваются, неметаллические свойства уменьшаются, так как:
а) увеличиваются заряды атомных ядер;
б) число электронов на внешнем уровне постоянно;
в) увеличивается число энергетических уровней;
г) увеличивается радиус атома.
Диагональная периодичность - повторяемость сходства химических свойств простых веществ и соединений элементов, расположенных по диагонали друг от друга в Периодической системе.
«Звездная периодичность»