- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Химические и физические свойства водорода. часть 2
Содержание
- 1. Химические и физические свойства водорода. часть 2
- 2. Водород плохо растворим в воде и органически
- 3. При обычных условиях молекулярный водород проявляет сравнительно
- 4. Восстановительные свойства:при обычных условиях водород вступает в
- 5. Реакции взаимодействия с простыми веществами – неметаллами:2H2 +
- 6. 2. Водород реагирует с оксидами малоактивных металлов, причем
- 7. CH2 = CH2 + H2 ↔ CH3-CH3;C6H6 + 3H2 ↔ C6H12;C3H6 + H2 ↔
- 8. 2Na +H2 ↔ 2NaH (t, p).Ca + H2 ↔
- 9. Хотя все атомы одного элемента имеют одинаковое
- 10. Природный водород состоит из двух стабильных изотопов
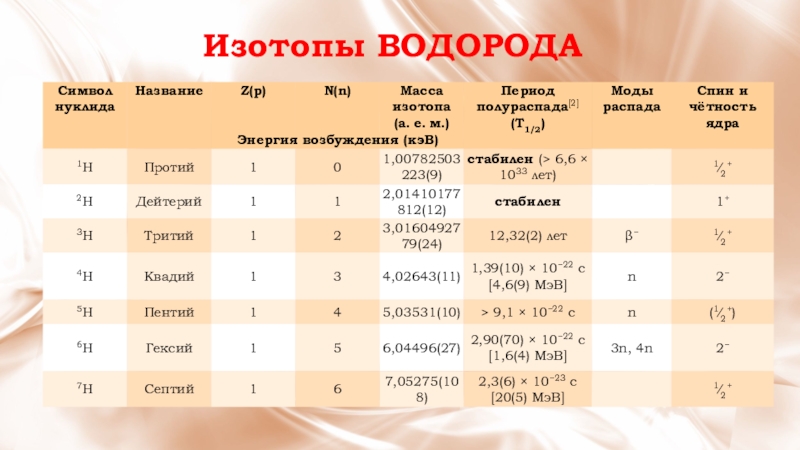
- 11. Изотопы ВОДОРОДА
Слайд 2Водород плохо растворим в воде и органически растворителях, хорошо растворим в
По данным современной космохимии водород является самым распространенным элементом Вселенной.
Основная форма существования водорода в космическом пространстве – отдельные атомы.
По распространенности на Земле водород занимает 9 место среди всех элементов.
Основное количество водорода на Земле находится в связанном состоянии – в составе воды, нефти, природного газа, каменного угля и т.д.
В виде простого вещества водород встречается редко – в составе вулканических газов.
Физические свойства водорода
Слайд 3При обычных условиях молекулярный водород проявляет сравнительно низкую реакционную способность, что
Химические свойства водорода
Рассмотрим строение молекулы водорода H.
Каждый атом водорода на внешнем энергетическом уровне несет 1 неспаренный электрон. Для отображения атома используем структуру Льюиса – это схема строения внешнего энергетического уровня атома, когда электроны обозначаются точками. Модели точечных структур Люьиса неплохо помогают при работе с элементами второго периода.
H + H = H:H
В молекуле водорода одна общая электронная пара и одна химическая связь H–H.
Эта электронная пара не смещается ни к одному из атомов водорода, т.к. электроотрицательность у атомов водорода одинаковая. Такая связь называется ковалентной неполярной.
При нагревании вступает во взаимодействие практически со всеми простыми веществами, образованными элементами главных подгрупп (кроме благородных газов, B, Si, P, Al).
В химических реакциях может выступать как
в роли восстановителя (чаще), так и окислителя (реже).
н
н
Слайд 4Восстановительные свойства:
при обычных условиях водород вступает в реакцию только с активными
при соблюдении жестких условий взаимодействует с большинством неметаллов;
обладает способностью восстанавливать металлы до простых веществ из их оксидов (этот промышленный способ получения металлов называют водородотермией).
В органических синтезах используются реакции насыщения водородом (гидрирования) и реакции отщепления водорода от молекулы (дегидрирования).
Эти способы позволяют получать углеводороды и другие органические соединения.
Химические свойства ВОДОРОДА
Окислительные свойства:
взаимодействует с активными (щелочными и щелочноземельными) металлами, в результате чего образуются гидриды — солеподобные образования;
при реакции водорода
(под воздействием сильной освещенности или при нагревании)
с малоактивными металлами также образуются гидриды.
Слайд 5Реакции взаимодействия с простыми веществами – неметаллами:
2H2 + O2 = 2H2O + Q
H2 + S = H2S (t = 150 – 300 C);
3H2 + N2 ↔ 2NH3 (t = 500 C, p, kat = Fe, Pt);
2H2 + C ↔ CH4 (t , p, kat).
Водород проявляет свойства восстановителя
Н20 -2е → 2Н+
в следующих реакциях:
2. Водород реагирует с галогенами:
H2 + Hal2 = 2HHal;
причем, реакция взаимодействия со фтором tкомн со взрывом:
H2 + F2 = 2HF
с хлором – hν (при освещении или УФ-облучении):
H2 + Cl2 = 2HCl
с бромом и йодом только при нагревании;
H2 + Br2 = 2HBr
H2 + I2 = 2HI
кислородом (смесь кислорода и водорода в объемном отношении 2:1 называют «гремучим газом»),
серой, азотом и углеродом:
Реакции взаимодействия с простыми веществами
Слайд 62. Водород реагирует с оксидами малоактивных металлов,
причем он способен восстанавливать только
стоящие в ряду активности правее цинка:
CuO + H2 = Cu + H2O (t );
Fe2O3 + 3H2 = 2Fe + 3H2O (t );
WO3 + 3H2 = W + 3H2O (t ).
Реакции взаимодействия со сложными веществами
Водород реагирует с оксидами неметаллов:
H2 + CO2 ↔ CO + H2O (t);
2H2 + CO ↔ CH3OH
(t = 300 C, p = 250 – 300 атм., kat = ZnO, Cr2O3).
Слайд 7CH2 = CH2 + H2 ↔ CH3-CH3;
C6H6 + 3H2 ↔ C6H12;
C3H6 + H2 ↔ C3H8;
CH3CHO + H2 ↔ CH3-CH2-OH;
CH3-CO-CH3 +
Водород вступает в реакции гидрирования с органическими соединениями класса: циклоалканов, алкенов, аренов, альдегидов и кетонов и др.
Все эти реакции проводят при нагревании, под давлением, в качестве катализаторов используют платину или никель:
Реакции взаимодействия со сложными веществами
Слайд 82Na +H2 ↔ 2NaH (t, p).
Ca + H2 ↔ CaH2 (t, p).
Водород
в качестве окислителя
Н2 +2е
выступает в реакциях взаимодействия со щелочными и щелочноземельными металлами.
При этом образуются гидриды – кристаллические ионные соединения,
в которых водород проявляет степень окисления -1.
Гидриды металлов – сильные восстановители:
NaH + H2O = NaOH + H2
Слайд 9Хотя все атомы одного элемента имеют одинаковое число протонов,
эти атомы могут
Такие различные атомы одного и того же элемента называются изотопами.
Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает.
По этой причине в природе существует гораздо больше химических элементов,
чем указано в таблице Д.И. Менделеева,
которая систематизирует элементы по числу протонов
(порядковый номер).
Изотопы
Слайд 10Природный водород состоит из двух стабильных изотопов –
протия 1Н (99,98%) и
(0,015%) – и радиоактивного изотопа трития 3Н (Т)
Изото́пы водорода — разновидности атомов (и ядер) химического элемента водорода, имеющие разное содержание нейтронов в ядре.
На данный момент известны 7 изотопов водорода.
Водород встречается в виде трёх изотопов,
которые имеют индивидуальные названия:
1H — протий (Н), 2Н — дейтерий (D), 3Н — тритий (T; радиоактивный).
Протий и дейтерий являются стабильными изотопами
с массовыми числами 1 и 2.
Содержание их в природе следовательно составляет
99,9885 ± 0,0070 % и 0,0115 ± 0,0070 %.
Это соотношение может незначительно меняться исходя из источника и
способа получения водорода.
Изотоп водорода 3Н (тритий) нестабилен.
Его период полураспада составляет 12,32 лет.
Тритий содержится в природе в очень малых количествах.
+
+
+