- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Химическая связь (11 класс)
Содержание
- 1. Химическая связь (11 класс)
- 2. Электроотрицательность- количественная характеристика способности атома в молекуле
- 3. Слайд 3
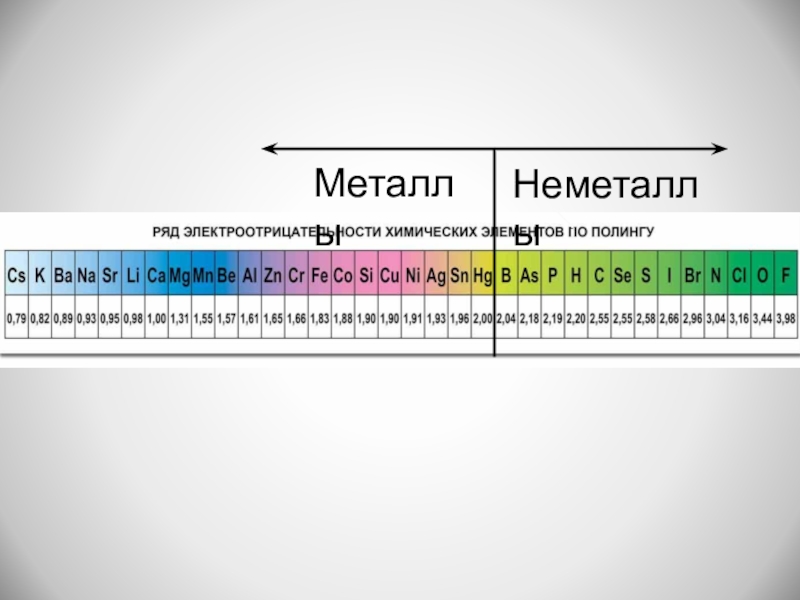
- 4. МеталлыНеметаллы
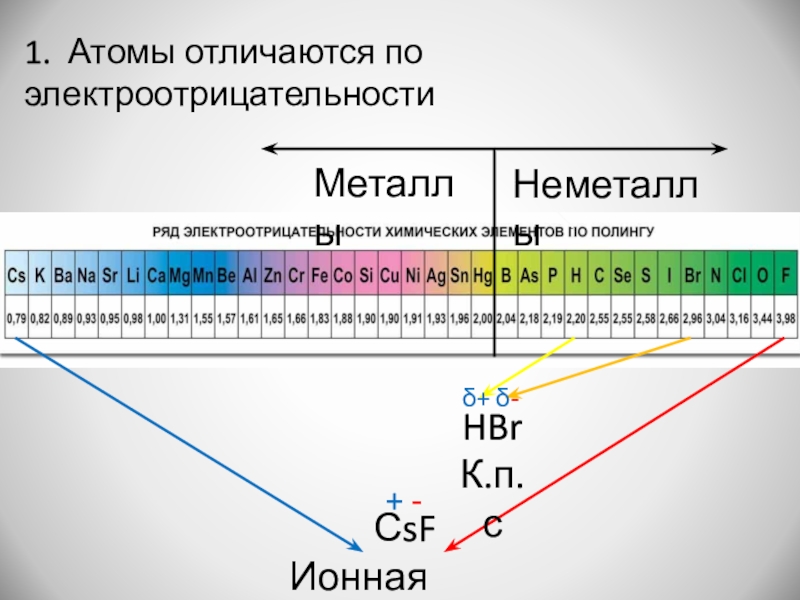
- 5. МеталлыНеметаллы1. Атомы отличаются по электроотрицательностиСsFИонная связь+ -HBrК.п.сδ+ δ-
- 6. 2. Атомы не отличаются по электроотрицательностиА. Неметалл
- 7. Б. металл простое вещество
- 8. Механизм образования связиИонная связь электростат.притяжение ионов Типичные представители: соли, щелочи.
- 9. Механизм образования связи2. кпсТипичные представители: кислоты, оксиды НеМе, ЛВС (летучие водородные соединения)
- 10. Механизм образования связи3. кнсКак и галогеныF2 Cl2 Br2 I2 Типичные представители: простые вещества неметаллы
- 11. Механизм образования связи4. Металлическая связьКак и галогеныF2 Cl2 Br2 I2 Типичные представители: простые вещества неметаллы
- 12. Механизм образования связи6. Водородная связьА. Межмолекулярная Вода
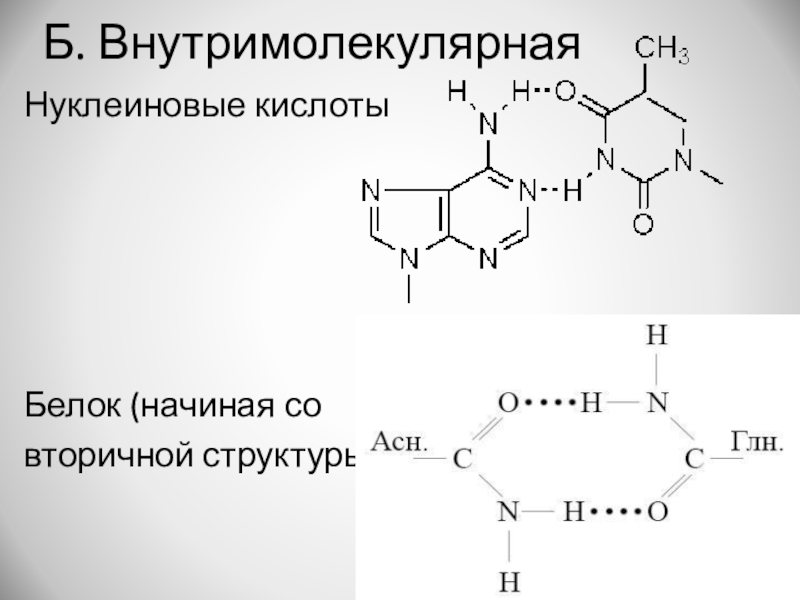
- 13. Б. ВнутримолекулярнаяНуклеиновые кислотыБелок (начиная совторичной структуры)
- 14. ВалентностьПользуясь валентностью, становится удобно расписывать структурные формулы
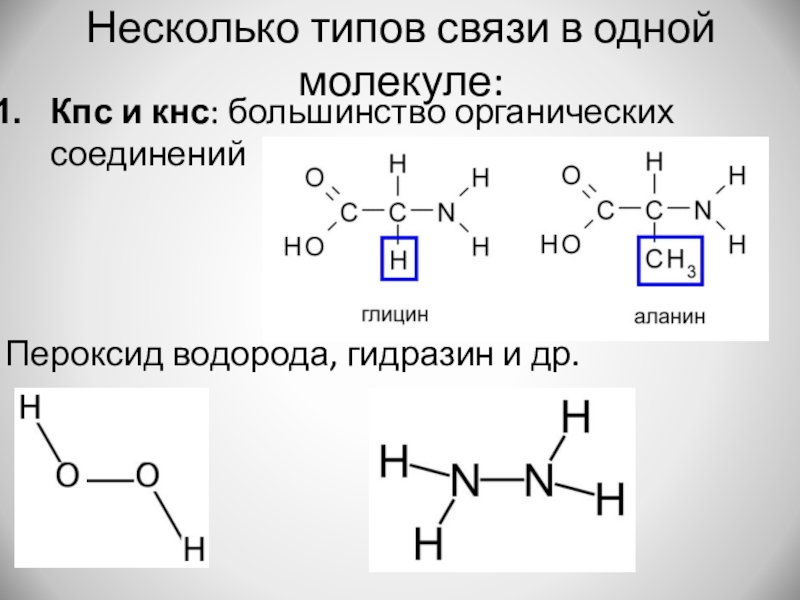
- 15. Несколько типов связи в одной молекуле:Кпс и кнс: большинство органических соединенийПероксид водорода, гидразин и др.
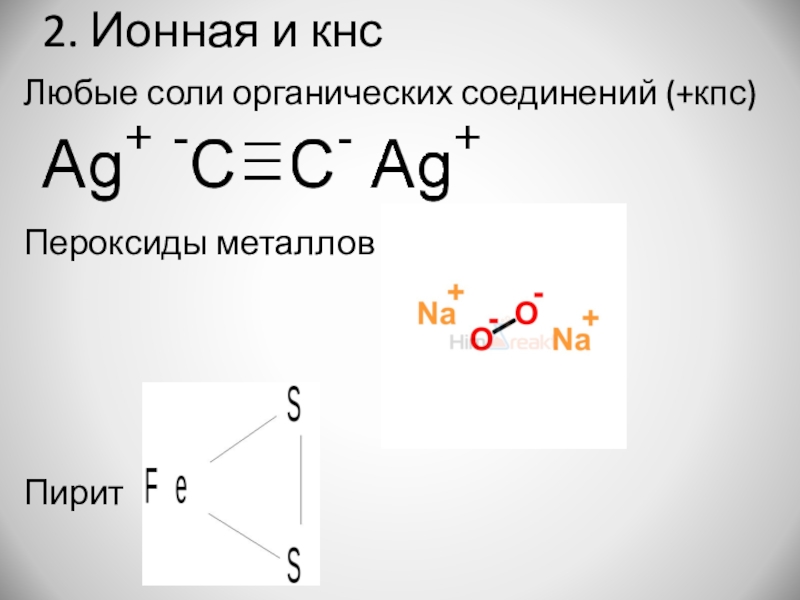
- 16. 2. Ионная и кнсЛюбые соли органических соединений (+кпс) Пероксиды металловПирит
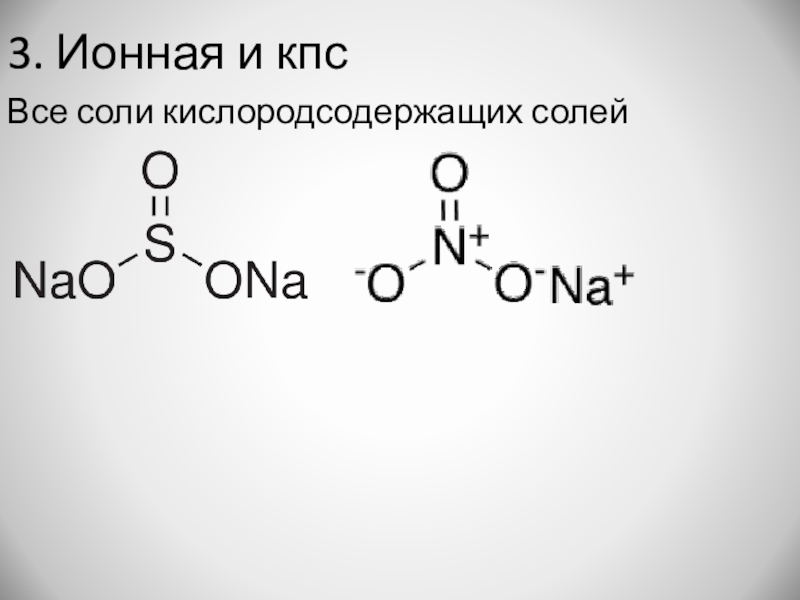
- 17. 3. Ионная и кпсВсе соли кислородсодержащих солей
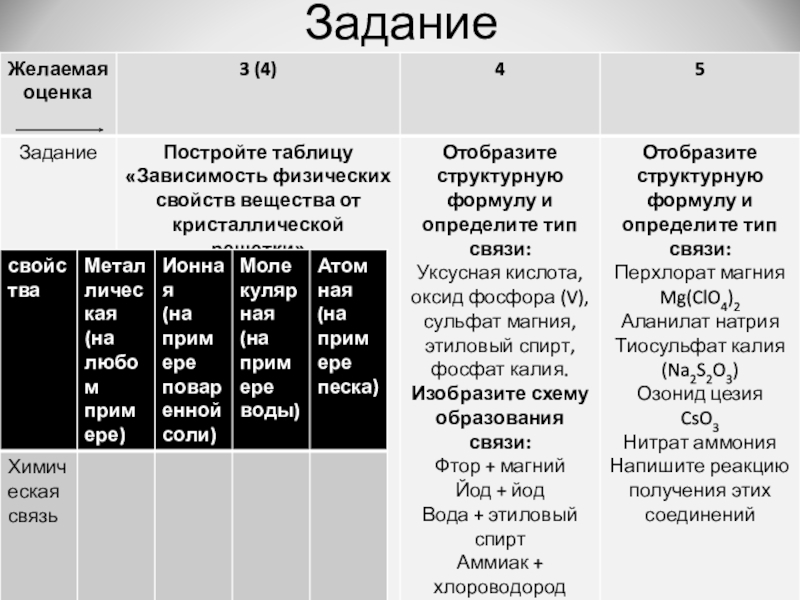
- 18. Задание
Электроотрицательность- количественная характеристика способности атома в молекуле смещать к себе общие электронные пары, то есть способность атомов оттягивать к себе электроны других атомов.
Слайд 2Электроотрицательность
- количественная характеристика способности атома в молекуле смещать к себе общие
электронные пары, то есть способность атомов оттягивать к себе электроны других атомов.
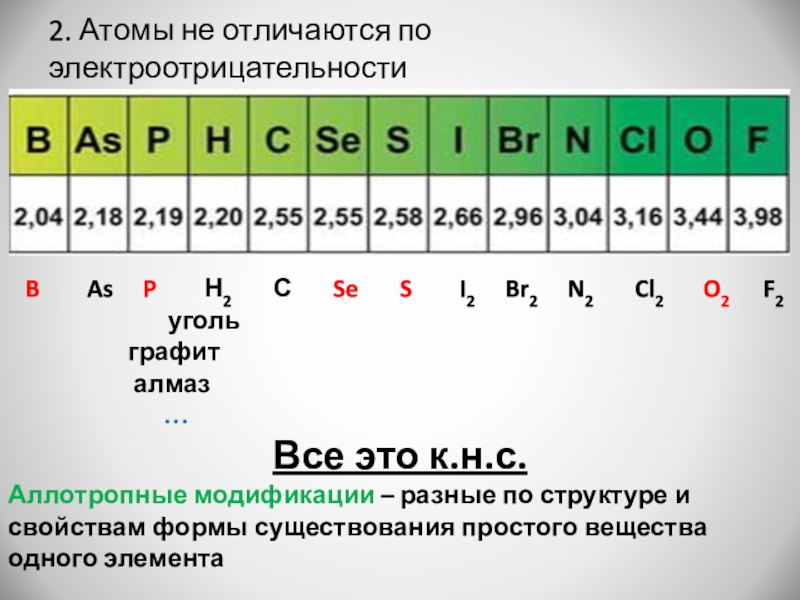
Слайд 62. Атомы не отличаются по электроотрицательности
А. Неметалл простое вещество
B
As P Н2 С Se S I2 Br2 N2 Cl2 O2 F2
уголь
графит
алмаз
…
Все это к.н.с.
Аллотропные модификации – разные по структуре и свойствам формы существования простого вещества одного элемента
уголь
графит
алмаз
…
Все это к.н.с.
Аллотропные модификации – разные по структуре и свойствам формы существования простого вещества одного элемента
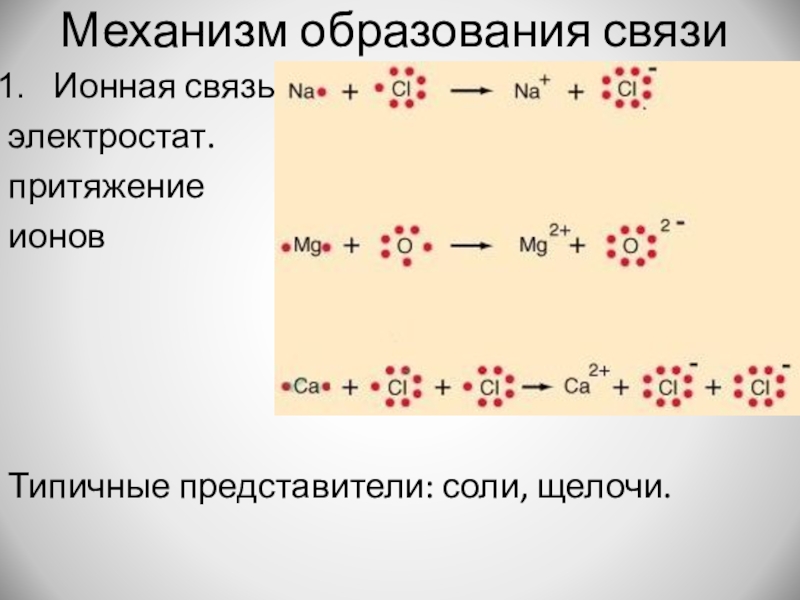
Слайд 8Механизм образования связи
Ионная связь
электростат.
притяжение
ионов
Типичные представители: соли, щелочи.
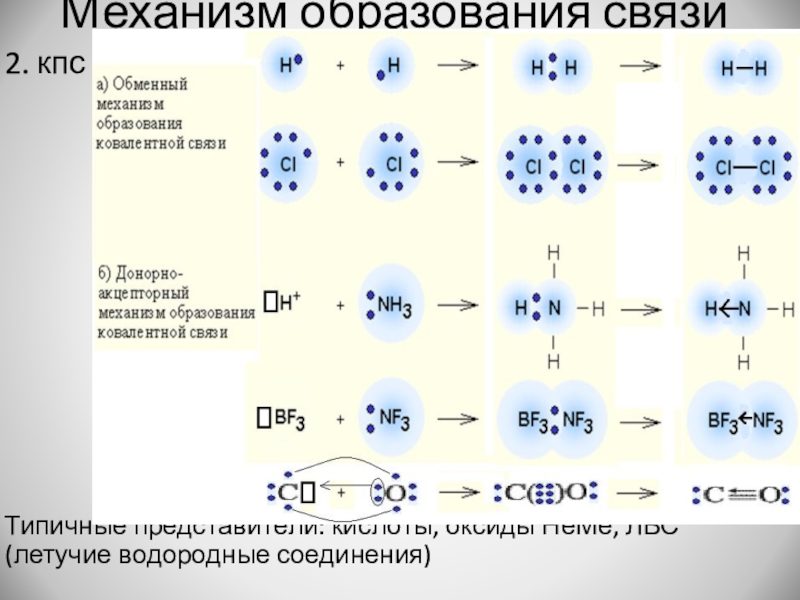
Слайд 9Механизм образования связи
2. кпс
Типичные представители: кислоты, оксиды НеМе, ЛВС (летучие водородные
соединения)
Слайд 10Механизм образования связи
3. кнс
Как и галогены
F2 Cl2 Br2 I2
Типичные представители:
простые вещества неметаллы
Слайд 11Механизм образования связи
4. Металлическая связь
Как и галогены
F2 Cl2 Br2 I2
Типичные
представители: простые вещества неметаллы
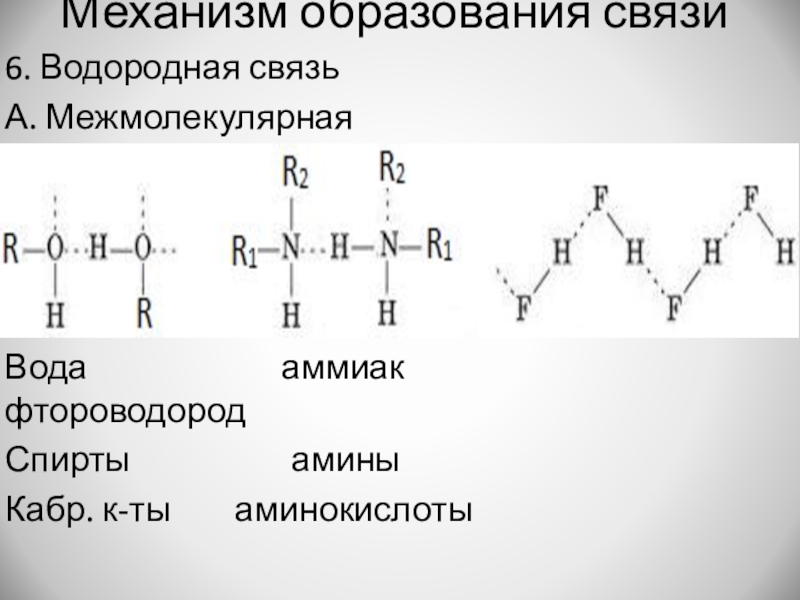
Слайд 12Механизм образования связи
6. Водородная связь
А. Межмолекулярная
Вода
аммиак фтороводород
Спирты амины
Кабр. к-ты аминокислоты
Спирты амины
Кабр. к-ты аминокислоты
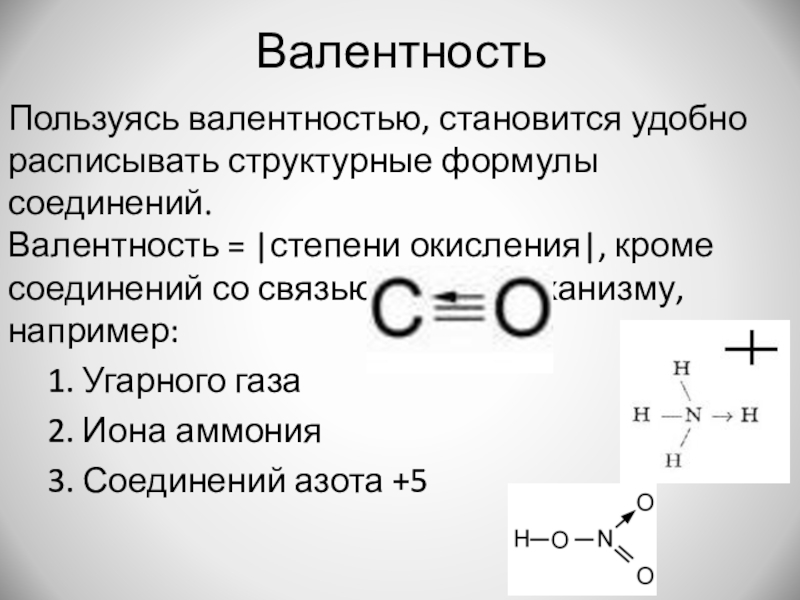
Слайд 14Валентность
Пользуясь валентностью, становится удобно расписывать структурные формулы соединений.
Валентность = |степени окисления|,
кроме соединений со связью по Д-А механизму, например:
1. Угарного газа
2. Иона аммония
3. Соединений азота +5
1. Угарного газа
2. Иона аммония
3. Соединений азота +5
Слайд 15Несколько типов связи в одной молекуле:
Кпс и кнс: большинство органических соединений
Пероксид
водорода, гидразин и др.