- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Гибридизация атомных орбиталей и геометрия молекул
Содержание
- 1. Гибридизация атомных орбиталей и геометрия молекул
- 2. Свойства ковалентной связиДлинаПоляризуемостьЭнергияНасыщаемостьНаправленность
- 3. Насыщаемость- определяется числом общих электронных пар, полное
- 4. Поляризуемость- способность молекул и отдельных связей в
- 5. Направленность –пространственная структура молекул, т.е геометрическая форма,
- 6. Гибридизация – Переход атома углерода из основного
- 7. Слайд 7
- 8. sp-гибридизация Сложные неорганические вещества
- 9. Слайд 9
- 10. sp2-гибридизация Сложные неорганические вещества
- 11. Слайд 11
- 12. sp3-гибридизация
- 13. Слайд 13
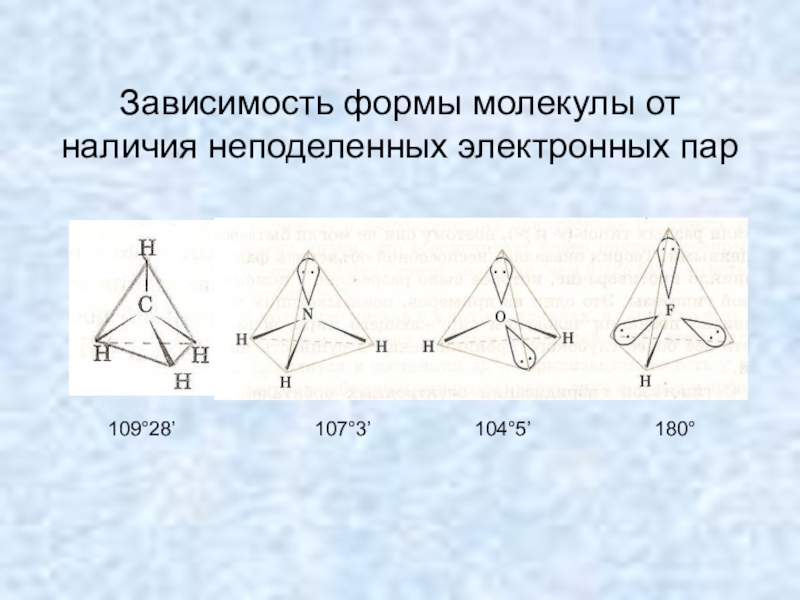
- 14. Зависимость формы молекулы от наличия неподеленных электронных пар109°28’107°3’104°5’180°
- 15. Молекула воды
Свойства ковалентной связиДлинаПоляризуемостьЭнергияНасыщаемостьНаправленность
Слайд 3Насыщаемость- определяется числом общих электронных пар, полное использование атомом своих валентных
орбиталей, молекулы имеют строго определенный состав.
Например: H2,HCL,H2O,CH4
Например: H2,HCL,H2O,CH4
Слайд 4Поляризуемость- способность молекул и отдельных связей в них изменять своя полярность
под влиянием внешнего электрического поля.
Например: HCL
Например: HCL
Слайд 5Направленность –пространственная структура молекул, т.е геометрическая форма, она зависит от гибридизации
валентных орбиталей центрального атома и их пространственного расположения
Слайд 6Гибридизация –
Переход атома углерода из основного состояния в возбужденное
процесс выравнивания
электронных облаков по форме и энергии