- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Галогены. Соединения галогенов
Содержание
- 1. Галогены. Соединения галогенов
- 2. УЛЫБНИСЬ НОВОМУ ЗНАНИЮ Давайте изучим мы
- 3. ЦЕЛИ УРОКА:На основе положения в ПСХЭМ рассмотреть
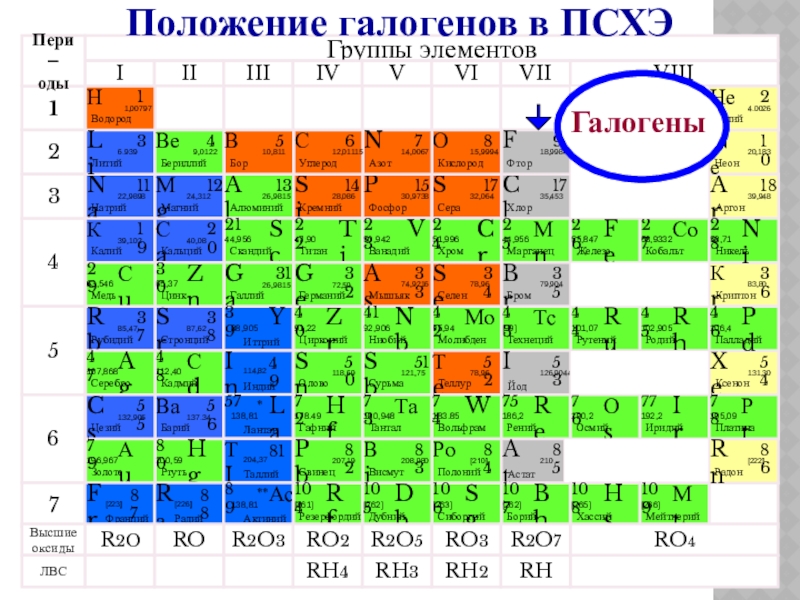
- 4. ГалогеныПоложение галогенов в ПСХЭ
- 5. ОБЩАЯ ХАРАКТЕРИСТИКА
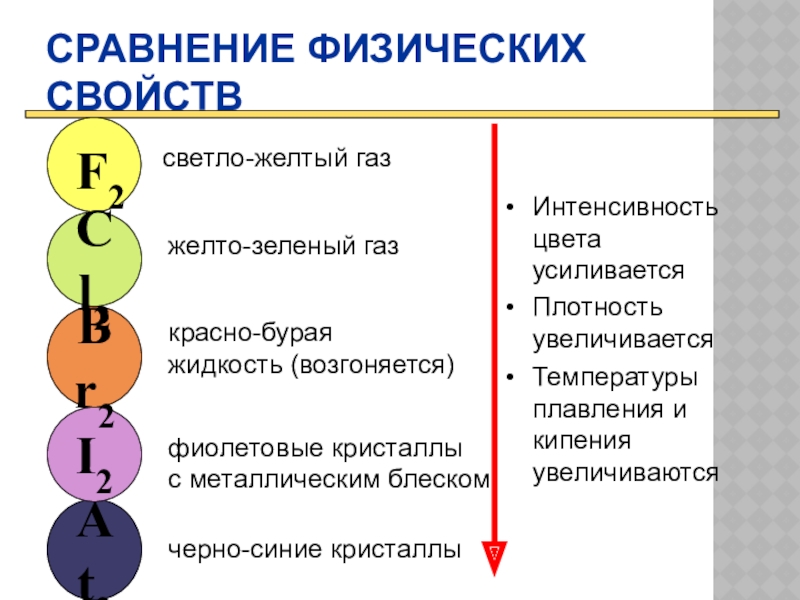
- 6. СРАВНЕНИЕ ФИЗИЧЕСКИХ СВОЙСТВИнтенсивность цвета усиливаетсяПлотность увеличиваетсяТемпературы плавления
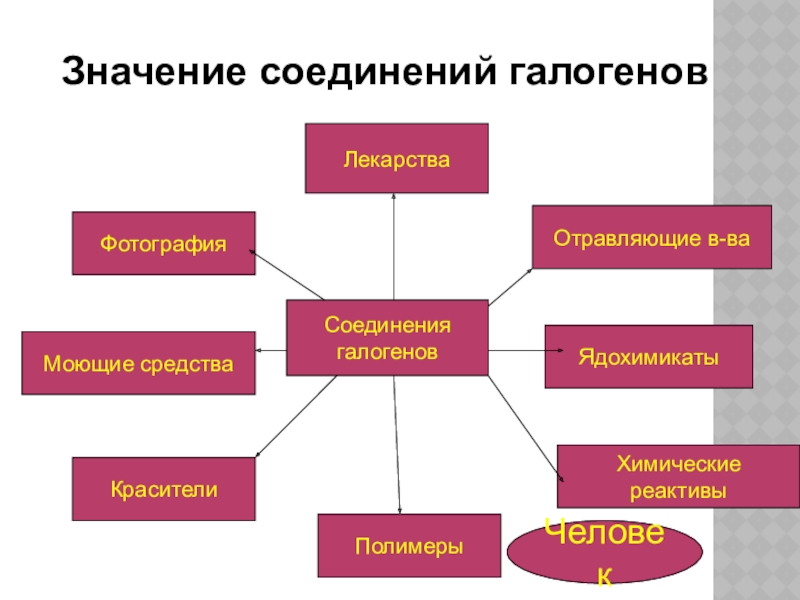
- 7. ЛекарстваМоющие средстваКрасителиПолимерыХимические реактивыЯдохимикатыОтравляющие в-ваФотографияЗначение соединений галогеновСоединения галогеновЧеловек
- 8. ИСТОРИЯ ОТКРЫТИЯ ФТОРА
- 9. ИСТОРИЯ ОТКРЫТИЯ ХЛОРА
- 10. ИСТОРИЯ ОТКРЫТИЯ БРОМА
- 11. ИСТОРИЯ ОТКРЫТИЯ ЙОДА
- 12. ИСТОРИЯ ОТКРЫТИЯ АСТАТА
- 13. Нахождение галогенов в природеCaF2 (флюорит)Бесцветный,желтый, голубой, фиолетовыйAgBr (бромаргирит)-примеси к другим минераламБесцветный, розовый, желтый
- 14. Нахождение галогенов в природе NaСl (галит)Бесцветный, красный, желтый, синий, голубой3Ca(PO4 ) 2*CaF2 (апатит)Бесцветный,фиолетовый
- 15. СОЛИФторидыХлоридыБромидыЙодидыГалогениды Na F KClKBrNaI
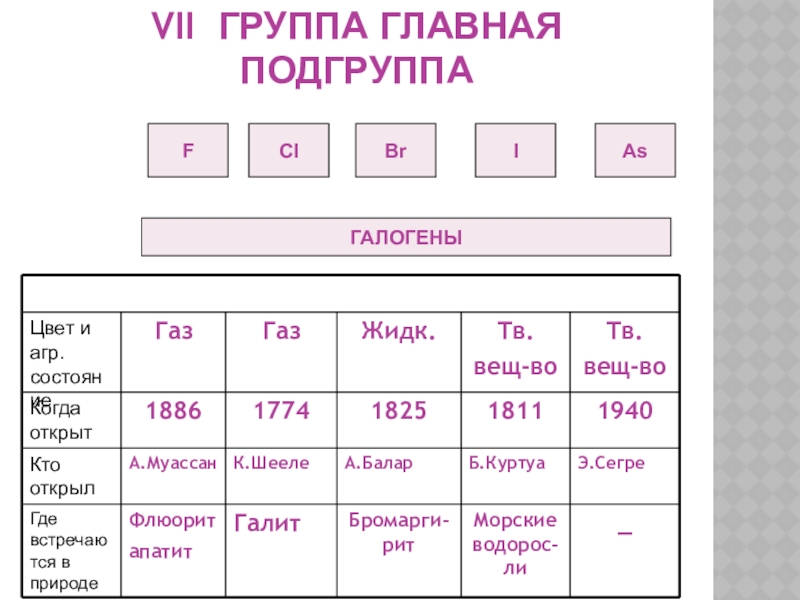
- 16. VII ГРУППА ГЛАВНАЯ ПОДГРУППАFCIBrIAsГАЛОГЕНЫ
- 17. Хлор хвалился: «Нет мне равных!Галоген я -
- 18. Проверить F2
- 19. Химические свойства хлораCl2 - сильно реакционоспособен (искл.
- 20. Химические свойства бромаBr2 - умеренно реакционоспособен.Вытесняется из солей фтором и хлором.
- 21. Химические свойства йодаI2 - мало реакционоспособен.Вытесняется из солей фтором, хлором и бромом.
- 22. СОЕДИНЕНИЯ ГАЛОГЕНОВ Галогеноводороды, – Это едкие газы
- 23. Применение хлораОтбеливателиПроизводство HClПолучение
- 24. КРОССВОРД « ГАЛОГЕНЫ »
- 25. Xe + 2F2 = H2 + F2
- 26. Параграф 18, в ПТ. Стр.116-117 зад.1-5
Слайд 1ГАЛОГЕНЫ. СОЕДИНЕНИЯ ГАЛОГЕНОВ
Подготовила:
Краснова
Оксана Владимировна
Учитель химии
МОУ СОШ № 125
Слайд 2УЛЫБНИСЬ НОВОМУ ЗНАНИЮ
Давайте изучим мы сегодня
элементы галогены.
А по-русски - солероды,
Все – от фтора и до йода.
Даже неустойчивый астат
Быть в семействе этом рад.
Слайд 3ЦЕЛИ УРОКА:
На основе положения в ПСХЭМ рассмотреть и сформулировать знания о
Рассмотреть физические и химические свойства и применение важнейших соединений галогенов.
Слайд 5ОБЩАЯ ХАРАКТЕРИСТИКА
+9 ) )
2 7
+17 ) ) )
2 8 7
+35 ) ) ) )
2 8 18 7
+53 ) ) ) ) )
2 8 18 18 7
Заряд ядра увеличивается
Радиус атома увеличивается
Количество валентных электронов равно 7
Притяжение валентных электронов к ядру уменьшается
Способность отдавать электроны увеличивается
Неметаллические свойства ослабевают
Окислительная способность уменьшается
Уменьшается электроотрицательность (ЭО)
Увеличивается сила галогеноводородных кислот
Уменьшается кислотный характер высших оксидов.
Слайд 6СРАВНЕНИЕ ФИЗИЧЕСКИХ СВОЙСТВ
Интенсивность цвета усиливается
Плотность увеличивается
Температуры плавления и кипения увеличиваются
At2
I2
Br2
Cl2
светло-желтый газ
желто-зеленый
красно-бурая
жидкость (возгоняется)
фиолетовые кристаллы
с металлическим блеском
черно-синие кристаллы
Слайд 7Лекарства
Моющие средства
Красители
Полимеры
Химические реактивы
Ядохимикаты
Отравляющие в-ва
Фотография
Значение соединений галогенов
Соединения
галогенов
Человек
Слайд 8ИСТОРИЯ ОТКРЫТИЯ ФТОРА
В 1886
Анри Муассан
(1852 – 1907 г.)
2HF→H2↑ + F2↑
Слайд 9ИСТОРИЯ ОТКРЫТИЯ ХЛОРА
В 1774 году шведский
В 1807 году английский химик Гемфри Дэви получил тот же газ. Он пришел к выводу, что получил новый элемент и назвал его "хлорин" (от "хлорос" - желто-зеленый).
В 1812 году Гей-Люсеок дал газу название хлор.
Карл Вильгельм Шееле
(1742 – 1786 г.)
MnO2+ 4HCl → Cl2+ MnCl2 + 2H2O
Слайд 10ИСТОРИЯ ОТКРЫТИЯ БРОМА
В 1825 году французский
Антуан Жером Балар
(1802 – 1876 г.)
2NaBr + Cl2 → 2NaCl + Br2
Слайд 11ИСТОРИЯ ОТКРЫТИЯ ЙОДА
В 1811 году французский
В 1813 году Ж.-Л.Гей-Люссак подробно изучил этот элемент и дал ему современное название. Название "иод" происходит от греческого слова "иодэс" - "фиолетовый" (по цвету паров).
Бернар Куртуа (1777 – 1838 г. )
2 NaI + 2 H2SO4 = I2 + SO2 + Na2 SO4 + 2 H2 O
Слайд 12ИСТОРИЯ ОТКРЫТИЯ АСТАТА
В 1869 г
Впервые астат был получен искусственно в 1940 г. открыт Д.Корсоном, К.Маккензи и Э.Сегре (Калифорнийский университет в Беркли). Для синтеза изотопа 211At они облучали висмут альфа-частицами.
Астат является наиболее редким элементом среди всех, обнаруженных в природе. В поверхностном слое земной коры толщиной 1,6 км содержится всего 70 мг астата.
20983Bi + 42He → 21185At + 2 10n
Эрст Сегре
(1914 – 1985 г.)
Слайд 13Нахождение галогенов в природе
CaF2 (флюорит)
Бесцветный,желтый, голубой, фиолетовый
AgBr (бромаргирит)-примеси к другим минералам
Бесцветный,
Слайд 14
Нахождение галогенов в природе
NaСl (галит)
Бесцветный, красный, желтый, синий, голубой
3Ca(PO4 ) 2*CaF2
Бесцветный,
фиолетовый
Слайд 17Хлор хвалился: «Нет мне равных!
Галоген я - самый главный.
Зря болтать я
Всё на свете отбелю!»
Йод красой своей гордился,
Твердым был, но испарился.
Фиолетовый как ночь,
Далеко умчался прочь.
Бром разлился океаном,
Хоть зловонным. Но румяным.
Бил себя он грозно в грудь:
«Я ведь бром! Не кто-нибудь!..»
Фтор молчал и думал:
«Эх!.. Ведь приду – окислю всех…»
Химические свойства галогенов
Слайд 18Проверить
F2 –САМЫЙ РЕАКЦИОНОСПОСОБНЫЙ,
Химические свойства фтора
Слайд 19
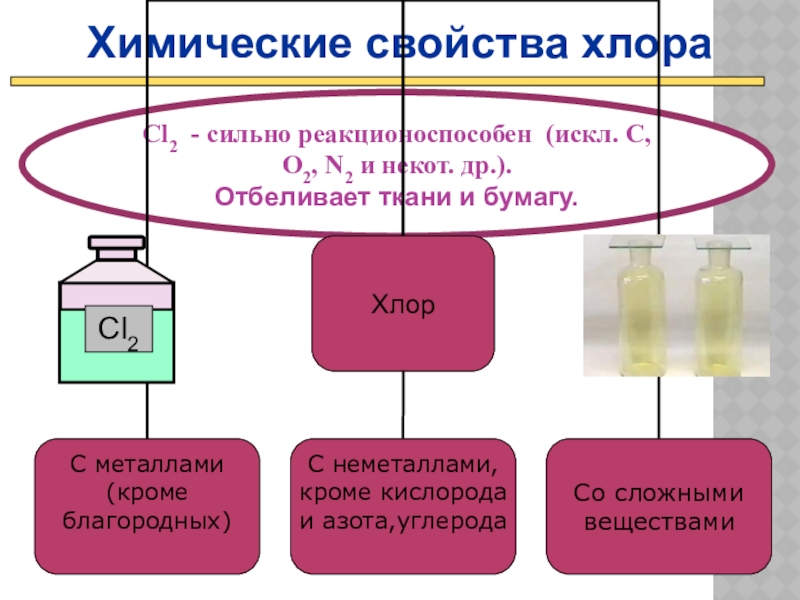
Химические свойства хлора
Cl2 - сильно реакционоспособен (искл. C, O2, N2 и
Отбеливает ткани и бумагу.
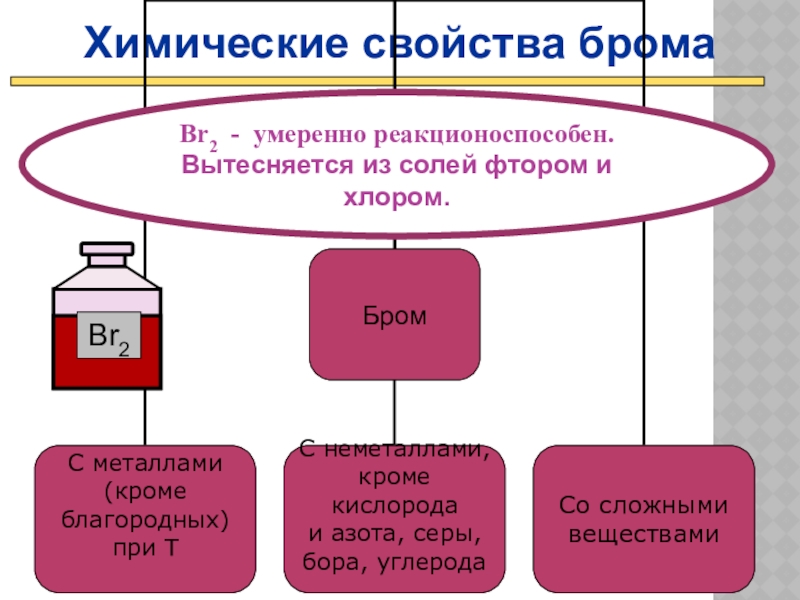
Слайд 20Химические свойства брома
Br2 - умеренно реакционоспособен.
Вытесняется из солей фтором и хлором.
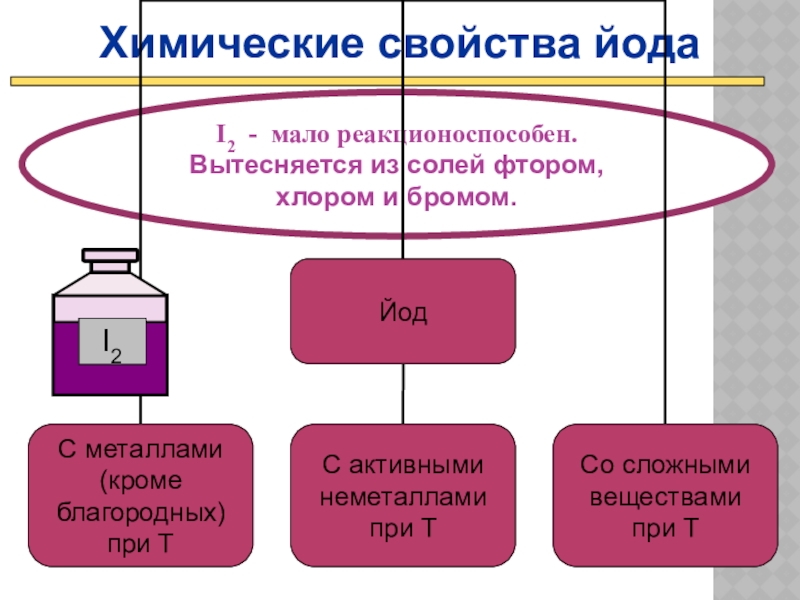
Слайд 21Химические свойства йода
I2 - мало реакционоспособен.
Вытесняется из солей фтором, хлором и
Слайд 22СОЕДИНЕНИЯ ГАЛОГЕНОВ
Галогеноводороды, – Это едкие газы с резким запахом, хорошо
HF HCl HBr HI
фтороводород
хлороводород
бромоводород
йодоводород
Слайд 23
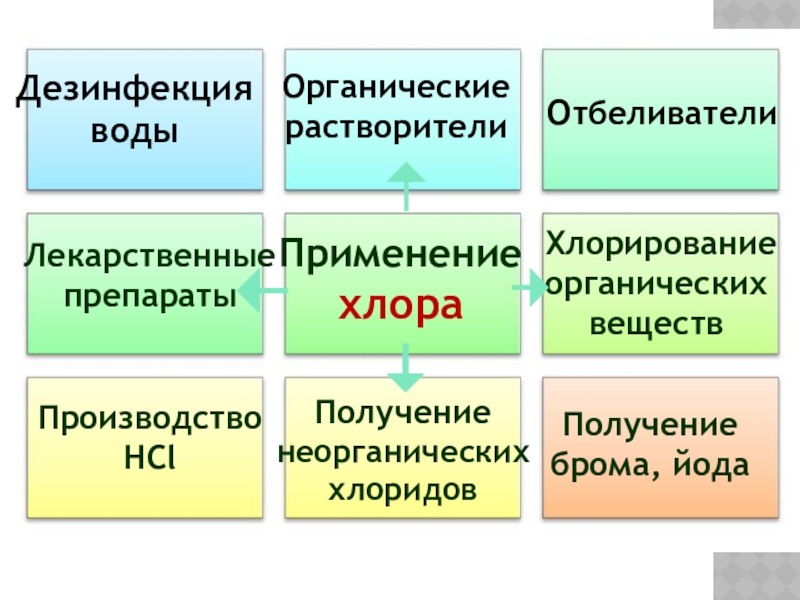
Применение хлора
Отбеливатели
Производство
HCl
Получение брома, йода
Дезинфекция
Органические растворители
Лекарственные препараты
Хлорирование органических веществ
Получение неорганических хлоридов
Слайд 25Xe + 2F2 =
H2 + F2 =
2Au + 3Cl2
2NaCl + 2H2 O =
2NaI + Cl2 =
2H2 O + 2F2 =
2NaOH + H2 +Cl2
2NaCl + I2
XeF4
4 HF + O2
2HF
2AuCl3
Проверь себя
Слайд 26
Параграф 18, в ПТ. Стр.116-117 зад.1-5 по желанию зад.8
Решите задачу:
Домашнее задание