- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Галогены - Физические и химические свойства.
Содержание
- 1. Галогены - Физические и химические свойства.
- 2. Цели: Охарактеризовать положение галогенов
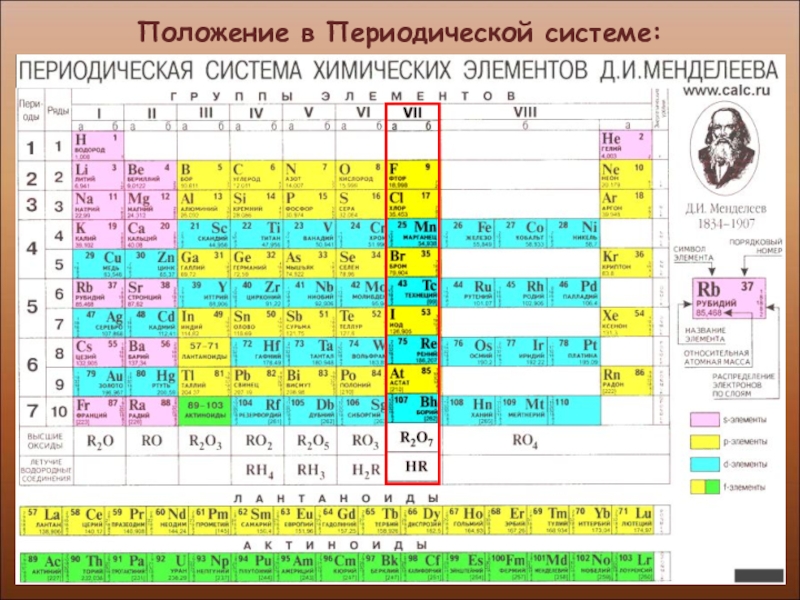
- 3. Положение в Периодической системе:
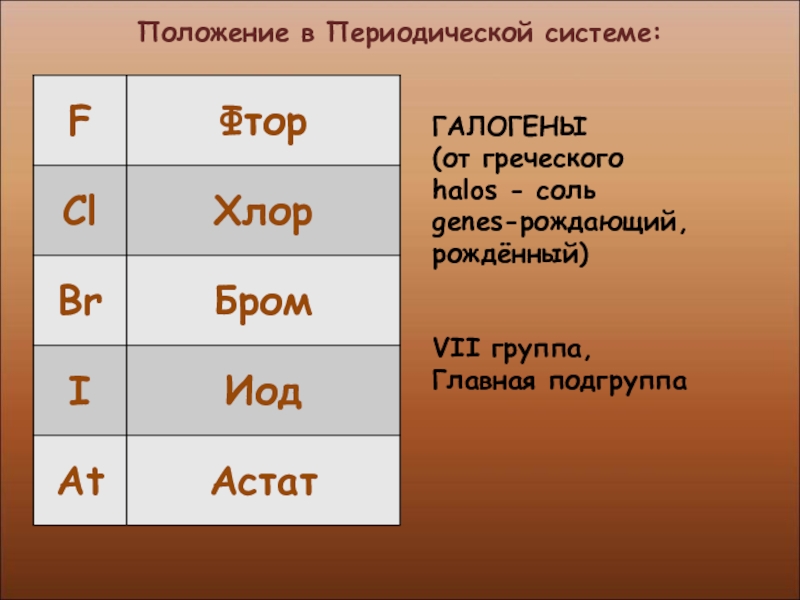
- 4. Положение в Периодической системе:ГАЛОГЕНЫ (от греческогоhalos - соль genes-рождающий, рождённый)VII группа, Главная подгруппа
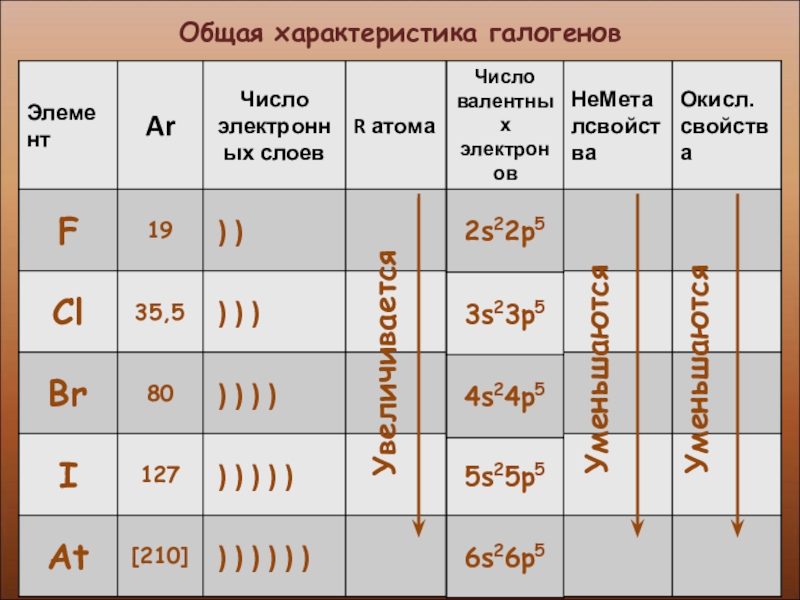
- 5. Общая характеристика галогенов
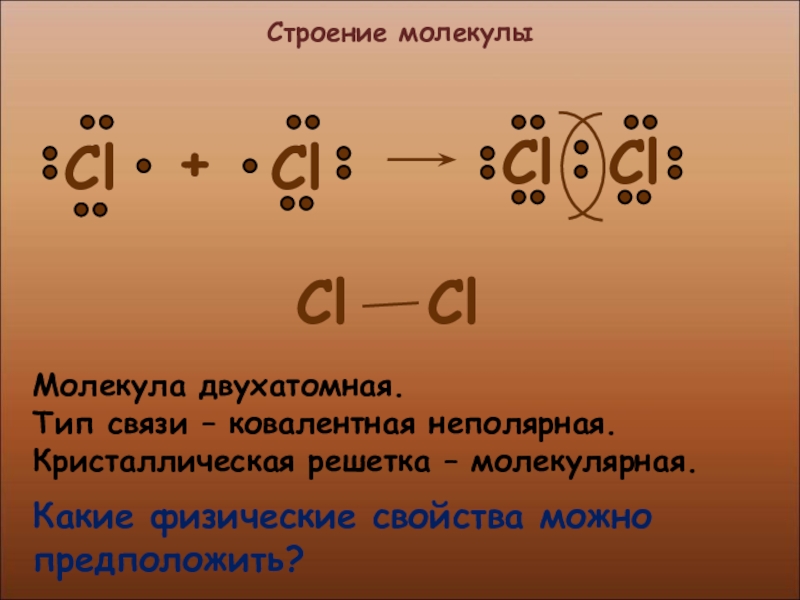
- 6. Строение молекулыМолекула двухатомная.Тип связи – ковалентная неполярная.Кристаллическая решетка – молекулярная.Какие физические свойства можно предположить?
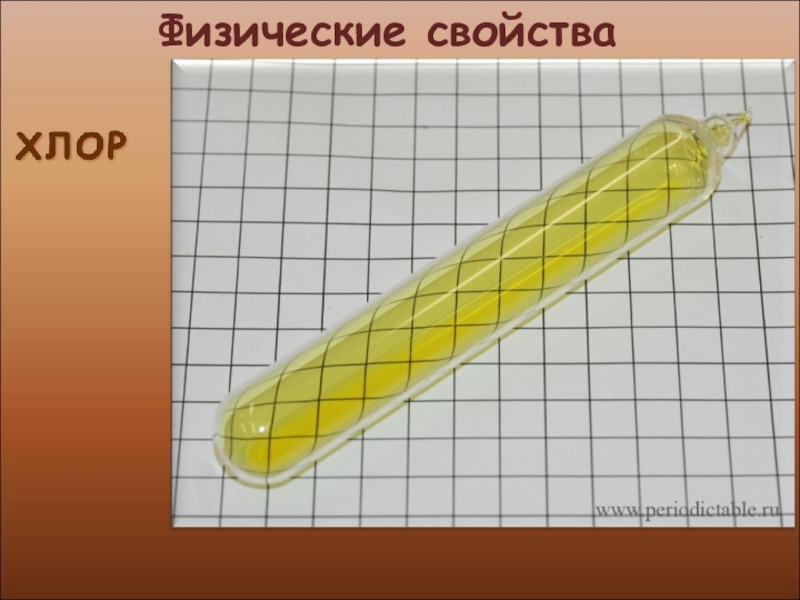
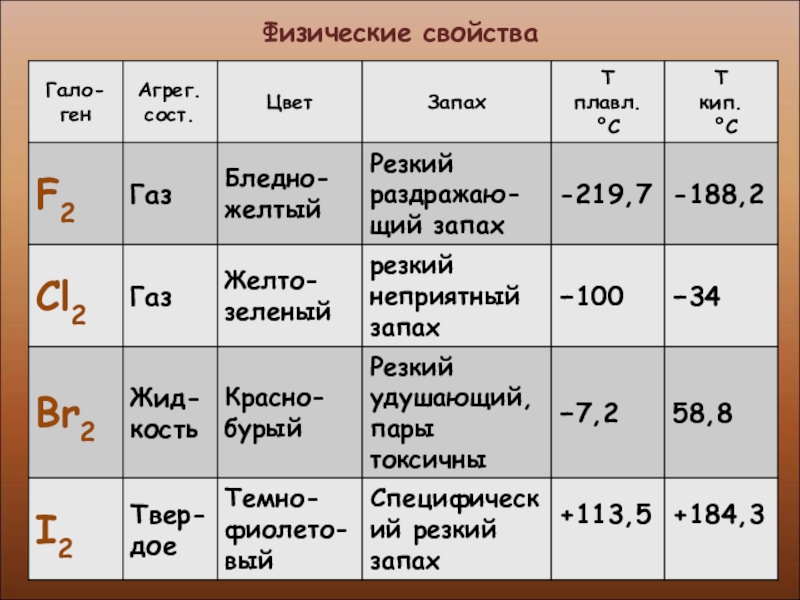
- 7. Физические свойства
- 8. Физические свойства
- 9. Физические свойства
- 10. Физические свойства
- 11. Физические свойства
- 12. Физические свойства
- 13. Физические свойстваЭтот элемент был вторым (после технеция)
- 14. Возгонка йодаКристаллический йод обладает способностью при нагревании
- 15. Нахождение в природе CaF2 Флюорит (плавиковый шпат)
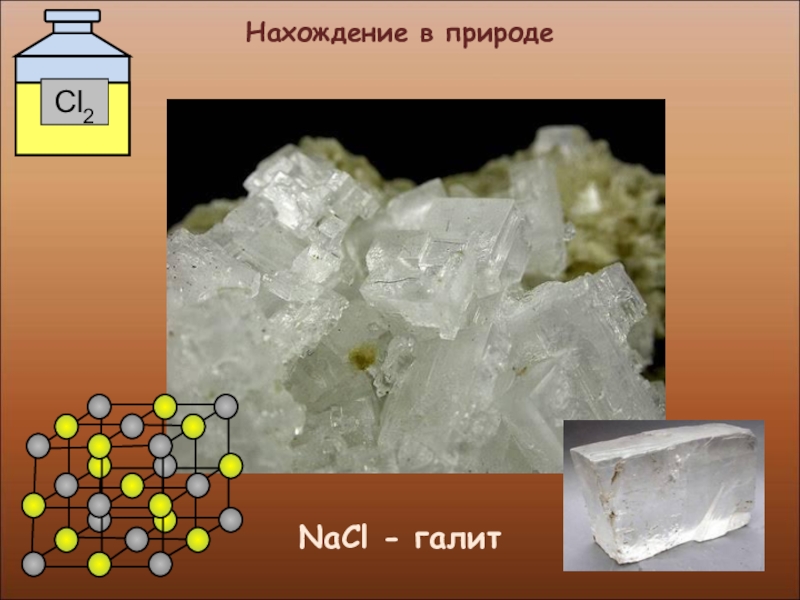
- 16. Нахождение в природеNaCl - галит
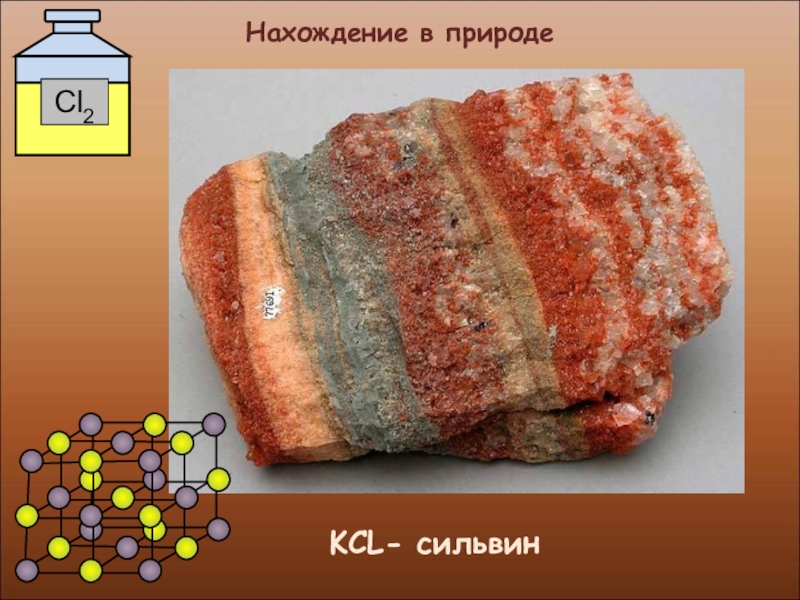
- 17. Нахождение в природе KCL- сильвин
- 18. Нахождение в природеБром и иод добывают из
- 19. Химические свойства
- 20. Химические свойства.При взаимодействии галогенов с металлами образуются
- 21. Химические свойстваПри взаимодействии галогенов с водородом образуются галогеноводороды (при растворении в воде галогеноводороды образуют кислоты)
- 22. Химические свойстваCl2, Br2, I2 взаимодействуют по схеме:Гal2
- 23. Химические свойстваБолее активный галоген вытесняет менее активный
- 24. Химические свойства фтораВзаимодействует со всеми металлами с
- 25. Химические свойства фтораРеагирует при облучении даже с
- 26. Химические свойства брома Химическая активность брома
- 27. Химические свойства йода Химическая активность йода
- 28. Вывод: химическая активность галогенов уменьшается от
- 29. Качественные реакции на галогенид-ионыКачественные реакции на хлориды,
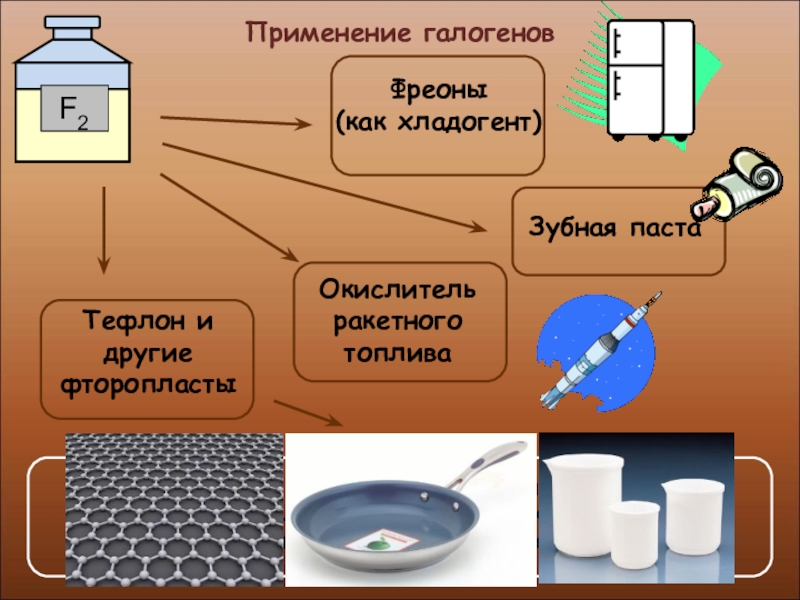
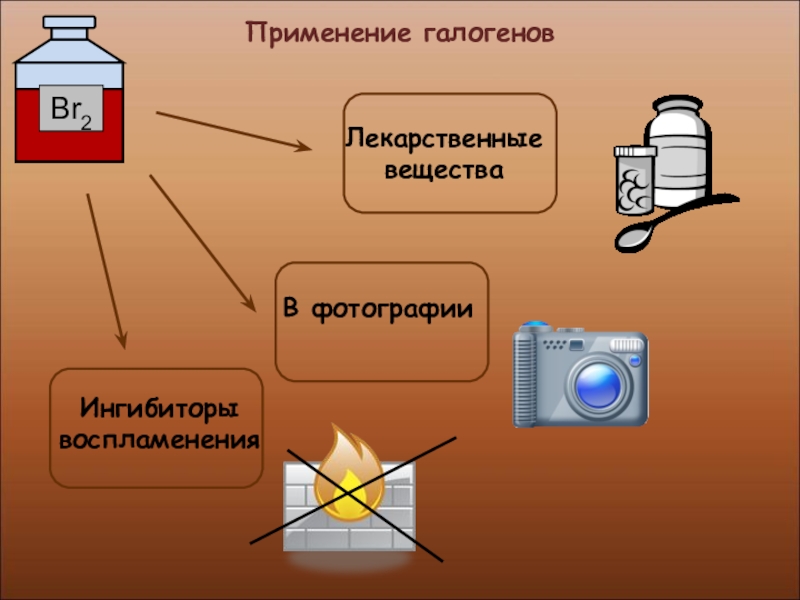
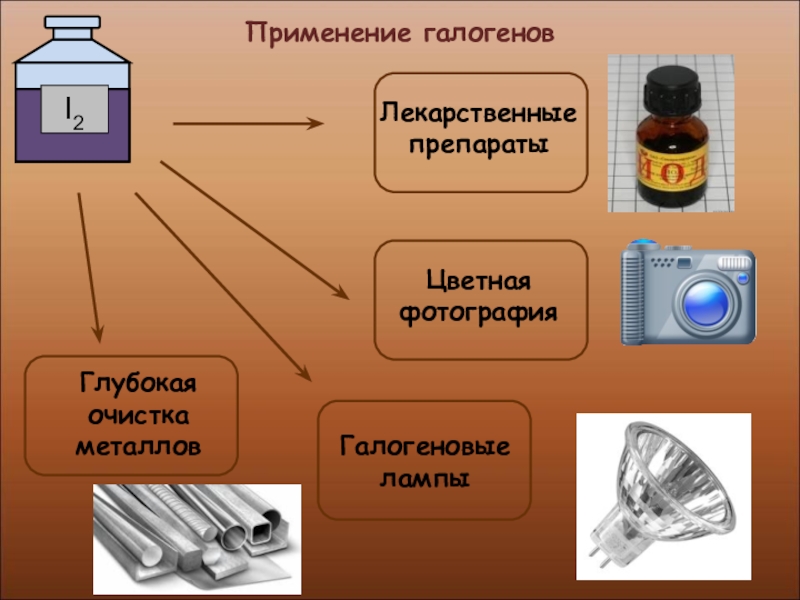
- 30. Применение галогенов
- 31. Применение галогеновПроизводство медикаментов, красок и пластмассПроизводство соляной кислоты и хлоридов
- 32. Применение галогенов
- 33. Применение галогенов
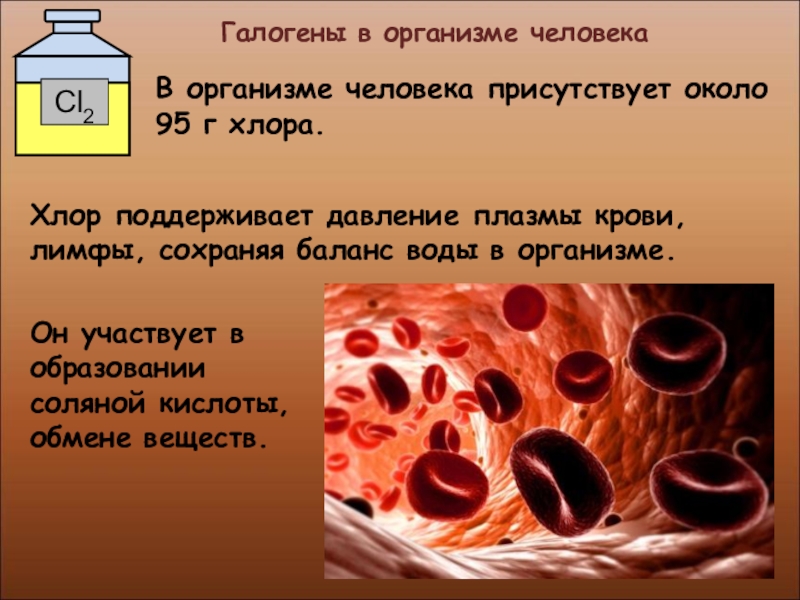
- 34. Галогены в организме
- 35. Галогены в организме человекаОн
- 36. Галогены в организме
- 37. Галогены в организме человекаСодержание
Слайд 2Цели:
Охарактеризовать положение галогенов
в
Д.И.Менделеева.
Охарактеризовать особенности строения
атомов галогенов.
Охарактеризовать физические свойства.
Охарактеризовать химические свойства
галогенов.
Обобщить знания учащихся об
областях применения галогенов.
Слайд 4Положение в Периодической системе:
ГАЛОГЕНЫ
(от греческого
halos - соль
genes-рождающий, рождённый)
VII группа,
Главная подгруппа
Слайд 6Строение молекулы
Молекула двухатомная.
Тип связи – ковалентная неполярная.
Кристаллическая решетка – молекулярная.
Какие физические
Слайд 13Физические свойства
Этот элемент был вторым (после технеция) синтезированным искусственно элементом.
Все
Период полураспада самого стабильного изотопа около 8 часов.
Свойства астата остаются малоизученными.
Слайд 14Возгонка йода
Кристаллический йод обладает способностью при нагревании переходить из твердого состояния
Пары йода
Слайд 18Нахождение в природе
Бром и иод добывают из природных вод.
Источник иода –
водоросли –
ламинарии.
Слайд 20Химические свойства.
При взаимодействии галогенов с металлами образуются соли – галогениды.
Zn +
2Fe + 3Cl2 = 2FeCl3 хлорид железа(III)
2Al + 3Br2 = 2AlBr3 бромид алюминия
2Al + 3I2 = 2AlI3 бромид алюминия
Слайд 21Химические свойства
При взаимодействии галогенов с водородом образуются галогеноводороды (при растворении в
Слайд 22Химические свойства
Cl2, Br2, I2 взаимодействуют по схеме:
Гal2 + H2O = HГalО
Cl2 + H2O = HClO + HCl (хлороводородная кислота)
(хлорноватистая кислота)
Вода горит во фторе:
2F2 + 2H2O = 4HF + O2
Слайд 23Химические свойства
Более активный галоген вытесняет менее активный из
F2 > Cl2 > Br2 > I2 активность уменьшается
2КBr + Cl2 = 2KCl + Br2
Почему для этой реакции не используют фтор?
Слайд 24Химические свойства фтора
Взаимодействует со всеми металлами с выделением большого количества теплоты:
с железом : 3F2 + 2Fe → 2FeF3 + 1974 кДж
При нагревании взаимодействует со многими неметаллами, кроме кислорода, азота и алмаза
с водородом: F2 + H2 → 2HF2 +547 кДж
c кремнием: 2F2 + Si → SiF4 + 1615 кДж
Окисляет другие галогены:
хлор: F2 + Cl2 → 2ClF
бром: F2 + Br2 → 2BrF
йод: F2 + I2 → 2lF
Слайд 25Химические свойства фтора
Реагирует при облучении даже с инертными газами
Взаимодействует со сложными веществами:
с водой: 2F2 + 2H2O → 4HF + O2↑
cо щелочами: 2F2 + 2NaOH → 2NaF + H2O + OF2 ↑
с оксидом кремния: 2F2 + SiO2 → SiF4 + O2↑
Слайд 26Химические свойства брома
Химическая активность брома меньше, чем у фтора
С металлами:
Взаимодействие брома с алюминием
3Br2 + 2Al → 2AlBr3
С неметаллами:
Взаимодействие с водородом
Br2 + H2 → 2 HBr
Взаимодействие с кремнием
2Br2 + Si → SiBr4
При растворении брома в воде образуется бромная вода, которую используют в органической химии.
Слайд 27Химические свойства йода
Химическая активность йода еще ниже, чем у
С металлами только при нагревании:
Взаимодействие йода с железом
I2 + Fe → FeI2
Взаимодействие йода с алюминием
3I2 + 2Al → 2AlI3
С неметаллами:
Взаимодействует с водородом при нагревани
I2 + H2 → 2 HI - Q
Слайд 28Вывод:
химическая активность галогенов уменьшается от фтора к йоду, поэтому
Взаимодействие хлорной воды с галогенидами
2KI + Cl2 → 2KCl + I2
NaCl + Cl2 →
2NaBr + Cl2 → 2NaCl + Br2
Слайд 29Качественные реакции на галогенид-ионы
Качественные реакции на хлориды, бромиды и йодиды -образование
NaCl + AgNO3 → AgCl↓ + NaNO3
белый творожистый осадок
NaBr + AgNO3 → AgBr↓ + NaNO3
желтоватый творожистый осадок
NaI + AgNO3 → AgI↓ + NaNO3
желтый творожистый осадок
Слайд 31Применение галогенов
Производство медикаментов, красок и пластмасс
Производство соляной кислоты и хлоридов
Слайд 34 Галогены в организме человека
Фтор находится в организме
Но наибольшее его количество содержится в зубах, костях, волосах и ногтях.
Кости – своеобразное «депо» фтора.
Недостаток фтора – один из факторов, вызывающих болезнь зубов – кариес.
Слайд 35 Галогены в организме человека
Он участвует в образовании соляной
В организме человека присутствует около 95 г хлора.
Хлор поддерживает давление плазмы крови, лимфы, сохраняя баланс воды в организме.
Слайд 36 Галогены в организме человека
Содержание брома в организме
Бром находится в крови, мозге, печени, почках. Больше всего его в мозге человека.
Препараты брома применяют при заболеваниях нервной системы: истерии, неврастении и других неврозах.
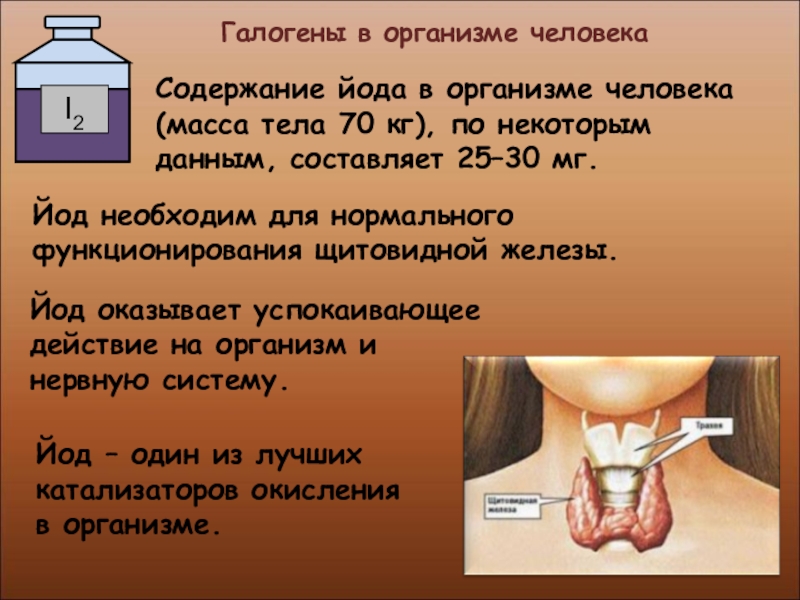
Слайд 37 Галогены в организме человека
Содержание йода в организме человека
Йод необходим для нормального функционирования щитовидной железы.
Йод оказывает успокаивающее действие на организм и нервную систему.
Йод – один из лучших катализаторов окисления в организме.