- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Электронное пособие по изучении темы:Кислородосодержащие углеводороды, Химия 1 курс по направлению обучения 05.02.02 Гидрология и 05.02.03 Метеорология
Содержание
- 1. Электронное пособие по изучении темы:Кислородосодержащие углеводороды, Химия 1 курс по направлению обучения 05.02.02 Гидрология и 05.02.03 Метеорология
- 2. Содержание:Цели и задачи урокаВводная часть урокаСвойства спиртовСвойства
- 3. Свойства спиртовВведение в тему
- 4. Слайд 4
- 5. Применение На
- 6. Применение спиртов в качестве топлива Для топливных
- 7. РастворителиСреди растворителей широкое распространение имеют самые разные
- 8. Слайд 8
- 9. В настоящее время трудно найти область практической
- 10. Свойства карбоновых кислотВведение в тему
- 11. Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH.
- 12. Классификация карбоновых кислотПо числу карбоксильныхгруппнепредельныеароматическиеодноосновныедвухосновныемногоосновныепредельныеПо типу углеводородногорадикала
- 13. Общая формула одноосновных кислот предельного рядаСnH2n+1COOНгде n может быть равно нулю.
- 14. Слайд 14
- 15. Физические свойства Низшие карбоновые кислоты — жидкости с острым
- 16. Характерные химические реакции Наиболее важные химические свойства, характерные
- 17. Изомерия карбоновых кислот. Cтруктурная изомерия: изомерия скелета в
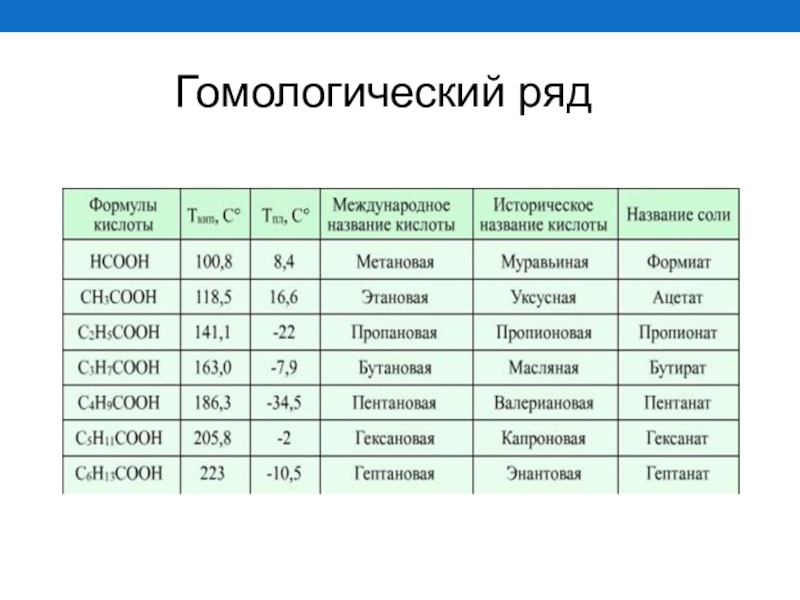
- 18. Гомологический ряд
- 19. Номенклатура и изомерияНазвание карбоновой кислоты образуется от
- 20. ПрименениеМуравьиная кислота обладает дезинфицирующим свойством и поэтому
- 21. Уксусная кислота – хороший растворитель многих органических
- 22. Фармокалогия
- 23. Слайд 23
- 24. В большинстве своем лекарственные препараты редко бывают
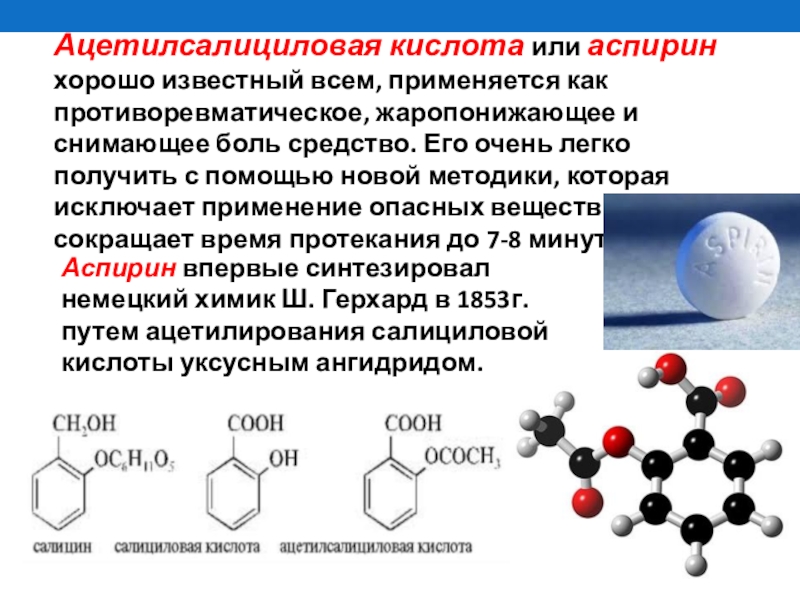
- 25. Ацетилсалициловая кислота или аспирин хорошо
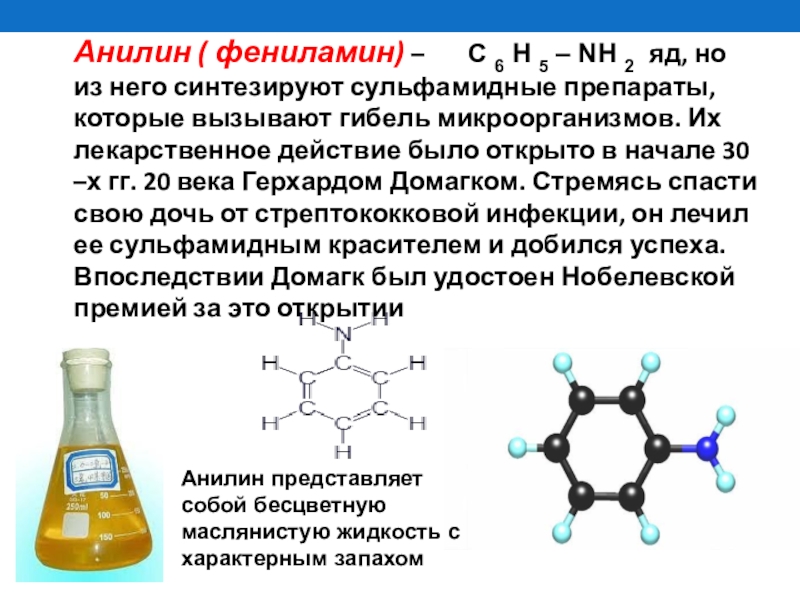
- 26. Анилин ( фениламин) – C 6 H 5 – NH 2 яд, но
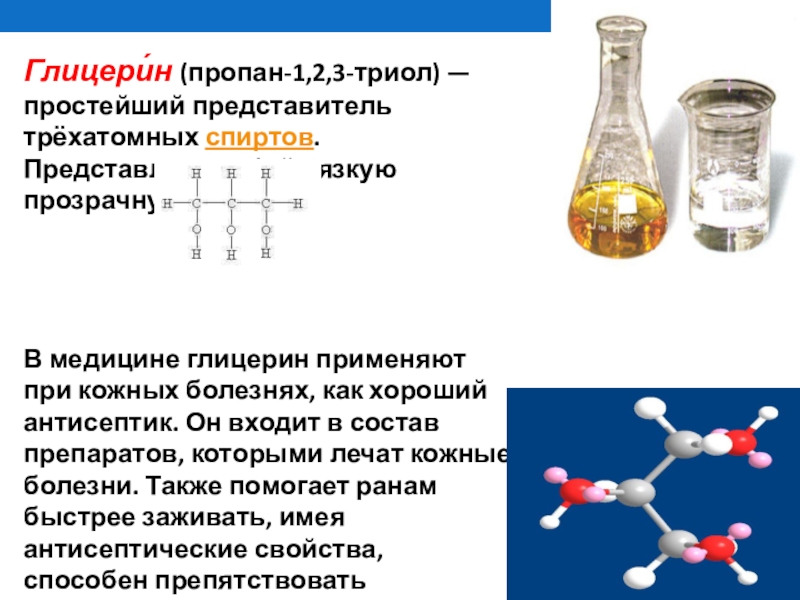
- 27. Глицери́н (пропан-1,2,3-триол) — простейший представитель трёхатомных спиртов. Представляет
- 28. Широко применяется глицерин в фармакологический промышленности. Он
- 29. Салициловая кислота (от лат. salix «ива», из коры которой она была
- 30. Салициловая кислота — активный компонент ивовой коры. Ещё
- 31. Диэтиловый эфир (этиловый эфир, серный эфир). Возможно, что
- 32. Диэтиловый эфир в медицине используется в качестве
- 33. Современная медицина знает способы лечения многих болезней,
- 34. Классификация спиртов:Изучение нового материала
- 35. Классификация спиртов:в) Фенолы а) Одноатомные – одна
- 36. Предельные одноатомные спиртыгде R – остаток алкана.Предельные
- 37. Гомологический ряд спиртов
- 38. Особенности свойств спиртов::Начиная с первого представителя, все
- 39. Изомерия и номенклатураНазвание спиртов образуется от соответствующего
- 40. Изомеры пентанола:
- 41. Химические свойства одноатомных спиртов
- 42. Реакции по гидроксогруппе
- 43. Б) Реакция окисления проводится окислительной смесью спирты
- 44. Б) Реакция этерификации в результате образуются галогенопроизводные
- 45. Реакции по углеводородному радикалу
- 46. Хлорирование:СН3 – СН2 – ОН +
- 47. Методы синтеза спиртов
- 48. 1. Гидролиз галоенопроизводных алканов водным раствором щёлочиtВозможно осуществелние гидролизаарилгалогенидов, но в болеежестких условиях.В результате образуются фенолы.
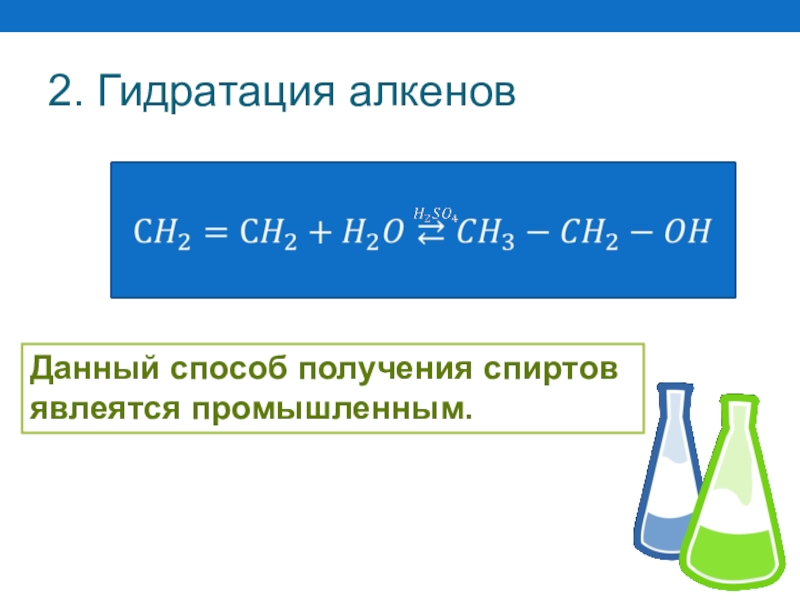
- 49. 2. Гидратация алкеновДанный способ получения спиртов явлеятся промышленным.
- 50. 3. Реакция окисления алкеновНа слайде показана схема
- 51. Некоторые промышленные способы получения спиртов:tброжение
- 52. Закрепление пройденного материала
- 53. Закончите уравнения реакций:OOHkat
- 54. Ответьте на 11 вопросов и угадайте кодовое слово.
- 55. РЕШЕНИЕ КРОССВОРДА. Ключевое слово – УГЛЕВОДОРОД.1.2.3.4.5.6.7.8.10.119.
- 56. Задание на дом:
- 57. Вопросы:Шестой представитель алканов.Образование сложных эфиров называется реакцией
- 58. Вопросы:Шестой представитель алканов.Образование сложных эфиров называется реакцией
- 59. Источники изображенияhttp://img-fotki.yandex.ru/get/9326/130884706.6c/0_a67d8_1c06018b_orighttp://clipart-finder.com/data/png/dandelionmood_Chemical_Flasks.pnghttp://welcometogeorgia.ru/pic/large-2614.jpghttp://www.9948451.ru/uploads/posts/2013-03/1363695262_mystery-chemist.gifhttp://www.jb-webs.com/wp-content/plugins/real-website-builder/pictures/Chemicalsopt.jpg
Слайд 1 Электронное пособие по изучении темы:
«Кислородосодержащие углеводороды»
Дисциплина: Химия
разработан для студентов 1
преподавателем ГОУ СПО ТО «АГМТ»
высшей категории
Антоненко Людмилой Ивановной
Слайд 2Содержание:
Цели и задачи урока
Вводная часть урока
Свойства спиртов
Свойства карбоновых кислот
Фармакология
Классификация спиртов
Химические свойства
Реакции по гидроксогруппе
Реакции по углеводородному радикалу
Методы синтеза спиртов
Закрепление пройденного материала
Выполнение реакций
Кроссворд
Задание на дом
Список используемой литературы
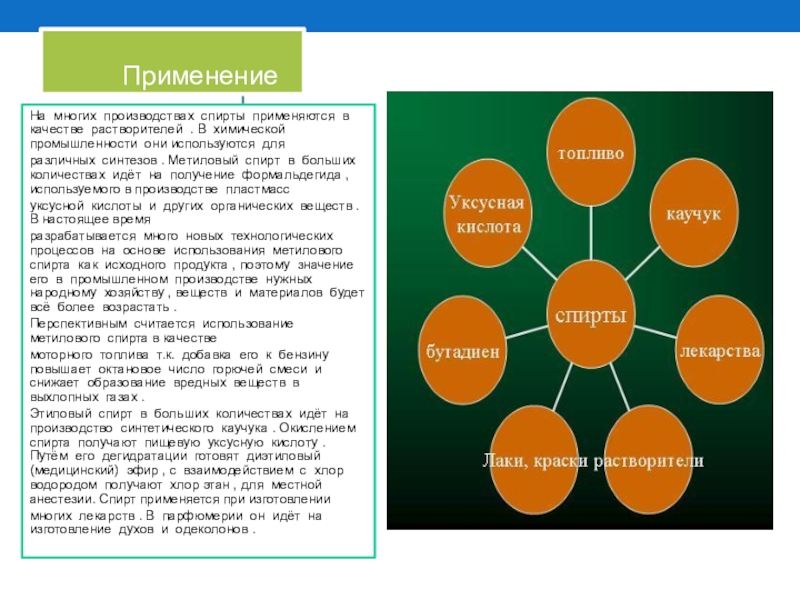
Слайд 5 Применение
На многих производствах спирты применяются
различных синтезов . Метиловый спирт в больших количествах идёт на получение формальдегида , используемого в производстве пластмасс
уксусной кислоты и других органических веществ . В настоящее время
разрабатывается много новых технологических процессов на основе использования метилового спирта как исходного продукта , поэтому значение его в промышленном производстве нужных народному хозяйству , веществ и материалов будет всё более возрастать .
Перспективным считается использование метилового спирта в качестве
моторного топлива т.к. добавка его к бензину повышает октановое число горючей смеси и снижает образование вредных веществ в выхлопных газах .
Этиловый спирт в больших количествах идёт на производство синтетического каучука . Окислением спирта получают пищевую уксусную кислоту . Путём его дегидратации готовят диэтиловый (медицинский) эфир , с взаимодействием с хлор водородом получают хлор этан , для местной анестезии. Спирт применяется при изготовлении
многих лекарств . В парфюмерии он идёт на изготовление духов и одеколонов .
Слайд 6Применение спиртов в качестве топлива
Для топливных целей в настоящий момент используются
Слайд 7Растворители
Среди растворителей широкое распространение имеют самые разные классы спиртов: одноатомные и
Самым распространённым спиртом среди растворителей является этанол — его мировой объём потребления в этом качестве превышает 3,5 млн тонн в год. Другими популярными растворителями являются метанол и изопропанол с объёмами потребления более 1 млн тонн в год.
Слайд 8 Медицина
Основным спиртом, используемых в в медицинских целях, является этанол. Его используют в качестве наружного антисептического и раздражающего средства для приготовления компрессов и обтираний. Ещё более широко применяется этиловый спирт для приготовления различных настоек, разведений, экстрактов и прочих лекарственных форм. Применение спиртов в качестве собственно лекарственных средств не столь заметно, однако в перечне 10 наиболее важных рецептурных препаратов США в 2000 году 6-ю строчку занимает альбутерол, который можно отнести к рассматриваемому классу.
Слайд 9В настоящее время трудно найти область практической деятельности человека, где бы
ингибиторы коррозии металлов;
пенообразователи для флотореагентов;
компоненты автокосметики;
исходные продукты для получения взрывчатых веществ, а также их компоненты.
исходные продукты для получения отравляющих веществ, а также компоненты для их дегазации
Слайд 11Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько
Слайд 12Классификация карбоновых кислот
По числу карбоксильных
групп
непредельные
ароматические
одноосновные
двухосновные
многоосновные
предельные
По типу углеводородного
радикала
Слайд 15 Физические свойства
Низшие карбоновые кислоты — жидкости с острым запахом, хорошо растворимые в
Слайд 16 Характерные химические реакции
Наиболее важные химические свойства, характерные для большинства карбоновых кислот:
1)
Также карбоновые кислоты могут вытеснять более слабую кислоту из её соли, например:
(потом разлагается на углекислый газ и воду)
2) Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации):
CH3COOH + СН3СН2ОН = CH3COOCH2СН3 + H2O
3) При нагревании аммонийных солей карбоновых кислот образуются их амиды:
4) Под действием карбоновые кислоты превращаются в соответствующие хлорангидриды.
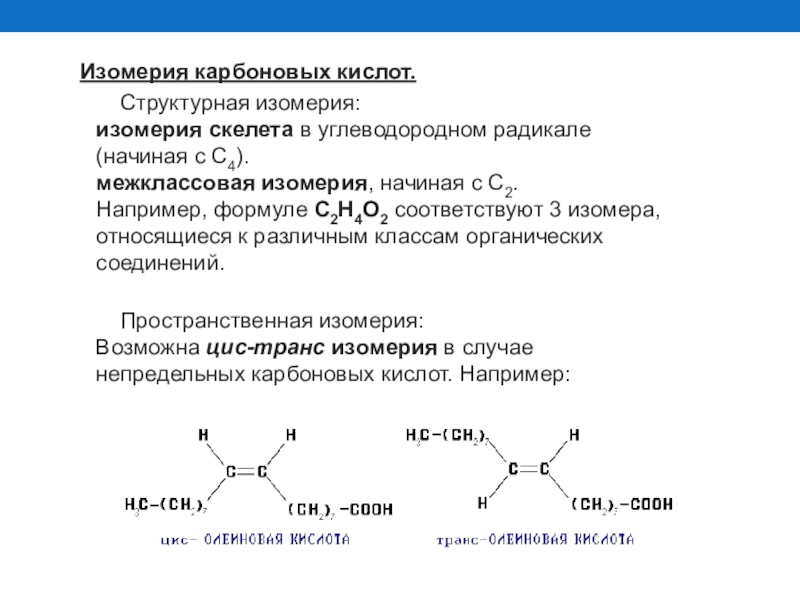
Слайд 17Изомерия карбоновых кислот.
Cтруктурная изомерия:
изомерия скелета в углеводородном радикале (начиная с C4).
Пространственная изомерия: Возможна цис-транс изомерия в случае непредельных карбоновых кислот. Например:
Слайд 19Номенклатура и изомерия
Название карбоновой кислоты образуется от названия соответствующего алкана с
Количество карбоксильных групп указывается в названии префиксами ди-, три-, тетра-:
Многие кислоты имеют исторически сложившиеся, или тривиальные, названия.
Слайд 20Применение
Муравьиная кислота обладает дезинфицирующим свойством и поэтому находит свое применение в
Слайд 21Уксусная кислота – хороший растворитель многих органических веществ. Используется при крашении,
используемые для борьбы с
сорняками, - гербициды.
Уксусная кислота является
основным компонентом
винного уксуса.
Слайд 23 Органическая химия теснейшим образом связана с медициной. Огромное количество разнообразных лекарственных
Химики - органики в содружестве с медиками, микробиологами и фармацевтами смогли не только установить строение многих природных соединений, используемых в медицине, но и синтезировать некоторые из них. Наряду с этим химики пошли по пути создания соединений, хотя и отличающихся от природных, но обладающих аналогичным, а часто и более эффективным действием. Более того, были получены новые лекарственные средства, которые не знает природа, но способные излечивать многие болезни.
Слайд 24В большинстве своем лекарственные препараты редко бывают простыми веществами. Чаще это
И хотя число лекарственных препаратов огромно, мы ограничимся рассказом только о нескольких самых известных и часто применяемых лекарствах
Слайд 25
Ацетилсалициловая кислота или аспирин хорошо известный всем, применяется как противоревматическое, жаропонижающее
Аспирин впервые синтезировал немецкий химик Ш. Герхард в 1853г. путем ацетилирования салициловой кислоты уксусным ангидридом.
Слайд 26Анилин ( фениламин) – C 6 H 5 – NH 2 яд, но из него синтезируют сульфамидные
Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом
Слайд 27
Глицери́н (пропан-1,2,3-триол) — простейший представитель трёхатомных спиртов. Представляет собой вязкую прозрачную жидкость.
В
Слайд 28Широко применяется глицерин в фармакологический промышленности. Он растворяет лекарства, применяется для
Слайд 29Салициловая кислота (от лат. salix «ива», из коры которой она была впервые выделена) — 2-гидроксибензойная или
Выделена из ивовой коры итальянским химиком Рафаэлем Пириа и затем синтезирована им же.
Слайд 30Салициловая кислота — активный компонент ивовой коры. Ещё в XIX в. её использовали
Салициловая кислота обладает слабыми антисептическими, раздражающими и кератолитическими (в больших концентрациях) свойствами и применяется в медицине наружно в мазях и растворах при лечении кожных заболеваний; входит в состав пасты Лассара, присыпки «гальманин», препаратов «мозольная жидкость» и «мозольный пластырь».
Слайд 31Диэтиловый эфир (этиловый эфир, серный эфир). Возможно, что впервые диэтиловый эфир был
Слайд 32Диэтиловый эфир в медицине используется в качестве лекарственного средства общеанестезирующего действия, так
Слайд 33Современная медицина знает способы лечения многих болезней, но такие заболевания, как
Желаю вам как можно меньше употреблять лекарства и не болеть.
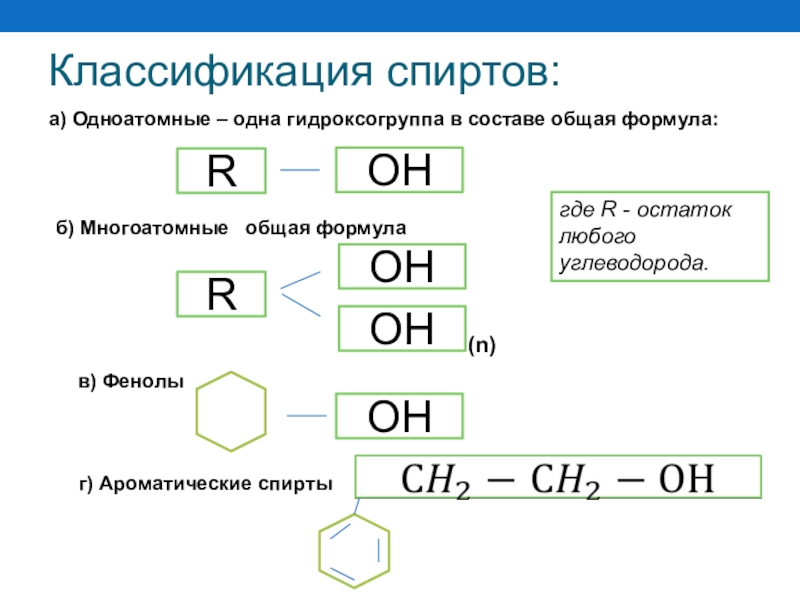
Слайд 35Классификация спиртов:
в) Фенолы
а) Одноатомные – одна гидроксогруппа в составе общая
где R - остаток любого углеводорода.
R
OH
б) Многоатомные общая формула
R
OH
OH
(n)
г) Ароматические спирты
OH
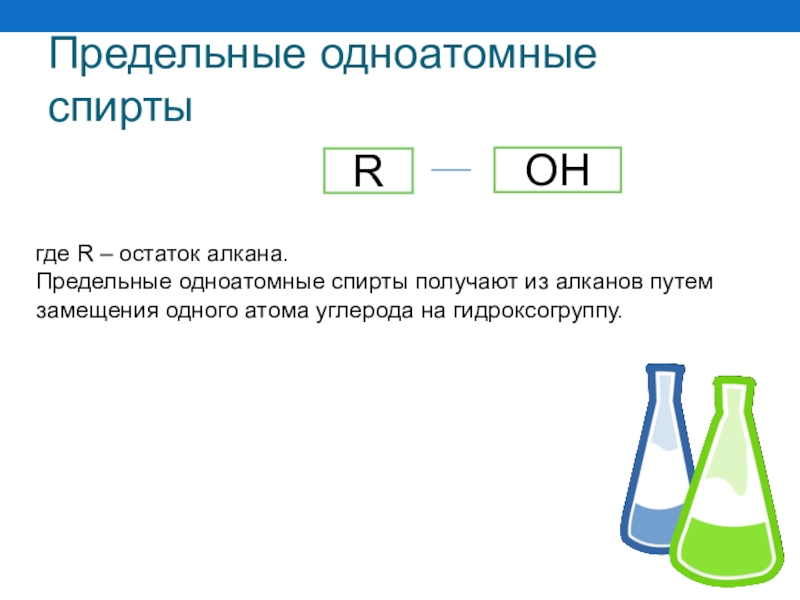
Слайд 36Предельные одноатомные спирты
где R – остаток алкана.
Предельные одноатомные спирты получают из
R
OH
Слайд 38Особенности свойств спиртов:
:Начиная с первого представителя, все спирты-жидкости, а начиная с
До 4го – хорошо растворимы в воде, дальше растворимость спиртов в воде ухудшается. За счет водородных связей и межмолекулярного взаимодействия молекулы спирта начиная с первых представителей- жидкости.
Чем длиннее молекула спирта (длина R), тем хуже растворимость спирта в воде за счёт углеводородного радикала.
Все спирты горючие.
Чем длиннее R – спирта, тем больше копоти образуется при горении (о чем это говорит?) горит красный коптящим пламенем, а первые 3 – бесцветным или слегка голубоватым.
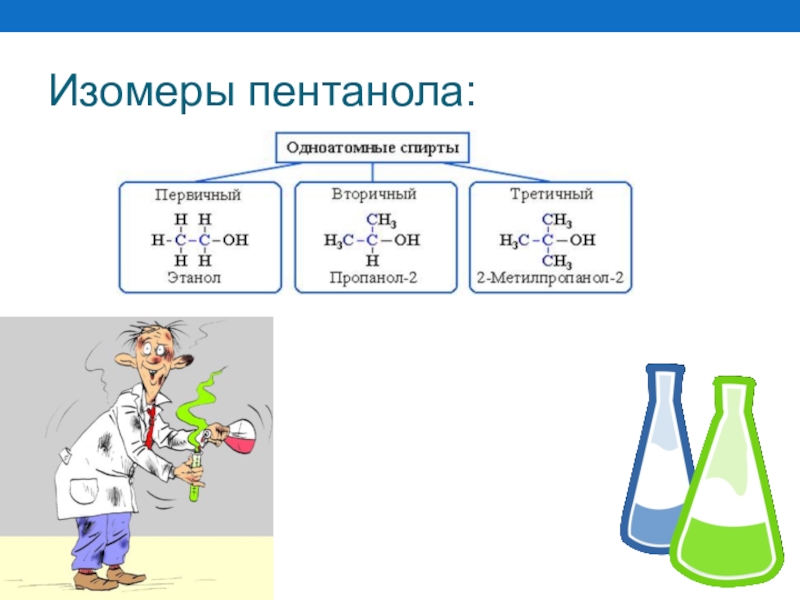
Слайд 39Изомерия и номенклатура
Название спиртов образуется от соответствующего алкана по количеству атомов
Пример:
ЭТАН
Н
Н
Н
ОН
ОЛ
Слайд 43Б) Реакция окисления проводится окислительной смесью
спирты ведут себя, как
2СН3ОН+2NA → 2СН3ОNa + Н2
A) Реакции с активными Ме
смесь пермангагата калия и серной кислоты
С2 Н5 ОН(СН3-СН2-ОН) - этанол
С2 Н5 ОН + [О] + Н2 О → СН3 – С
О
H
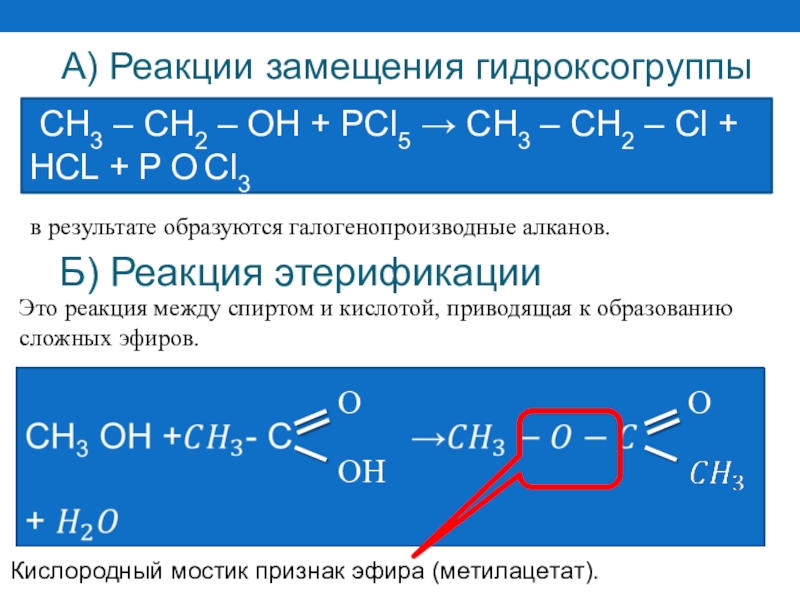
Слайд 44Б) Реакция этерификации
в результате образуются галогенопроизводные алканов.
СН3 – СН2
A) Реакции замещения гидроксогруппы
Кислородный мостик признак эфира (метилацетат).
О
H
Это реакция между спиртом и кислотой, приводящая к образованию сложных эфиров.
О
OH
О
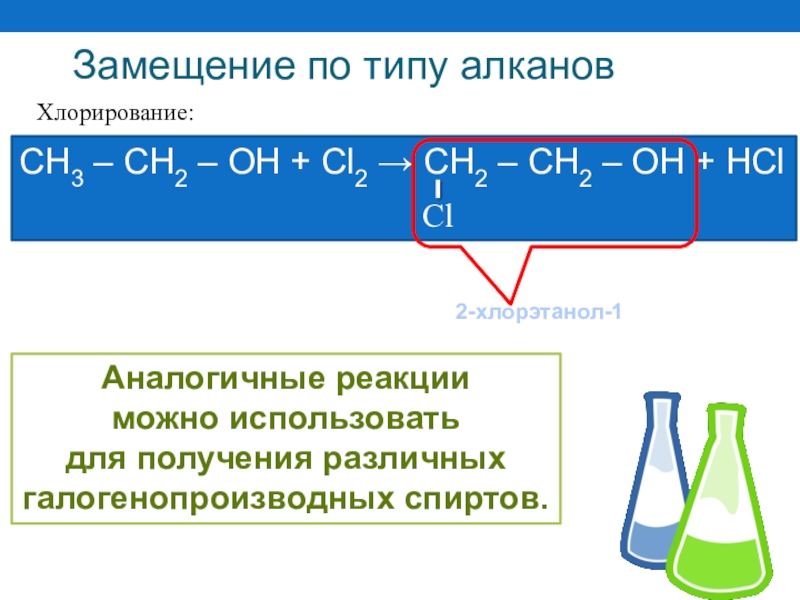
Слайд 46 Хлорирование:
СН3 – СН2 – ОН + Cl2 → СН2 –
Замещение по типу алканов
О
Cl
2-хлорэтанол-1
Аналогичные реакции
можно использовать
для получения различных
галогенопроизводных спиртов.
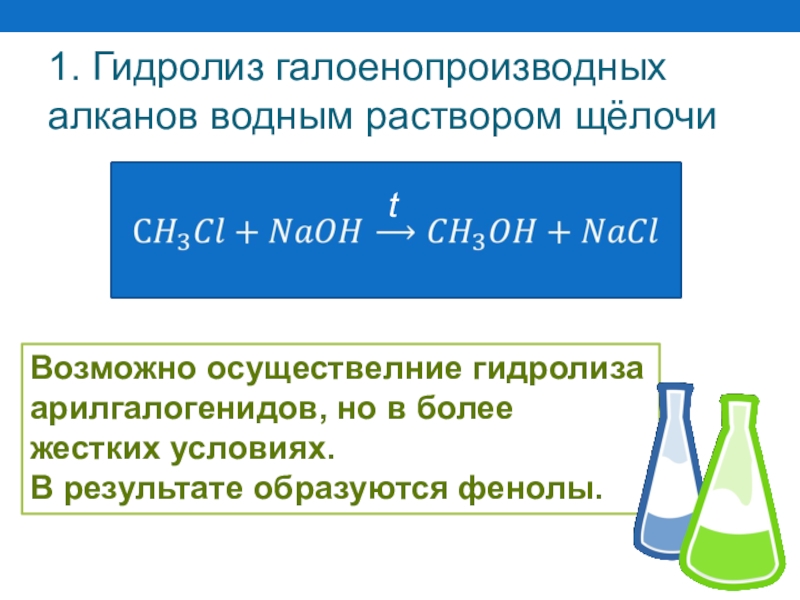
Слайд 481. Гидролиз галоенопроизводных алканов водным раствором щёлочи
t
Возможно осуществелние гидролиза
арилгалогенидов, но в
жестких условиях.
В результате образуются фенолы.
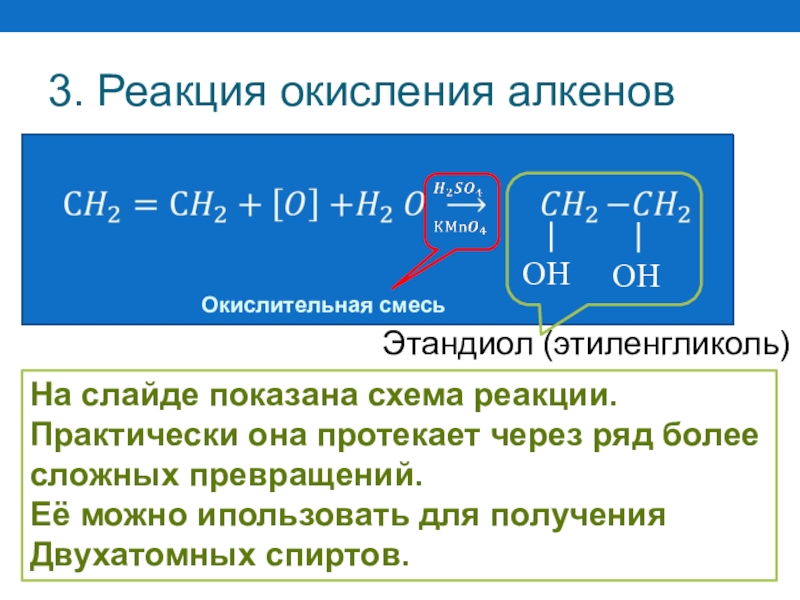
Слайд 503. Реакция окисления алкенов
На слайде показана схема реакции.
Практически она протекает через
сложных превращений.
Её можно ипользовать для получения
Двухатомных спиртов.
Окислительная смесь
OH
OH
Этандиол (этиленгликоль)
Слайд 57Вопросы:
Шестой представитель алканов.
Образование сложных эфиров называется реакцией … ?
Третий член гомологического
Спирт с полностью замещенным атомом водорода.
Русское название пентанола.
Спирт, образованный от нонана.
Обеспечивание перманганата калия происходит в реакциях … ?
. Неразветвленная структура называется … .
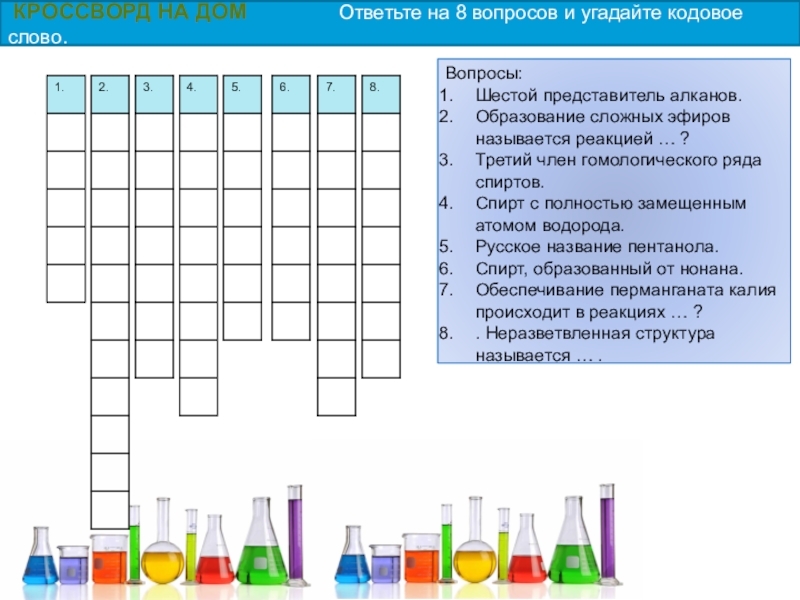
КРОССВОРД НА ДОМ Ответьте на 8 вопросов и угадайте кодовое слово.
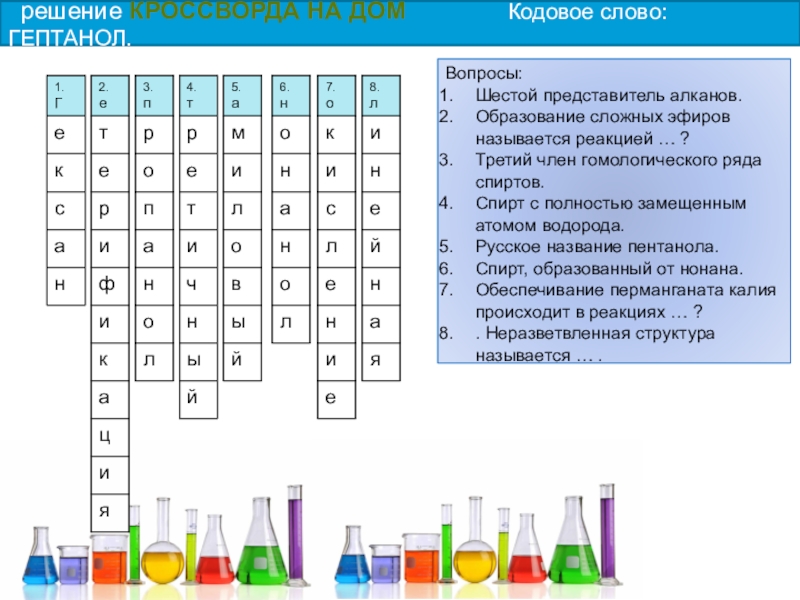
Слайд 58Вопросы:
Шестой представитель алканов.
Образование сложных эфиров называется реакцией … ?
Третий член гомологического
Спирт с полностью замещенным атомом водорода.
Русское название пентанола.
Спирт, образованный от нонана.
Обеспечивание перманганата калия происходит в реакциях … ?
. Неразветвленная структура называется … .
решение КРОССВОРДА НА ДОМ Кодовое слово: ГЕПТАНОЛ.