раствор или расплав электролита электрического тока.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Электролиз. Химические аспекты. Идем на урок в спецкласс
Содержание
- 1. Электролиз. Химические аспекты. Идем на урок в спецкласс
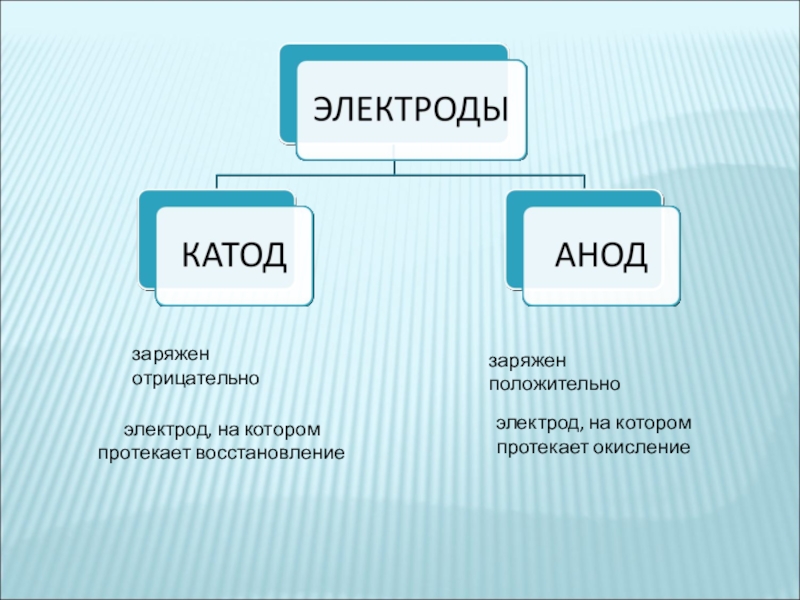
- 2. электрод, на котором протекает восстановлениеэлектрод, на котором протекает окислениезаряжен отрицательнозаряжен положительно
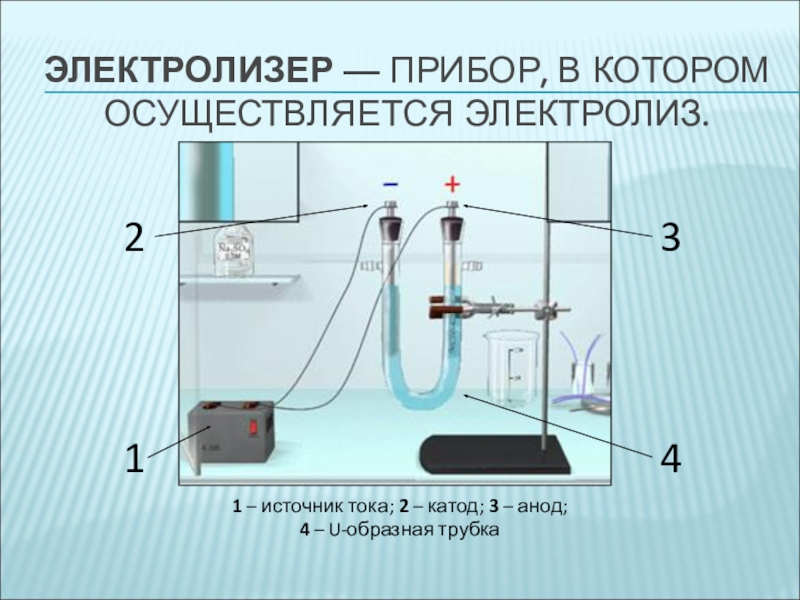
- 3. ЭЛЕКТРОЛИЗЕР — ПРИБОР, В КОТОРОМ ОСУЩЕСТВЛЯЕТСЯ ЭЛЕКТРОЛИЗ.12341
- 4. ЭЛЕКТРОЛИЗ РАСПЛАВОВ
- 5. ЭЛЕКТРОЛИЗ РАСТВОРОВ СОЛЕЙ
- 6. ПРОЦЕССЫ, ПРОИСХОДЯЩИЕ НА КАТОДЕ ПРИ ЭЛЕКТРОЛИЗЕ ВОДНЫХ
- 7. ПРОЦЕССЫ, ПРОИСХОДЯЩИЕ НА КАТОДЕ ПРИ ЭЛЕКТРОЛИЗЕ ВОДНЫХ
- 8. ПРОЦЕССЫ, ПРОИСХОДЯЩИЕ НА КАТОДЕ ПРИ ЭЛЕКТРОЛИЗЕ ВОДНЫХ
- 9. ПРОЦЕССЫ, ПРОИСХОДЯЩИЕ НА АНОДЕ ПРИ ЭЛЕКТРОЛИЗЕ ВОДНЫХ
- 10. НА КАТОДЕ ВОССТАНАВЛИВАЮТСЯ ИОНЫ МЕТАЛЛА, НА АНОДЕ
- 11. НА КАТОДЕ ВОССТАНАВЛИВАЮТСЯ МОЛЕКУЛЫ ВОДЫ, НА АНОДЕ
- 12. НА КАТОДЕ ВОССТАНАВЛИВАЮТСЯ КАТИОНЫ МЕТАЛЛА, НА АНОДЕ
- 13. НА КАТОДЕ ВОССТАНАВЛИВАЮТСЯ МОЛЕКУЛЫ ВОДЫ, НА АНОДЕ
- 14. РАЗЛИЧАЮТ ЭЛЕКТРОЛИЗ С ИНЕРТНЫМ И ЭЛЕКТРОЛИЗ С
- 15. РАССМОТРИМ СЛУЧАЙ ЭЛЕКТРОЛИЗА С АКТИВНЫМ АНОДОМ. ЭЛЕКТРОЛИЗ
- 16. ИСПОЛЬЗОВАНИЕ РЕГИОНАЛЬНОГО КОМПОНЕНТА НА УРОКЕ ПО ДАННОЙ
- 17. ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗАЭлектролиз расплавов и растворов веществ
электрод, на котором протекает восстановлениеэлектрод, на котором протекает окислениезаряжен отрицательнозаряжен положительно
Слайд 1ЭЛЕКТРОЛИЗ
Электролиз — это окислительно-восстановительные реакции, протекающие на электродах, при пропускании через
Слайд 2электрод, на котором протекает восстановление
электрод, на котором протекает окисление
заряжен отрицательно
заряжен положительно
Слайд 3ЭЛЕКТРОЛИЗЕР — ПРИБОР, В КОТОРОМ ОСУЩЕСТВЛЯЕТСЯ ЭЛЕКТРОЛИЗ.
1
2
3
4
1 – источник тока; 2
– катод; 3 – анод;
4 – U-образная трубка
4 – U-образная трубка
Слайд 6ПРОЦЕССЫ, ПРОИСХОДЯЩИЕ НА КАТОДЕ ПРИ ЭЛЕКТРОЛИЗЕ ВОДНЫХ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Катионы металлов, имеющих
стандартные электродные потенциалы меньшие, чем у алюминия (расположенные в электрохимическом ряду напряжения металлов до Аl) не разряжаются на катоде. В этом случае происходит только восстановление воды:
2Н2О + 2е → Н2↑ + 2ОН¯
2Н2О + 2е → Н2↑ + 2ОН¯
Слайд 7ПРОЦЕССЫ, ПРОИСХОДЯЩИЕ НА КАТОДЕ ПРИ ЭЛЕКТРОЛИЗЕ ВОДНЫХ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Катионы металлов, имеющих
стандартные электродные потенциалы меньшие, чем у водорода, но большие, чем у алюминия (расположены в электрохимическом ряду напряжений металлов от Аl до Н2) разряжаются одновременно с молекулами воды. Одновременно происходят процессы:
Меn+ + nе → Ме° и
2Н2О + 2е → Н2↑+ 2ОН¯
Меn+ + nе → Ме° и
2Н2О + 2е → Н2↑+ 2ОН¯
Слайд 8ПРОЦЕССЫ, ПРОИСХОДЯЩИЕ НА КАТОДЕ ПРИ ЭЛЕКТРОЛИЗЕ ВОДНЫХ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
При наличии в
растворе катионов металлов, имеющих стандартные электродные потенциалы большие, чем стандартный электродный потенциал водорода, на катоде прежде всего происходит восстановление катионов таких металлов:
Меn+ + nе → Ме°
Меn+ + nе → Ме°
Слайд 9ПРОЦЕССЫ, ПРОИСХОДЯЩИЕ НА АНОДЕ ПРИ ЭЛЕКТРОЛИЗЕ ВОДНЫХ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
При электролизе водных
растворов щелочей, кислородсодержащих кислот и их солей, а также фтороводорода и фторидов происходит электрохимическое окисление воды с выделением кислорода. В зависимости от среды, этот процесс может протекать по-разному:
а) в щелочной среде:
4ОН¯ – 4е → О2↑ + 2Н2О
б) в кислой или нейтральной среде:
2Н2О – 4е → О2 ↑ + 4Н+
При электролизе водных растворов бескислородных кислот и их солей (кроме HF и фторидов) у анода разряжаются анионы.
а) в щелочной среде:
4ОН¯ – 4е → О2↑ + 2Н2О
б) в кислой или нейтральной среде:
2Н2О – 4е → О2 ↑ + 4Н+
При электролизе водных растворов бескислородных кислот и их солей (кроме HF и фторидов) у анода разряжаются анионы.
Слайд 10НА КАТОДЕ ВОССТАНАВЛИВАЮТСЯ ИОНЫ МЕТАЛЛА, НА АНОДЕ ОКИСЛЯЮТСЯ АНИОНЫ КИСЛОТНОГО ОСТАТКА
СuСI2,
р-р
СuСI2 → Сu2+ + 2Сl¯ (ЭД)
Катод: Сu2+, Н2O
Сu2+ + 2е → Сu° (восстановление)
Анод: Сl¯, Н2O
2Сl¯ – 2е → СI2 (окисление)
Сu2+ + 2Сl¯ → Сu° + Cl2 ° ↑
CuCl2 → Cu + Cl2
СuСI2 → Сu2+ + 2Сl¯ (ЭД)
Катод: Сu2+, Н2O
Сu2+ + 2е → Сu° (восстановление)
Анод: Сl¯, Н2O
2Сl¯ – 2е → СI2 (окисление)
Сu2+ + 2Сl¯ → Сu° + Cl2 ° ↑
CuCl2 → Cu + Cl2
Слайд 11НА КАТОДЕ ВОССТАНАВЛИВАЮТСЯ МОЛЕКУЛЫ ВОДЫ, НА АНОДЕ ОКИСЛЯЮТСЯ АНИОНЫ КИСЛОТНОГО ОСТАТКА
KI,
р-р
KI → K+ + l¯ (ЭД)
Катод: K+, H2O
2Н2O + 2е → 2OH¯ + H2° (восстановление)
Анод: l¯, Н2O
2l¯ – 2е → I2° (окисление)
2Н2O + 2l¯ → 2OН¯ + H2º + I2º
2Н2O + 2Kl → 2KOH + H2º↑ + I2°↑
KI → K+ + l¯ (ЭД)
Катод: K+, H2O
2Н2O + 2е → 2OH¯ + H2° (восстановление)
Анод: l¯, Н2O
2l¯ – 2е → I2° (окисление)
2Н2O + 2l¯ → 2OН¯ + H2º + I2º
2Н2O + 2Kl → 2KOH + H2º↑ + I2°↑
Слайд 12НА КАТОДЕ ВОССТАНАВЛИВАЮТСЯ КАТИОНЫ МЕТАЛЛА, НА АНОДЕ ОКИСЛЯЮТСЯ МОЛЕКУЛЫ ВОДЫ
CuSO4, р-р
CuSO4
→ Cu2+ + SO42¯ (ЭД)
Катод: Cu2+, H2O
Cu2+ + 2е → Сuº (восстановление) 2
Анод: SO42¯, H2O
2Н2O – 4е → O2° + 4Н+ (окисление) 1
2Сu2+ + 2Н2O → 2Cu° + O2° ↑ + 4Н+
2CuSO4 + 2Н2O → 2Сu° + O2° ↑ + 2H2SO4
Катод: Cu2+, H2O
Cu2+ + 2е → Сuº (восстановление) 2
Анод: SO42¯, H2O
2Н2O – 4е → O2° + 4Н+ (окисление) 1
2Сu2+ + 2Н2O → 2Cu° + O2° ↑ + 4Н+
2CuSO4 + 2Н2O → 2Сu° + O2° ↑ + 2H2SO4
Слайд 13НА КАТОДЕ ВОССТАНАВЛИВАЮТСЯ МОЛЕКУЛЫ ВОДЫ, НА АНОДЕ ОКИСЛЯЮТСЯ МОЛЕКУЛЫ ВОДЫ
Na2SO4, p-p
Na2SO4
→ 2Na+ + SO42¯ (ЭД)
Катод: Na+, H2O
2H2O + 2е → 20H¯ + H2° (восстановление) 2
Анод: SO42¯, H2O
2H2O – 4е → O2° + 4H+ (окисление) 1
4H2O + 2H2O → 40H¯ + 2H2° + O2° + 4H+
2Н2О → 2H2° ↑ + O2° ↑
Катод: Na+, H2O
2H2O + 2е → 20H¯ + H2° (восстановление) 2
Анод: SO42¯, H2O
2H2O – 4е → O2° + 4H+ (окисление) 1
4H2O + 2H2O → 40H¯ + 2H2° + O2° + 4H+
2Н2О → 2H2° ↑ + O2° ↑
Слайд 14РАЗЛИЧАЮТ ЭЛЕКТРОЛИЗ С ИНЕРТНЫМ И ЭЛЕКТРОЛИЗ С АКТИВНЫМ АНОДОМ
Инертный анод —
анод, материал которого не окисляется в ходе электролиза (например, электрод из платины).
Активный анод — анод, материал которого может окисляться в ходе электролиза
Активный анод — анод, материал которого может окисляться в ходе электролиза
Слайд 15РАССМОТРИМ СЛУЧАЙ ЭЛЕКТРОЛИЗА С АКТИВНЫМ АНОДОМ. ЭЛЕКТРОЛИЗ РАСТВОРА NISO4 С НИКЕЛЕВЫМ
АНОДОМ
NiSO4, р-р
NiSO4 → Ni2+ + SO42¯ (ЭД)
Катод: Ni2+, H2O
Ni2+ + 2е → Ni° (восстановление) 2
Анод: Ni; SO42¯, H2O
Ni° – 2е → Ni2+ (окисление) 1
Этот процесс применяется для электролитической очистки никеля (так называемое электролитическое рафинирование)
Слайд 16ИСПОЛЬЗОВАНИЕ РЕГИОНАЛЬНОГО КОМПОНЕНТА НА УРОКЕ ПО ДАННОЙ ТЕМЕ. У ТРОИЦКОЙ ОРГАНИЗАЦИИ МУП
«ВОДОКАНАЛ» ПОЯВИЛОСЬ НОВОЕ ОБОРУДОВАНИЕ, ПОЗВОЛЯЮЩЕЕ ПОЛУЧАТЬ ХЛОР В НЕОБХОДИМЫХ КОНЦЕНТРАЦИЯХ ДЛЯ ОБЕЗЗАРАЖИВАНИЯ ВОДЫ НА ВОДООЧИСТНОЙ СТАНЦИИ. В ОСНОВЕ РАБОТЫ ДАННОЙ УСТАНОВКИ ЛЕЖИТ ПРОЦЕСС ЭЛЕКТРОЛИЗА РАСТВОРА ПОВАРЕННОЙ СОЛИ. ПРЕИМУЩЕСТВО ДАННОГО СПОСОБА ПОЛУЧЕНИЯ ХЛОРА ЗАКЛЮЧАЕТСЯ В ТОМ, ЧТО ВЫДЕЛЯЮЩИЙСЯ НА АНОДЕ ГАЗ СОВЕРШЕННО НЕ ПРЕДСТАВЛЯЕТ ОПАСНОСТЬ ДЛЯ ЖИЗНИ ОБСЛУЖИВАЮЩЕГО ПЕРСОНАЛА. РАНЬШЕ, КОГДА ХЛОР ХРАНИЛСЯ В БАЛЛОНАХ, ЧАСТО ВОЗНИКАЛИ УТЕЧКИ ЯДОВИТОГО ВЕЩЕСТВА. ПОЭТОМУ ДАННАЯ СТАНЦИЯ ЯВЛЯЛАСЬ ПОТЕНЦИАЛЬНО ОПАСНЫМ ОБЪЕКТОМ. СЕЙЧАС ЭТА ПРОБЛЕМА РЕШЕНА.
Слайд 17ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗА
Электролиз расплавов и растворов веществ широко используются в промышленности:
1.
Для получения металлов (алюминий, магний, натрий, кадмий получают только электролизом).
2. Для получения водорода, галогенов, щелочей.
3. Для очистки металлов – рафинирования (очистку меди, никеля, свинца проводят элекитрохимическим методом).
4. Для защиты металлов от коррозии – нанесение защитных покрытий в виде тонкого слоя другого металла, устойчивого к коррозии (хрома, никеля, меди, серебра, золота) – гальваностегия.
5. Получение металлических копий, пластинок – гальванопластика.
2. Для получения водорода, галогенов, щелочей.
3. Для очистки металлов – рафинирования (очистку меди, никеля, свинца проводят элекитрохимическим методом).
4. Для защиты металлов от коррозии – нанесение защитных покрытий в виде тонкого слоя другого металла, устойчивого к коррозии (хрома, никеля, меди, серебра, золота) – гальваностегия.
5. Получение металлических копий, пластинок – гальванопластика.