- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Экспериментальное решение задач ЕГЭ (презентация)
Содержание
- 1. Экспериментальное решение задач ЕГЭ (презентация)
- 2. Тема: Роль химического эксперимента в усвоении знаний при подготовке к ЕГЭ.
- 3. «Химия никоим образом научиться невозможно, не видав
- 4. Введение. При выполнении тестовых заданий мы часто
- 5. Наблюдение гидролиза солей вступает в
- 6. Актуальность темы: При изучении химии важную
- 7. Цель нашей работы: Разработать и провести
- 8. Задачи: 1. Выполнить опыты по разделам:
- 9. Методика исследования: 1. Экспериментальный метод 2. Анализ полученных результатов, составление уравнений химических реакций, выявление общих закономерностей.
- 10. Межмолекулярные реакции с участием наиболее распространенных окислителей.
- 11. Слайд 11
- 12. Окислительные свойства дихромата калия K2Cr2O7+7H2SO4+6KJ=
- 13. Слайд 13
- 14. Окислительные свойства азотной кислоты (в вытяжном шкафу)
- 15. Слайд 15
- 16. Слайд 16
- 17. Внутримолекулярная реакция разложения бихромата аммония Сухую соль
- 18. Слайд 18
- 19. Слайд 19
- 20. Определение ионов Fe+2, Fe+3. К раствору хлорида
- 21. FeCl3+3KCNS= Fe(CNS)3+3KCl Ионы железа (III) проверяем желтой кровяной солью: FeCl3+K4[Fe(CN)6]= KFe[Fe(CN)6] ↓+3KCl Берлинская лазурь
- 22. Слайд 22
- 23. Обнаружение белков. в пробирку налили 1 мл
- 24. Слайд 24
- 25. Обнаружение углеводов. Полученный раствор нагрели на спиртовке.
- 26. Слайд 26
- 27. Слайд 27
- 28. Фараоновы змеи Взвесили 5 грамм нитрата калия,10
- 29. Слайд 29
- 30. Слайд 30
- 31. Получение бромной и йодной воды (в вытяжном
- 32. Слайд 32
- 33. Заключение1. Задания ЕГЭ многочисленны и многоплановы; В
Тема: Роль химического эксперимента в усвоении знаний при подготовке к ЕГЭ.
Слайд 1Исследовательская работа
по химии
Учениц 11 Б класса:
Хусаиновой Л.И.
Ялмурзиной И.М.
Учитель химии:
Гареева Р.А.
Слайд 3«Химия никоим образом научиться невозможно, не видав самой практики не принимаясь
за химические операции» - М.В. Ломоносов
Слайд 4Введение. При выполнении тестовых заданий мы часто сталкиваемся с противоречиями, для разрешения
которых требуются не только имеющиеся знания, но и новые.
Трудным для понимания остается вопрос о свойствах амфотерных соединений. Ученики хорошо понимают, что все основания взаимодействуют с кислотами. Опыт взаимодействия гидроксида алюминия с гидроксидом натрия вызывает недоумение, так как в реакцию вступает нерастворимое и растворимое основания
Al(OH) 3 +KOH = K[AL(OH) 4]
NH4Cl +NaOH = NH3 ↑ + NaCl+H2O
Слайд 5 Наблюдение гидролиза солей вступает в противоречие с имеющимися знаниями, ведь вода
в представлении учащихся растворитель, а растворение физическое явление. Редко кто из одиннадцатиклассников не имеет пробелов и недостатков в химических знаниях. Исправить эти ошибки и восполнить пробелы в знаниях возможно на основе специально подобранных и разработанных химических опытов, которые позволяют обогатить содержание школьного курса исследовательскими формами организации учебной деятельности.
Слайд 6Актуальность темы: При изучении химии важную роль играет химический эксперимент -
составная часть учебного процесса. Каждое научное понятие должно обосновываться практически. Так как, познание начинается с восприятия конкретных предметов, явлений, процессов, фактов и переходит к затеям, обобщению и абстрагированию. Химическое понятие – это обобщенные знания о признаках химических явлений и процессов, которые формулируются на основе их восприятия. Химический эксперимент помогает обучающимся наполнить усваиваемые ими химические понятия живым, конкретным содержанием, увидеть в отдельных фактах общие закономерности.
Слайд 7Цель нашей работы: Разработать и провести химический эксперимент по отдельным разделам
химии с целью успешной подготовки к сдаче ЕГЭ.
Слайд 8Задачи: 1. Выполнить опыты по разделам: неорганическая и органическая химия классификация
неорганических веществ и их химические свойства:
- Строение и свойства органических соединений различных классов;
- Химическая реакция;
- Поведение веществ в растворах;
- Электролиз растворов и расплавов;
- Методы познания веществ и химических реакций.
2. Проанализировать на основе химического эксперимента:
- условия протекания реакций;
- сущность химических процессов, взаимосвязь состава, строения и свойств веществ, взаимного влияния атомов в молекуле;
- классификацию изученных веществ и реакций.
Слайд 9Методика исследования:
1. Экспериментальный метод
2. Анализ полученных результатов, составление уравнений химических реакций,
выявление общих закономерностей.
Слайд 10Межмолекулярные реакции с участием наиболее распространенных окислителей. Окислительные свойства перманганата калия
В кислой среде: 2KMnO4 + 5K2SO3 + 3H2SO4 → 6K2SO4 + 2MnSO4 + 3H2O; В щелочной среде: 2KMnO4 + K2SO3 + 2KOH → K2SO4 + 2K2MnO4 + H20;
В нейтральной среде: 2KMnO4 + 3K2SO3 + H2O → 3K2SO4 + 2MnO2 + 2KOH;
Слайд 12 Окислительные свойства дихромата калия K2Cr2O7+7H2SO4+6KJ= Cr2(SO4)3+3J2+4K2SO4+7H2O В коническую колбу внесли 3 капли дихромата
калия и 3 капли разбавленной серной кислоты. Затем добавили 1-2 капли раствора йодида калия. Цвет раствора меняется, 5-6 капель крахмального клейстера окрашивается йодом в синий цвет.
Слайд 14Окислительные свойства азотной кислоты (в вытяжном шкафу)
Концентрированный раствор:
Cu+ 4HNO3= Cu (NO3)2
+2NO2+2H2O
Разбавленный раствор : Cu +8HNO3= 3Cu (NO3)2 +2NO+4H2O
Разбавленный раствор : Cu +8HNO3= 3Cu (NO3)2 +2NO+4H2O
Слайд 17Внутримолекулярная реакция разложения бихромата аммония
Сухую соль поместили в фарфоровую чашку и
нагревали, соль оранжевого цвета стала зеленой, так как образовался оксид хрома (III)
(NH4)2Cr2O7= Cr2O3+N2+4H2O
Слайд 20Определение ионов Fe+2, Fe+3. К раствору хлорида железа (II) по каплям приливаем
красную кровяную соль. При взаимодействии выпадает темно-синий осадок турнбулевой сини:
FeCl2+K[Fe(CN)6]= KFe[Fe(CN)6]↓+2KCl
К раствору хлорида железа (III) прилили несколько капель раствора роданида калия, наблюдаем кроваво-красное окрашивание.
Слайд 21FeCl3+3KCNS= Fe(CNS)3+3KCl
Ионы железа (III) проверяем желтой кровяной солью:
FeCl3+K4[Fe(CN)6]= KFe[Fe(CN)6] ↓+3KCl
Берлинская лазурь
Слайд 23Обнаружение белков. в пробирку налили 1 мл растаявшего молочного мороженого и добавили
5-7 мл дистиллированной воды. Пробирку закрываем пробкой и встряхиваем. К 1 мл 5-10% раствора NaOH и несколько капель 10% раствора CuSO4. происходит биуретовая реакция – появляется ярко-фиолетовая окрашивание, связанное с взаимодействием пептидных связей белковых молекул со свежеприготовленным Cu (OH)2
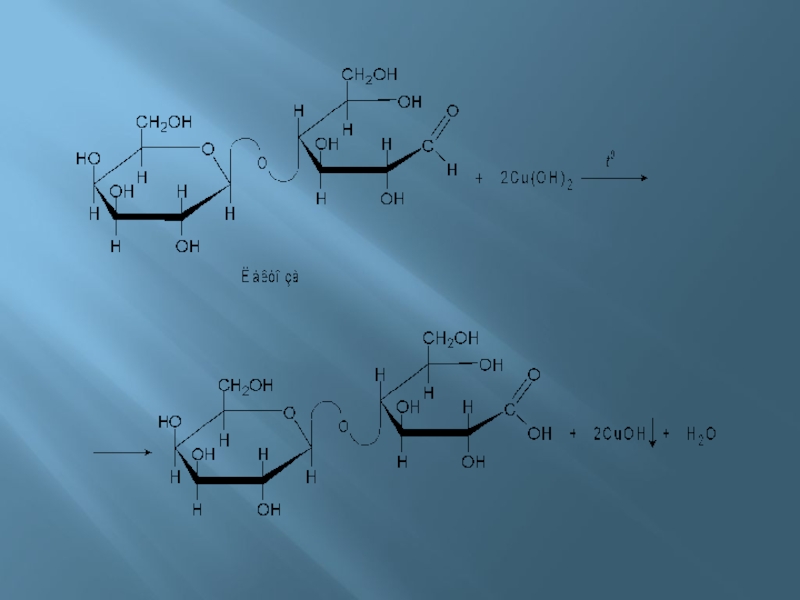
Слайд 25Обнаружение углеводов. Полученный раствор нагрели на спиртовке. Лактоза, находясь в нециклической (альдегидной)
форме реагирует с Cu(OH)2. При этом образуются различные продукты окисления и деструкции лактозы. Cu(OH)2 восстанавливается до оранжевого CuOH, который потом разлагается до Cu2O красного цвета. В ходе реакции может выделиться и медь. Упрощенно процесс можно представить следующими уравнением:
Слайд 28Фараоновы змеи Взвесили 5 грамм нитрата калия,10 грамм бихромата калия, 10 грамм
сахарозы.
Смесь увлажнили этанолом. При поджигании выползают змеи.
Происходят реакции:
2 KNO3= 2KNO2+O2↑
4K2Cr2O7= 2Cr2O3+4K2CrO4+3O2
C12H22O11+12O2= 12CO2+11H2O
Слайд 31Получение бромной и йодной воды (в вытяжном шкафу).
2KMnO4 + 16 HCI=
2MnCI2 +5 CI2 +2 KCI + 8 H2O
2NaBr+ CI2= 2 NaCI+Br2
2NaI+ CI2=2NaCI+I2
2NaBr+ CI2= 2 NaCI+Br2
2NaI+ CI2=2NaCI+I2
Слайд 33Заключение
1. Задания ЕГЭ многочисленны и многоплановы; В экзаменационной работе почти половина
заданий (21 из 45) проверяет усвоение элементов содержания блока «Вещество». Проверка усвоения содержания материала блока осуществляется на базовом (16 заданий с выбором ответа) и повышенном (5 заданий с кратким ответом) уровнях сложности. Треть заданий экзаменационной работы составляют задания блока «Химическая реакция». Проверка знаний этого блока осуществляется на всех трех уровнях сложности – базовом (9 заданий с выбором ответа), повышенном (3 задания с кратким ответом), и высоком (3 ответа с развернутым ответом). Большая доля заданий этого блока свидетельствует о необходимости серьезного отношения к повторению.
2. Для лучшего усвоения знаний при подготовке к ЕГЭ провели опыты по разделам: «Вещество», «Химическая реакция»;
3. В разделе «Вещество» повторили классификацию неорганических веществ и их свойства, строение и свойства органических соединений(на опытах с белками, углеводами), изучили особенности взаимодействия концентрированной азотной кислоты с металлами. Проделали эксперимент по изучению свойств переходных металлов (хрома, железа, марганца);
4. В блоке химическая реакция изучили реакции разложения, соединения, обмена. Эндотермические и экзотермические реакции. Окислительно-восстановительные реакции провели с соединениями марганца, хрома, серы, пероксида водорода. Научились составлять межмолекулярные, внутримолекулярные ОВР и реакции диспропорционирования.
5. Мы проделали огромное количество химических опытов, хотя в работе описали только 10 работ. За период работы мы совершенствовали наши экспериментальные умения и навыки, научились ориентироваться в огромном количестве химических соединений, усвоили многие признаки химических реакции. При выполнении экспериментов соблюдали правила работы в лаборатории, совершенствовали умения работать с лабораторной посудой и оборудованием. Выполняли правила безопасности при работе с едкими, горючими и таксичными веществами.
6.После проведенных экспериментов нам стало легче решать задания с развернутым ответом, так как многие вещества запомнились по цвету, агрегатному состоянию, по физическим и химическим свойствам.
7.Все стройное здание современной химии покоится на прочном фундаменте, основу которого составляют учение о строении вещества и о химической реакции. При составлении уравнении химических реакции мы повторили химическую связь, степень окисления и валентность химических элементов.
Получили амфотерные, кислотные и основные оксиды.
8.Нашу работу можно будет использовать при подготовке к ЕГЭ выпускникам последующих лет .
2. Для лучшего усвоения знаний при подготовке к ЕГЭ провели опыты по разделам: «Вещество», «Химическая реакция»;
3. В разделе «Вещество» повторили классификацию неорганических веществ и их свойства, строение и свойства органических соединений(на опытах с белками, углеводами), изучили особенности взаимодействия концентрированной азотной кислоты с металлами. Проделали эксперимент по изучению свойств переходных металлов (хрома, железа, марганца);
4. В блоке химическая реакция изучили реакции разложения, соединения, обмена. Эндотермические и экзотермические реакции. Окислительно-восстановительные реакции провели с соединениями марганца, хрома, серы, пероксида водорода. Научились составлять межмолекулярные, внутримолекулярные ОВР и реакции диспропорционирования.
5. Мы проделали огромное количество химических опытов, хотя в работе описали только 10 работ. За период работы мы совершенствовали наши экспериментальные умения и навыки, научились ориентироваться в огромном количестве химических соединений, усвоили многие признаки химических реакции. При выполнении экспериментов соблюдали правила работы в лаборатории, совершенствовали умения работать с лабораторной посудой и оборудованием. Выполняли правила безопасности при работе с едкими, горючими и таксичными веществами.
6.После проведенных экспериментов нам стало легче решать задания с развернутым ответом, так как многие вещества запомнились по цвету, агрегатному состоянию, по физическим и химическим свойствам.
7.Все стройное здание современной химии покоится на прочном фундаменте, основу которого составляют учение о строении вещества и о химической реакции. При составлении уравнении химических реакции мы повторили химическую связь, степень окисления и валентность химических элементов.
Получили амфотерные, кислотные и основные оксиды.
8.Нашу работу можно будет использовать при подготовке к ЕГЭ выпускникам последующих лет .




















![Экспериментальное решение задач ЕГЭ (презентация) FeCl3+3KCNS= Fe(CNS)3+3KCl Ионы железа (III) проверяем желтой кровяной солью: FeCl3+K4[Fe(CN)6]= KFe[Fe(CN)6] ↓+3KCl Берлинская лазурь FeCl3+3KCNS= Fe(CNS)3+3KCl Ионы железа (III) проверяем желтой кровяной солью: FeCl3+K4[Fe(CN)6]= KFe[Fe(CN)6] ↓+3KCl Берлинская лазурь](/img/thumbs/e0ea41ab70c521ee8bf2c23630cbc770-800x.jpg)