- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Движение електрона в атоме
Содержание
- 1. Движение електрона в атоме
- 2. Двойственная природа электрона Электрон имеет массу
- 3. Электрон в атоме может находиться
- 4. В настоящее время считается, что
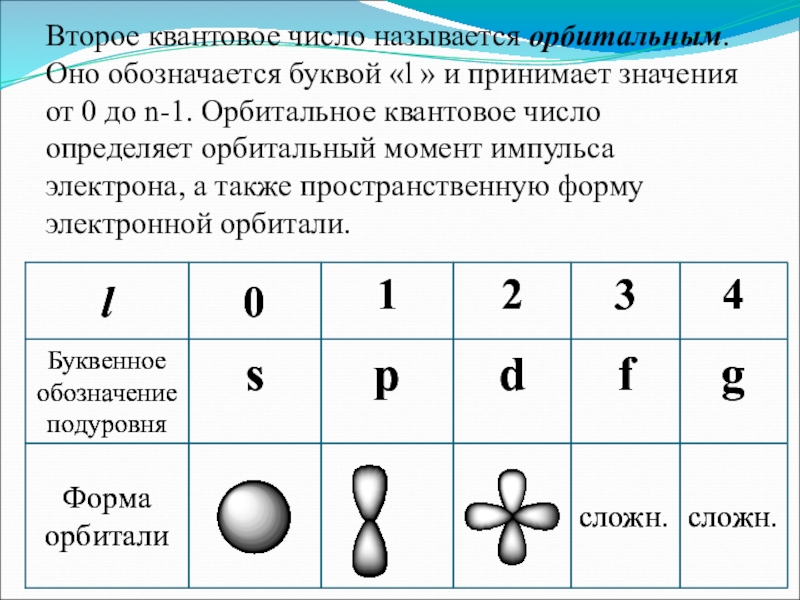
- 5. Второе квантовое число называется орбитальным. Оно обозначается
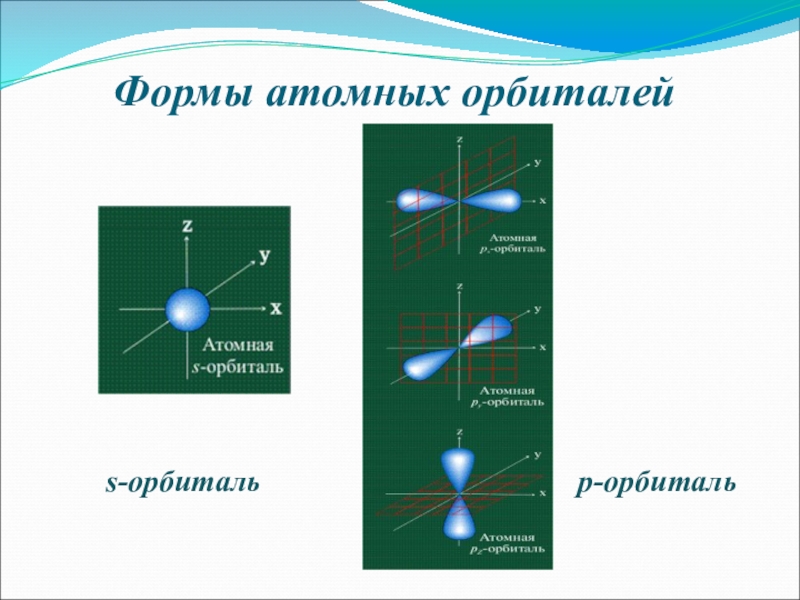
- 6. Формы атомных орбиталейs-орбитальp-орбиталь
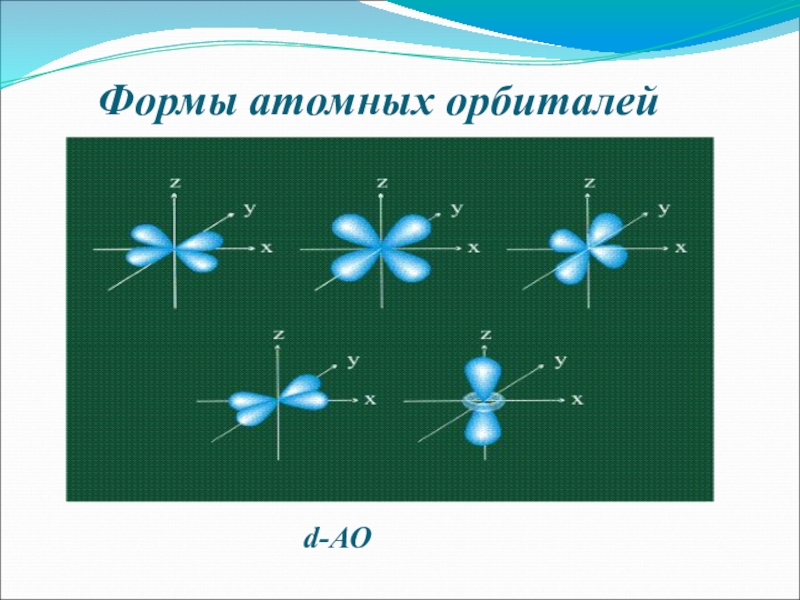
- 7. Формы атомных орбиталейd-АО
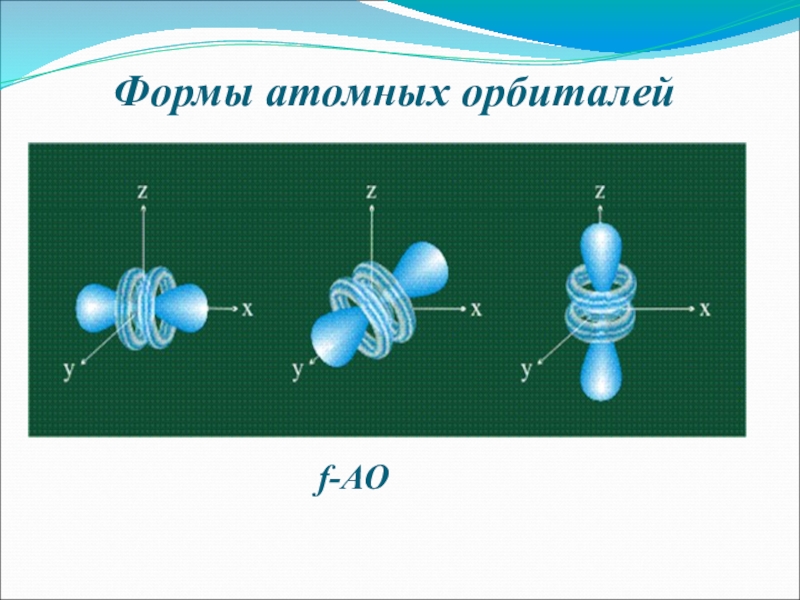
- 8. Формы атомных орбиталейf-АО
- 9. Число подуровней, на которые расщепляется энергетический уровень
- 10. Магнитное квантовое число ml определяет значения проекции
- 11. Слайд 11
- 12. Четвертое квантовое число называется спиновым
- 13. Общая характеристика состояния электрона в многоэлектронном атоме
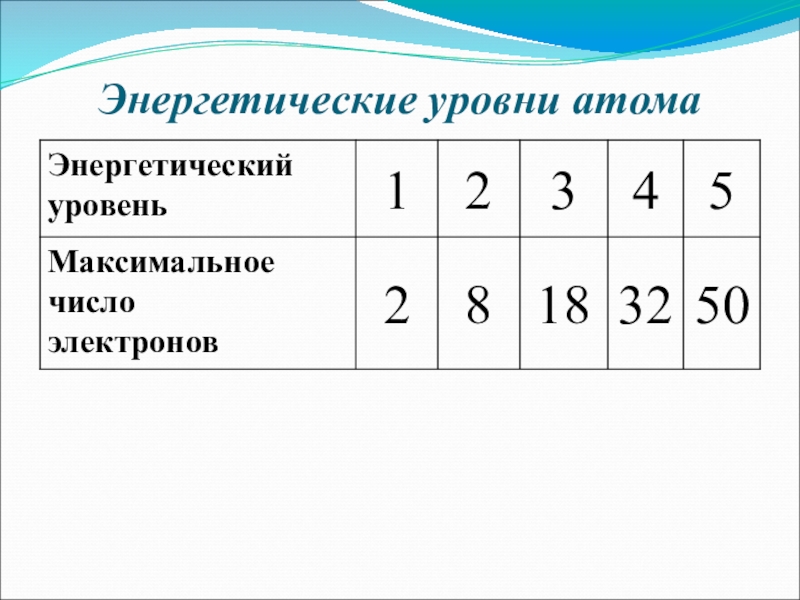
- 14. Энергетические уровни атома
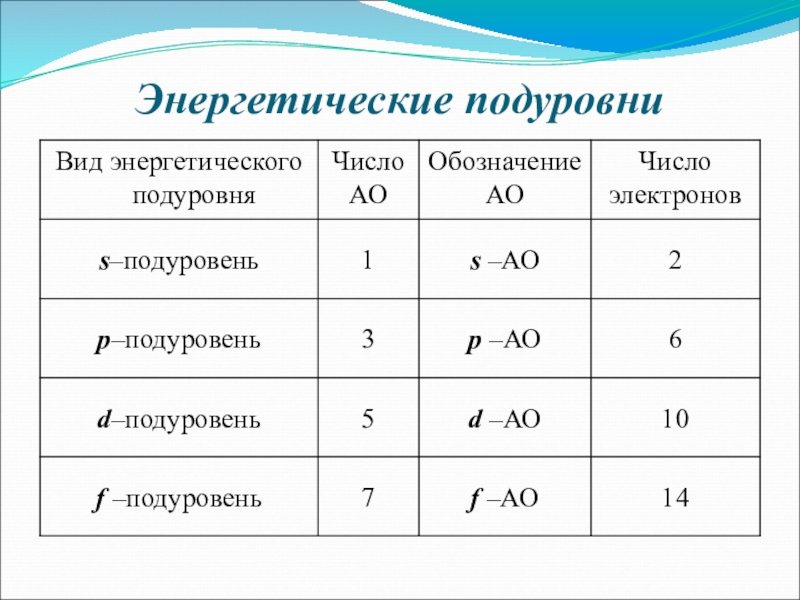
- 15. Энергетические подуровни
Слайд 2Двойственная природа электрона
Электрон имеет массу и заряд, как частица.
Электрон в атоме можно рассматривать как частицу, которая при движении проявляет волновые свойства. Т.е. нельзя описать движение электрона в атоме определенной траекторией (орбитой).
Слайд 3
Электрон в атоме может находиться в любой точке пространства
Атомная орбиталь –
область вокруг ядра атома,
в которой наиболее вероятно
нахождение электрона.
Слайд 4 В настоящее время считается, что состояние каждого электрона в
Первое из них называется главным квантовым числом. Оно обозначается буквой «n» и принимает значение простых целых чисел. Главное квантовое число определяет энергию электрона, степень удаленности от ядра, размеры электронной обитали.
Слайд 5
Второе квантовое число называется орбитальным. Оно обозначается буквой «l » и
Слайд 9Число подуровней, на которые расщепляется энергетический уровень равно номеру уровня.
Энергетический
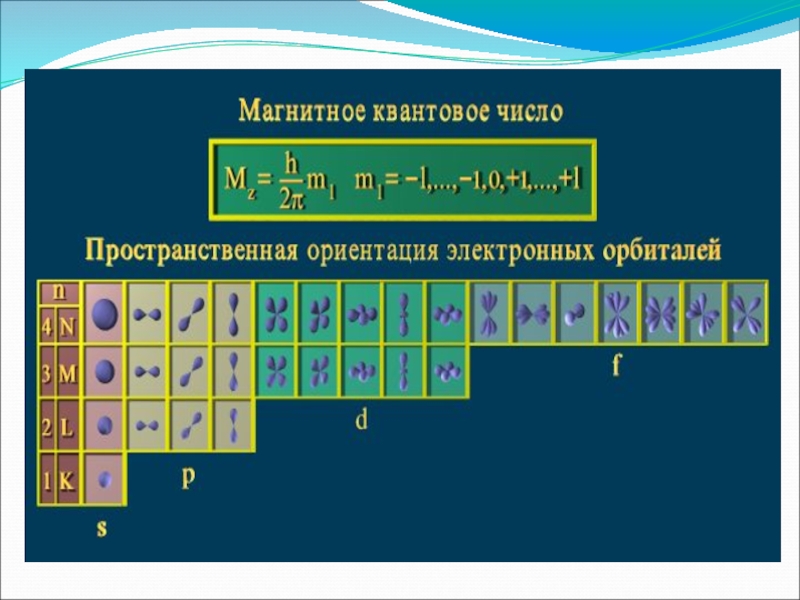
Слайд 10Магнитное квантовое число ml определяет значения проекции орбитального момента на одной
Оно принимает все целочисленные значения от – l до + l.
Например, при l =0 ml = 0;
при l =1 ml = -1; 0 ; +1;
при l =2 ml = -2; -1; 0 ; +1; +2;
Любому значению l соответствует (2l+1) возможных расположений электронного облака данного типа в пространстве.
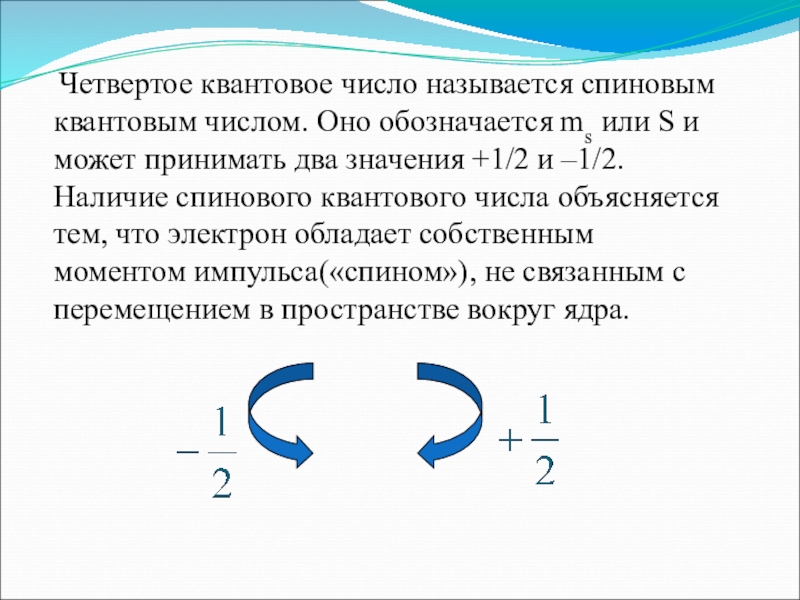
Слайд 12 Четвертое квантовое число называется спиновым квантовым числом. Оно обозначается
Слайд 13Общая характеристика состояния электрона в многоэлектронном атоме определяется принципом Паули: в
На одной орбитали могут находиться не более двух электронов, отличающихся друг от друга спинами. Максимальная емкость энергетического подуровня – 2(2+l ) электронов, а уровня – 2n2.