- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Азотная кислота и её свойства
Содержание
- 1. Азотная кислота и её свойства
- 2. Цели урока:Знать строение и свойства азотной кислоты
- 3. План урокаСтроение молекулы азотной кислотыФизические свойстваПолучениеХимические свойстваПрименение
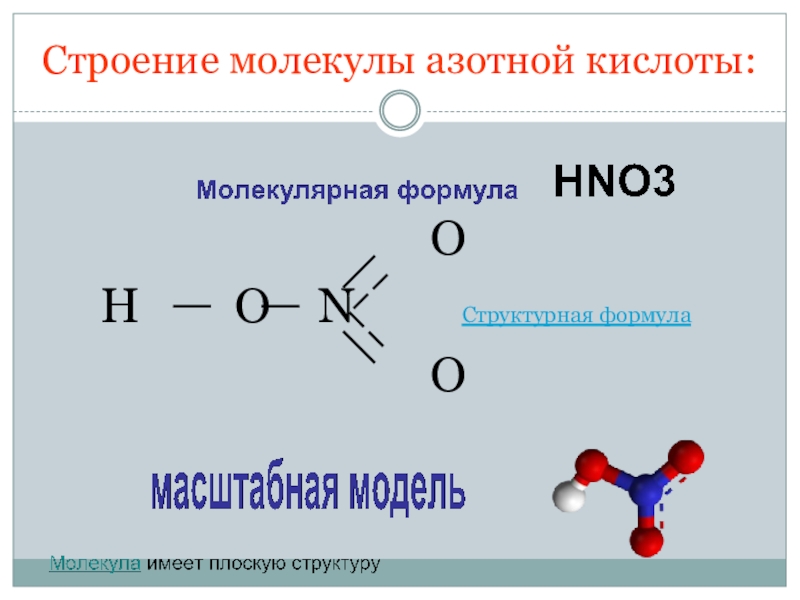
- 4. Строение молекулы азотной кислоты:
- 5. Физические свойстваБесцветная, дымящаяся, неограниченно растворимая в воде
- 6. Получение.Лабораторный способ: Действие конц. серной кислоты
- 7. Получение.Промышленный способ осуществляется
- 8. Химические свойства
- 9. Химические свойства4HNO3 (k) + Cu = Cu(NO3)2 + 4H2O + 2NO2↑8HNO3 (p) + 3Cu = 3Cu(NO3)2 + 4H2O + 2NO↑
- 10. Химические свойстваВнимание!Pt, Au + HNO3 → реакции нетAl, Fe, Cr + HNO3 (конц) холодная→ пассивацияAl, Fe, Cr + HNO3 (конц) t˚C→ NO2Al, Fe, Cr + HNO3 (разб) → NO
Цели урока:Знать строение и свойства азотной кислоты и ее солей. Уметь составлять уравнения реакций, отражающие свойства этих веществ.Развивать наблюдательность, внимание, умение работать самостоятельно и в группе, умение анализировать.
Слайд 2Цели урока:
Знать строение и свойства азотной кислоты и ее солей.
Уметь
составлять уравнения реакций, отражающие свойства этих веществ.
Развивать наблюдательность, внимание, умение работать самостоятельно и в группе, умение анализировать.
Развивать наблюдательность, внимание, умение работать самостоятельно и в группе, умение анализировать.
Слайд 3План урока
Строение молекулы азотной кислоты
Физические свойства
Получение
Химические свойства
Применение
Слайд 5Физические свойства
Бесцветная, дымящаяся, неограниченно растворимая в воде жидкость, обладающая резким раздражающим
запахом. t°пл.= -41°C; t°кип.= 86°С. При долгом стоянии на свету желтеет из-за частичного разложения. Едкое вещество.
Слайд 6Получение.
Лабораторный способ:
Действие конц. серной кислоты на кристаллические нитраты.
KNO3
+ H2SO4(конц) = KHSO4 + HNO3
Слайд 7Получение.
Промышленный способ осуществляется
в 3 этапа:
1) Окисление аммиака на платиновом катализаторе до NO
4NH3 + 5O2 = 4NO + 6H2O
2) Окисление кислородом воздуха NO до NO2
2NO + O2 = 2NO2
3) Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2H2O = 4HNO3
Слайд 9Химические свойства
4HNO3 (k) + Cu = Cu(NO3)2 + 4H2O + 2NO2↑
8HNO3 (p) + 3Cu
= 3Cu(NO3)2 + 4H2O + 2NO↑