СЕРИКОВСКАЯ ООШ
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Азот – безжизненный элемент или важная составная часть жизни на Земле?
Содержание
- 1. Азот – безжизненный элемент или важная составная часть жизни на Земле?
- 2. Тип проекта: реферативно-исследовательский, межпредметный;Место в учебном процессе:
- 3. ЦЕЛИ:изучить свойства азота и область его применения
- 4. ПОЧЕМУ НАЗВАЛИ “АЗОТ”? Соединения азота - селитра,
- 5. НАХОЖДЕНИЕ В ПРИРОДЕ.Азот – один из распространенных
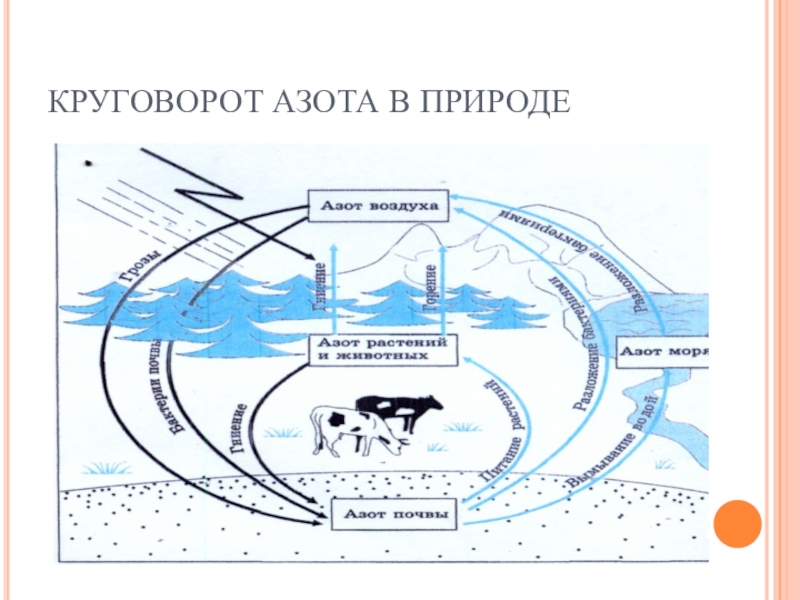
- 6. КРУГОВОРОТ АЗОТА В ПРИРОДЕ
- 7. “ЖИЗНЬ - ЕСТЬ СПОСОБ СУЩЕСТВОВАНИЯ БЕЛКОВЫХ ТЕЛ
- 8. АЗОТ (ОБЩИЕ СВЕДЕНИЯ).
- 9. ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТААзот немного легче воздуха; плотность
- 10. ХИМИЧЕСКИЕ СВОЙСТВА АЗОТА К металлам:N2+6Li (об.усл.)
- 11. СОЕДИНЕНИЯ АЗОТАНИТРАТЫ — соли азотной кислоты HNO3,
- 12. СПОСОБЫ ПОЛУЧЕНИЯ АЗОТА:Лабораторный способ:NH4NO2N2+ 2H2OПромышленный способ:Технический способ
- 13. ПРИМЕНЕНИЕ АЗОТА: создание инертных сред в металлургии;
- 14. АЗОТ – ДРУГ ИЛИ ВРАГ? Азот –
Тип проекта: реферативно-исследовательский, межпредметный;Место в учебном процессе: тема «Азот»;Формируемые компетенции: общеучебные, информационные, исследовательские (комплексное сравнение и анализ, классификация полученных результатов, химический эксперимент, обобщение).
Слайд 2Тип проекта: реферативно-исследовательский, межпредметный;
Место в учебном процессе: тема «Азот»;
Формируемые компетенции: общеучебные,
информационные, исследовательские (комплексное сравнение и анализ, классификация полученных результатов, химический эксперимент, обобщение).
Слайд 3ЦЕЛИ:
изучить свойства азота и область его применения на основе строения атома
и молекулы;
формировать умения формулировать проблему, находить пути её решения через самостоятельный поиск информации в учебнике, в Интернете, делать выводы;
воспитание научного мировоззрения.
формировать умения формулировать проблему, находить пути её решения через самостоятельный поиск информации в учебнике, в Интернете, делать выводы;
воспитание научного мировоззрения.
Слайд 4ПОЧЕМУ НАЗВАЛИ “АЗОТ”?
Соединения азота - селитра, азотная кислота, аммиак -
были известны задолго до получения азота в свободном состоянии. В 1772 г. Д.Резерфорд, сжигая фосфор и другие вещества в стеклянном колоколе, показал, что остающийся газ не поддерживает дыхания и горения. Д.Резерфорд назвал его “удушливым воздухом”.
К.Шееле назвал этот элемент, извлеченный из воздуха,- “дурным воздухом”.
В 1787 г. А.Лавуазье установил, что “жизненный” и “удушливый” газы, входящие в состав воздуха, это простые
вещества, и предложил название “азот”. “А” - отсутствие, “зоо” - жизнь. “Безжизненный”- азот.
И не случайно: испытания проводили на лабораторных мышах, помещая их под колпак с азотом, где они погибали.
К.Шееле назвал этот элемент, извлеченный из воздуха,- “дурным воздухом”.
В 1787 г. А.Лавуазье установил, что “жизненный” и “удушливый” газы, входящие в состав воздуха, это простые
вещества, и предложил название “азот”. “А” - отсутствие, “зоо” - жизнь. “Безжизненный”- азот.
И не случайно: испытания проводили на лабораторных мышах, помещая их под колпак с азотом, где они погибали.
Слайд 5НАХОЖДЕНИЕ В ПРИРОДЕ.
Азот – один из распространенных элементов на Земле.
- в
атмосфере - 4•1051 по массе и 78% газообразного азота по объёму
- литосфере – 1,9•10-3 по массе
- в живых организмах - 0,3% по массе
В белке животных и человека - 16–17% азота. В организмах человека и плотоядных животных белок образуется за счёт потребляемых белковых веществ травоядных животных и в растениях.
Азот – четвертый по распространенности элемент солнечной системы (после водорода, гелия и кислорода)
- литосфере – 1,9•10-3 по массе
- в живых организмах - 0,3% по массе
В белке животных и человека - 16–17% азота. В организмах человека и плотоядных животных белок образуется за счёт потребляемых белковых веществ травоядных животных и в растениях.
Азот – четвертый по распространенности элемент солнечной системы (после водорода, гелия и кислорода)
Слайд 7“ЖИЗНЬ - ЕСТЬ СПОСОБ СУЩЕСТВОВАНИЯ БЕЛКОВЫХ ТЕЛ НА ЗЕМЛЕ” - ПО
ОПРЕДЕЛЕНИЮ Ф.ЭНГЕЛЬСА
Д.Резерфорд –“удушливый воздух”
К. Шееле – “дурной воздух”
А.Лавуазье – “безжизненный воздух”
Д.И.Прянишников – “Нет жизни без азота, ибо он является важнейшей составляющей частью белковой молекулы”
Слайд 8АЗОТ (ОБЩИЕ СВЕДЕНИЯ).
АЗОТ (лат. Nitrogenium — рождающий селитры), N
(читается «эн») — химический элемент второго периода
VA группы периодической системы, атомный номер 7,
атомная масса 14,0067. В свободном виде — газ без
цвета, запаха и вкуса, плохо растворим в воде. Состоит
из двухатомных молекул N2, обладающих высокой
прочностью. Относится к неметаллам.
Природный азот состоит из стабильных нуклидов 14N (содержание в смеси 99,635% по массе) и 15N. Конфигурация внешнего электронного слоя 2 s 2 2р 3. Радиус нейтрального атома азота 0,074 нм, радиус ионов: N3- — 0,132, N3+ — 0,030 и N5+ — 0,027 нм. Энергии последовательной ионизации нейтрального атома азота равны, соответственно, 14,53, 29,60, 47,45, 77,47 и 97,89 эВ. По шкале Полинга электроотрицательность азота 3,05.
(читается «эн») — химический элемент второго периода
VA группы периодической системы, атомный номер 7,
атомная масса 14,0067. В свободном виде — газ без
цвета, запаха и вкуса, плохо растворим в воде. Состоит
из двухатомных молекул N2, обладающих высокой
прочностью. Относится к неметаллам.
Природный азот состоит из стабильных нуклидов 14N (содержание в смеси 99,635% по массе) и 15N. Конфигурация внешнего электронного слоя 2 s 2 2р 3. Радиус нейтрального атома азота 0,074 нм, радиус ионов: N3- — 0,132, N3+ — 0,030 и N5+ — 0,027 нм. Энергии последовательной ионизации нейтрального атома азота равны, соответственно, 14,53, 29,60, 47,45, 77,47 и 97,89 эВ. По шкале Полинга электроотрицательность азота 3,05.
Слайд 9ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТА
Азот немного легче воздуха; плотность 1,2506 кг/м3 (при н.у.),
tпл.= - 209,8оС, tкип.= -195,8оС. Азот сжижается с трудом: плотность жидкого азота 800 кг/м3. В воде азот менее растворим чем кислород: при 0оС в 1м3 Н2О растворяется 23,3 г азота.
Азот не поддерживает дыхание и горение.
Азот не поддерживает дыхание и горение.
Слайд 10ХИМИЧЕСКИЕ СВОЙСТВА АЗОТА
К металлам:
N2+6Li (об.усл.) —> 2Li3N
N2+3Mg (об.усл.) —>
Mg3N2
N2+2Al —> 2AlN
К неметаллам:
N2+3H2 2NH3
N2+O2 —>2NO-Q
N2+3F2 (эл. разряд) —> 2NF3
N2+2Al —> 2AlN
К неметаллам:
N2+3H2 2NH3
N2+O2 —>2NO-Q
N2+3F2 (эл. разряд) —> 2NF3
Слайд 11СОЕДИНЕНИЯ АЗОТА
НИТРАТЫ — соли азотной кислоты HNO3, твердые хорошо растворимые в
воде вещества. Традиционное русское название некоторых нитратов щелочных и щелочноземельных металлов и аммония — селитры (аммонийная селитра NH4NO3, калийная селитра КNO3, кальциевая селитра Са(NO3)2 и др.
НИТРИДЫ — химические соединения азота с более электроположительными элементами. Компоненты жаропрочных сплавов используются в полупроводниковых приборах (напр., полупроводниковых лазерах, светоизлучающих диодах), как абразивы.
ОКСИДЫ АЗОТА: гемиоксид N2O и монооксид NO (бесцветные газы), сесквиоксид N2O3 (синяя жидкость), диоксид NO2 (бурый газ, при обычных условиях смесь NO2 и его димера N2O4), оксид N2O5 (бесцветные кристаллы). N2O и NO — несолеобразующие оксиды, N2O3 с водой дает азотистую кислоту, N2O5 — азотную, NO2 — их смесь. Все оксиды азота физиологически активны. N2O — средство для наркоза («веселящий газ»), NO и NO2 — промежуточные продукты в производстве азотной кислоты, NO2 — окислитель в жидком ракетном топливе, смесевых ВВ, нитрующий агент.
АММИАК NH3 M=17,03: Применяется для производства азотной кислоты, нитрата и сульфата аммония, жидких удобрений (аммиакатов), мочевины, соды, в органическом синтезе, при крашении тканей, светокопировании (надиазониевой бумаге), в качестве хладагента в холодильниках, при серебрении зеркал.
HNO3 – азотная кислота.
HNO2 – азотистая кислота.
НИТРИДЫ — химические соединения азота с более электроположительными элементами. Компоненты жаропрочных сплавов используются в полупроводниковых приборах (напр., полупроводниковых лазерах, светоизлучающих диодах), как абразивы.
ОКСИДЫ АЗОТА: гемиоксид N2O и монооксид NO (бесцветные газы), сесквиоксид N2O3 (синяя жидкость), диоксид NO2 (бурый газ, при обычных условиях смесь NO2 и его димера N2O4), оксид N2O5 (бесцветные кристаллы). N2O и NO — несолеобразующие оксиды, N2O3 с водой дает азотистую кислоту, N2O5 — азотную, NO2 — их смесь. Все оксиды азота физиологически активны. N2O — средство для наркоза («веселящий газ»), NO и NO2 — промежуточные продукты в производстве азотной кислоты, NO2 — окислитель в жидком ракетном топливе, смесевых ВВ, нитрующий агент.
АММИАК NH3 M=17,03: Применяется для производства азотной кислоты, нитрата и сульфата аммония, жидких удобрений (аммиакатов), мочевины, соды, в органическом синтезе, при крашении тканей, светокопировании (надиазониевой бумаге), в качестве хладагента в холодильниках, при серебрении зеркал.
HNO3 – азотная кислота.
HNO2 – азотистая кислота.
Слайд 12СПОСОБЫ ПОЛУЧЕНИЯ АЗОТА:
Лабораторный способ:
NH4NO2N2+ 2H2O
Промышленный способ:
Технический способ получения азота основан на
разделении предварительно сжиженного воздуха.
Интернет —> Азотные установки, азотные станции, генераторы азота
Интернет —> Азотные установки, азотные станции, генераторы азота
Слайд 13ПРИМЕНЕНИЕ АЗОТА:
создание инертных сред в металлургии;
синтез аммиака и азотной
кислоты;
производство минеральных удобрений;
производство взрывчатых веществ;
жидкий азот в медицине.
производство минеральных удобрений;
производство взрывчатых веществ;
жидкий азот в медицине.
Слайд 14АЗОТ – ДРУГ ИЛИ ВРАГ?
Азот – “безжизненный”.
Азот – главный
элемент жизни.
Что можно сказать о хим. активности азота? Почему?
В каких реакциях азот – окислитель, в каких – восстановитель?
Что можно сказать о хим. активности азота? Почему?
В каких реакциях азот – окислитель, в каких – восстановитель?