- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Амины для 11 классов, что бы вспомнили.
Содержание
- 1. Амины для 11 классов, что бы вспомнили.
- 2. Аминами называются органические производные аммиака, в котором
- 3. По числу замещённых атомов водорода различают соответственно
- 4. Химические свойства. Амины, являясь производными аммиака, имеют
- 5. Амины присоединяют галогеналканы RCl, с образованием донорно-акцепторной
- 6. Реакция с ангидридами протекает в мягких условиях.
- 7. Третичные амины при обычной температуре с азотистой
- 8. Физические свойства.Первые представители ряда аминов — метиламин CH3NH2,
- 9. Получение.Восстановление азотсодержащих соединений: нитросоединений(реакция Зинина).Эту реакцию впервые
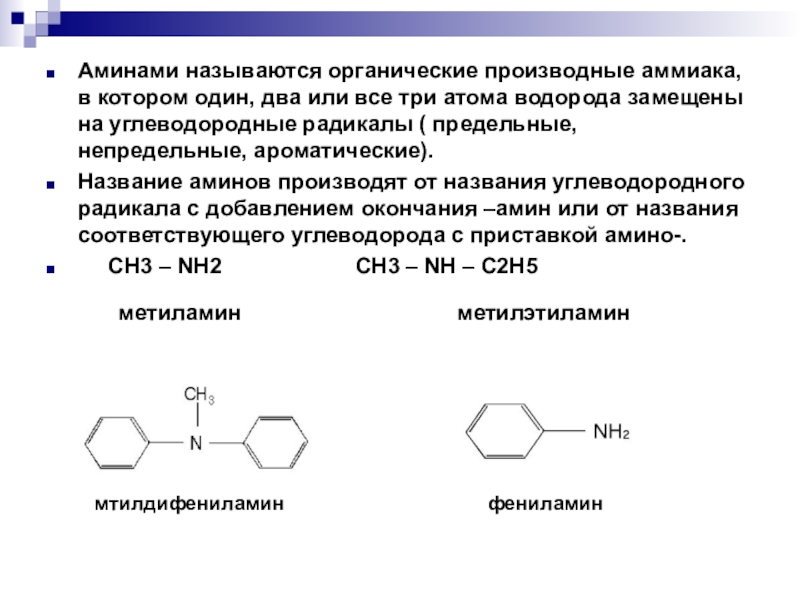
Аминами называются органические производные аммиака, в котором один, два или все три атома водорода замещены на углеводородные радикалы ( предельные, непредельные, ароматические).Название аминов производят от названия углеводородного радикала с добавлением окончания –амин или от названия соответствующего
Слайд 2Аминами называются органические производные аммиака, в котором один, два или все
три атома водорода замещены на углеводородные радикалы ( предельные, непредельные, ароматические).
Название аминов производят от названия углеводородного радикала с добавлением окончания –амин или от названия соответствующего углеводорода с приставкой амино-.
CH3 – NH2 CH3 – NH – C2H5
метиламин метилэтиламин
Название аминов производят от названия углеводородного радикала с добавлением окончания –амин или от названия соответствующего углеводорода с приставкой амино-.
CH3 – NH2 CH3 – NH – C2H5
метиламин метилэтиламин
мтилдифениламин
фениламин
Слайд 3
По числу замещённых атомов водорода различают соответственно первичные, (R-NH2) вторичные (R-NH-R)
и третичные амины. Четвертичная аммониевая соль вида [R4N]+Cl- является органическим аналогом аммониевой соли.
По характеру органической группы, связанной с азотом, различают алифатические CH3-N< и ароматические С6H5-N< b ;и жирно-алифатические (содержат ароматический и алифатический радикалы) амины.
По числу NH2-групп в молекуле амины делят на моноамины, диамины, триамины и т. д.
По характеру органической группы, связанной с азотом, различают алифатические CH3-N< и ароматические С6H5-N< b ;и жирно-алифатические (содержат ароматический и алифатический радикалы) амины.
По числу NH2-групп в молекуле амины делят на моноамины, диамины, триамины и т. д.
Слайд 4Химические свойства.
Амины, являясь производными аммиака, имеют сходное с ним строение и
проявляют подобные ему свойства. Для них также характерно образование донорно-акцепторной связи. Азот предоставляет неподеленную электронную пару, исполняя роль донора. В качестве акцептора электоронов может выступать, например, протон Н+, образуя ион R3NH+. Возникшая ковалентная связь N-H полностью эквивалентна остальным связям N-H в амине.
Водные растворы алифатических аминов проявляют щелочную реакцию, так как при их взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония:
C2H5NH2 + H2O → [C2H5NH3]+ + OH-
Взаимодействуя с кислотами, амины образуют алкиламиновые соли, в большинстве случаев растворимые в воде. Например, амины присоединяют галогеноводороды:
RNH2 + HCl → [RNH3]Cl-
Водные растворы алифатических аминов проявляют щелочную реакцию, так как при их взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония:
C2H5NH2 + H2O → [C2H5NH3]+ + OH-
Взаимодействуя с кислотами, амины образуют алкиламиновые соли, в большинстве случаев растворимые в воде. Например, амины присоединяют галогеноводороды:
RNH2 + HCl → [RNH3]Cl-
Слайд 5
Амины присоединяют галогеналканы RCl, с образованием донорно-акцепторной связи N-R, которая также
эквивалентна уже имеющимся.
При нагревании с карбоновыми кислотами, их ангидридами, хлорангидридами или сложными эфирами первичные и вторичные амины ацилируются с образованием N-замещенных амидов, соединений с фрагментом -С(О)N<:
При нагревании с карбоновыми кислотами, их ангидридами, хлорангидридами или сложными эфирами первичные и вторичные амины ацилируются с образованием N-замещенных амидов, соединений с фрагментом -С(О)N<:
Слайд 6
Реакция с ангидридами протекает в мягких условиях. Ещё легче реагируют хлорангидриды,
реакция проводится в присутствии основания, чтобы свзяать образующийся HCl.
Если в качестве исходных соединений взять диамин и дикарбоновую кислоту, то они взаимодействуют по такой же схеме, но поскольку каждое соединение содержит две реагирующие группы, то образуется полиамид.
Первичные и вторичные амины взаимодействуют с азотистой кислотой различным образом. Из первичных аминов образуются первичные спирты:
C2H5NH2 + HNO2 → C2H5OH + N2 +H2O
Вторичные амины образуют с азотистой кислотой желтые, трудно растворимые нитрозамины — соединения, содержащие фрагмент >N-N=O:
(C2H5)2NH + HNO2 → (C2H5)2N-N=O + H2O
Если в качестве исходных соединений взять диамин и дикарбоновую кислоту, то они взаимодействуют по такой же схеме, но поскольку каждое соединение содержит две реагирующие группы, то образуется полиамид.
Первичные и вторичные амины взаимодействуют с азотистой кислотой различным образом. Из первичных аминов образуются первичные спирты:
C2H5NH2 + HNO2 → C2H5OH + N2 +H2O
Вторичные амины образуют с азотистой кислотой желтые, трудно растворимые нитрозамины — соединения, содержащие фрагмент >N-N=O:
(C2H5)2NH + HNO2 → (C2H5)2N-N=O + H2O
Слайд 7
Третичные амины при обычной температуре с азотистой кислотой не реагируют,
Конденсация первичных
аминов с альдегидами и кетонами приводит к образованию иминов или так называемых оснований Шиффа — соединений, содержащих фрагмент -N=C<:
При горении амин выделяет кроме воды и углекислого газа ещё и азот.
При горении амин выделяет кроме воды и углекислого газа ещё и азот.
Слайд 8Физические свойства.
Первые представители ряда аминов — метиламин CH3NH2, диметиламин (CH3)2NH, триметиламин (CH3)3N
и этиламин C2H5NH2 — при комнатной температуре газообразные, далее при увеличении числа атомов в R амины становятся жидкостями, а при увеличении длины цепи R до 10 атомов С — кристаллическими веществами. Растворимость аминов в воде убывает по мере увеличения длины цепи R и при возрастании числа органических групп, связанных с азотом (переход к вторичным и третичным аминам). Запах аминов напоминает запах аммиака, высшие (с большими R) амины практически лишены запаха.
Слайд 9Получение.
Восстановление азотсодержащих соединений:
нитросоединений(реакция Зинина).
Эту реакцию впервые осуществил Н. Н. Зинин в 1842 г..
Действуя на нитробензол сульфидом аммония, он получил анилин:
C6H5NO2 + 3(NH4)2S → C6H5NH2 + 6NH3 + 3S + 2H2O
нитрилов, оксимов, амидов.
Алкилирование аммиака (реакция Гофмана)
Физические свойства аминов. Первые представители ряда аминов — метиламин CH3NH2, диметиламин (CH3)2NH, триметиламин (CH3)3N и этиламин C2H5NH2 — при комнатной температуре газообразные, далее при увеличении числа атомов в R амины становятся жидкостями, а при увеличении длины цепи R до 10 атомов С — кристаллическими веществами. Растворимость аминов в воде убывает по мере увеличения длины цепи R и при возрастании числа органических групп, связанных с азотом (переход к вторичным и третичным аминам). Запах аминов напоминает запах аммиака, высшие (с большими R) амины практически лишены запаха.
C6H5NO2 + 3(NH4)2S → C6H5NH2 + 6NH3 + 3S + 2H2O
нитрилов, оксимов, амидов.
Алкилирование аммиака (реакция Гофмана)
Физические свойства аминов. Первые представители ряда аминов — метиламин CH3NH2, диметиламин (CH3)2NH, триметиламин (CH3)3N и этиламин C2H5NH2 — при комнатной температуре газообразные, далее при увеличении числа атомов в R амины становятся жидкостями, а при увеличении длины цепи R до 10 атомов С — кристаллическими веществами. Растворимость аминов в воде убывает по мере увеличения длины цепи R и при возрастании числа органических групп, связанных с азотом (переход к вторичным и третичным аминам). Запах аминов напоминает запах аммиака, высшие (с большими R) амины практически лишены запаха.