- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Алкины
Содержание
- 1. Алкины
- 2. «Парад Ученых-химиков» Чье имя носит реакция получение
- 3. «Сравнительная характеристика углеводородовпредельного и непредельного строения»
- 4. АЛКИНЫ
- 5. Сегодня на уроке вы узнаете:Понятие о непредельных
- 6. Понятие об алкинахАлкины – углеводороды, содержащие в
- 7. Характеристика тройной связиВид гибридизации –
- 8. Схема образования sp -гибридных орбиталей
- 9. Гомологический ряд алкинов C2H2 C3H4 C4H6 C5H8 C6H10 C7H12Этин ПропинБутинПентинГексинГептин
- 10. Изомерия алкинов Структурная изомерия1. Изомерия положения тройной
- 11. Выполните упражнение:Назовите вещество.Составьте к нему три изомера
- 12. Физические свойстваТемпературы кипения и плавления алкинов, так
- 13. Способы получения ацетилена Ацетилен был открыт Г.Дэви
- 14. Ацетилен получают в промышленности двумя способами:1. Термический
- 15. Химические свойства алкиновХимические свойства ацетилена и его
- 16. Качественная реакция С помощью какого реактива можно
- 17. Реакция окисленияОбесцвечивание бромной воды является качественной реакцией на все непредельные углеводороды
- 18. ОкислениеАцетилен и его гомологи окисляются перманганатом калия
- 19. Горение ацетиленаПри сгорании (полном окислении) ацетилена выделяется
- 20. Реакции замещенияПри взаимодействии ацетилена (или R−C≡C−H) с
- 21. Реакции присоединенияа) гидрирование алкинов1-я стадия R
- 22. г) гидратация алкинов (реакция Кучерова
- 23. Реакция полимеризации1. Димеризация под действием водного раствора
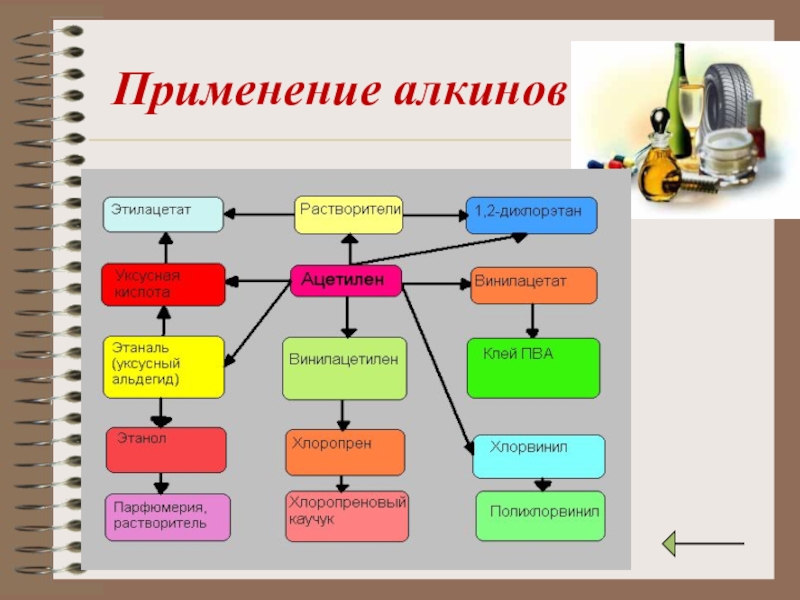
- 24. Применение алкинов
- 25. ЗаданиеКакие реакции лежали в основе принципа действия карбидных фонарей, применяемых для освещения в 19-ом веке?
- 26. Решение: В фонарь, наполненный карбидом кальция, по каплям
- 27. Домашнее заданиеИзучить п 4.5,4.6 стр110-119Ответить на вопросы1-5
- 28. СПАСИБОЗА СОТРУДНИЧЕСТВО!
Слайд 2«Парад Ученых-химиков»
Чье имя носит реакция получение алканов лабораторным способом.
Советский ученый
Русский химик-органик, сформулировал правило о направлениях химических реакции присоединения по двойной связи.
Русский химик, академик впервые получил бутадиен из этилового спирта
Шведский химик ввел термин «органическая химия».
Создатель теории химического строения органических веществ
Слайд 5Сегодня на уроке вы узнаете:
Понятие о непредельных углеводородах.
Характеристика тройной связи.
Изомерия и
Физические свойства.
Получение алкинов.
Свойства алкинов.
Применение алкинов.
Слайд 6Понятие об алкинах
Алкины – углеводороды, содержащие в молекуле одну тройную связь
СnН2n - 2, где n ≥ 2.
Алкины относятся к непредельным углеводородам, так как их молекулы содержат меньшее число атомов водорода, чем насыщенные.
Слайд 7Характеристика
тройной связи
Вид гибридизации – sp
Валентный угол
Длина связи С ≡ С – 0,12 нм
Строение ─ линейное
Вид связи – ковалентная полярная
По типу перекрывания – δ и 2 π
Слайд 10Изомерия алкинов
Структурная изомерия
1. Изомерия положения тройной связи (начиная с С4Н6):
СН
бутин-1 бутин-2
2. Изомерия углеродного скелета (начиная с С5Н8):
СН ≡С−СН2−СН2−СН3 СН ≡С−СН−СН3
⏐
СН3
пентин-1 3-метилбутин-1
3. Межклассовая изомерия с алкадиенами (начиная с С4Н8):
СН ≡С–СН2–СН3 СН2=СН–СН=СН2
бутин-1 бутадиен-1,3
Слайд 11Выполните упражнение:
Назовите вещество.
Составьте к нему три изомера разных видов изомерии. Назовите
Напишите формулы двух ближайших гомологов и назовите их.
Слайд 12Физические свойства
Температуры кипения и плавления алкинов, так же как и алкенов,
Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены.
Слайд 13Способы получения ацетилена
Ацетилен был открыт Г.Дэви в 1836 году в продуктах
В 1860 г. М. Бертло синтезировал ацетилен из простых веществ, пропуская водород через электрическую дугу между угольными электродами.
В 1862 г. Ф.Велер получил ацетилен из карбида кальция(СаС2), действуя на него водой. Напишите уравнения упомянутых в данном тексте реакций.
Слайд 14Ацетилен получают в промышленности двумя способами:
1. Термический крекинг метана:
2СН4 ⎯⎯→ С2Н2 + 3Н2
2. Гидролиз карбида кальция:
CaC2 + 2H2O ⎯⎯→ C2H2 + Ca(OH)2
Получение алкинов
Слайд 15Химические свойства алкинов
Химические свойства ацетилена и его гомологов в основном определяются
Слайд 16Качественная реакция
С помощью какого реактива можно доказать наличие кратных связей
Слайд 17Реакция окисления
Обесцвечивание бромной воды является качественной реакцией на все непредельные углеводороды
Слайд 18Окисление
Ацетилен и его гомологи окисляются перманганатом калия с
расщеплением тройной связи и
R−C≡C−R’ + 3[O] + H2O ⎯→ R−COOH + R’−COOH
Алкины обесцвечивают раствор KMnO4, что используется
для их качественного определения.
Слайд 19Горение ацетилена
При сгорании (полном окислении) ацетилена выделяется большое количества тепла:
HC≡CH +
Слайд 20Реакции замещения
При взаимодействии ацетилена (или R−C≡C−H) с аммиачными
растворами оксида серебра выпадают
HC≡CH + 2[Ag(NH3)2]OH ⎯→ AgC≡CAg ↓ + 4NH3 + 2H2O
Качественная реакция на
концевую тройную связь
Слайд 21Реакции присоединения
а) гидрирование алкинов
1-я стадия R – С ≡ С
алкин алкен
2-я стадия R – СН = СН – R + Н2 → R – СН2 – СН2 – R
алкен алкан
б) галогенирование алкинов
1-я стадия СН ≡ СН + Br2 → СНBr = СНBr
1,2-дибромэтен
2-я стадия СНBr = СНBr + Br2 → СНBr2 – СНBr2
1,1,2,2-тетрабромэтан
в) гидрогалогенирование алкинов (по правилу Марковникова)
1-я стадия СН3–С≡СН + НBr → СН3–СBr=СН2
2-бромпропен
2-я стадия СН3–СBr=СН2 + НBr → СН3–СBr2–СН3
2,2-дибромпропан
Слайд 23Реакция полимеризации
1. Димеризация под действием водного раствора CuCl и NH4Cl:
(винилацетилен)
2. Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):
С, 600 °С
3НC≡CH ⎯⎯→ С6H6 (бензол)
Слайд 25Задание
Какие реакции лежали в основе принципа действия карбидных фонарей, применяемых для
Слайд 26Решение:
В фонарь, наполненный карбидом кальция, по каплям поступала вода, а получившийся
Слайд 27Домашнее задание
Изучить п 4.5,4.6 стр110-119
Ответить на вопросы1-5 стр.118
Выполните упражнения 8-9 стр.
Изучить химические свойства алкинов на примере пентин-1.Напишите соответствующие реакции
Решите задачи 13,15 стр. 119

















![Алкины ОкислениеАцетилен и его гомологи окисляются перманганатом калия срасщеплением тройной связи и ОкислениеАцетилен и его гомологи окисляются перманганатом калия срасщеплением тройной связи и образованием карбоновых кислот:R−C≡C−R’ + 3[O] +](/img/thumbs/a80413c0f93c870cf5932f44fa315c0b-800x.jpg)

![Алкины Реакции замещенияПри взаимодействии ацетилена (или R−C≡C−H) с аммиачнымирастворами оксида серебра выпадают Реакции замещенияПри взаимодействии ацетилена (или R−C≡C−H) с аммиачнымирастворами оксида серебра выпадают осадки нерастворимых ацетиленидов:HC≡CH + 2[Ag(NH3)2]OH ⎯→](/img/tmb/5/423239/89d4dc832e113b2c3a46581ffc5a2077-800x.jpg)