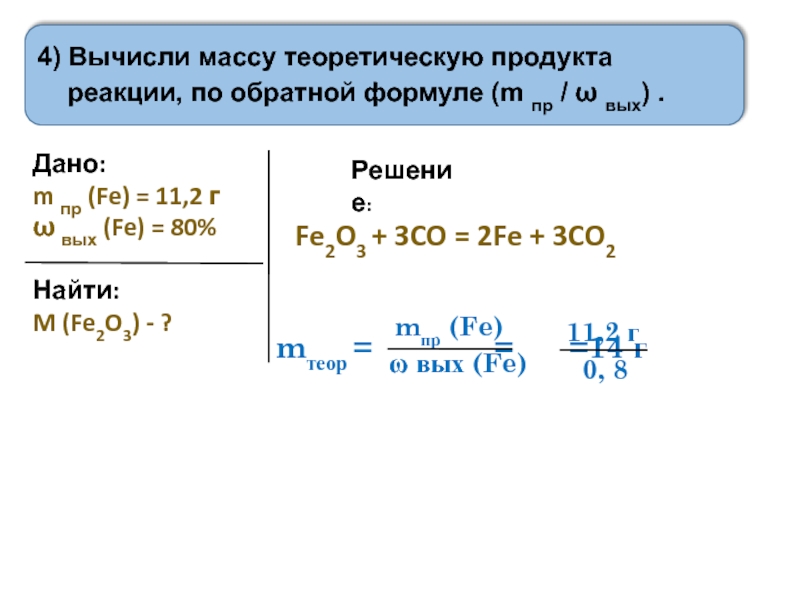
4) Вычисли массу теоретическую продукта реакции, по уравнению реакции.
5) Вычисли массу практическую продукта реакции, воспользовавшись обратной формулой (умножь массу теоретическую на долю выхода)
Алгоритм решения задач второго типа
(найдите «массу продукта реакции»)
(практическую)