- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему 9 класс готовый урок Железо, строение, свойства
Содержание
- 1. 9 класс готовый урок Железо, строение, свойства
- 2. СодержаниеЦельПервые понятия о железеЗначение Физические свойстваХимические свойства(с
- 3. ЦелиСодержаниеФормирование понятий о железе:Изучение химических и
- 4. Ковкий, вязкий металл серебристо-белого цвета.Гидротермальный источник с
- 5. ЗначениеЖелезо — один из самых используемых металлов,
- 6. Физические свойстваЦвет : серебристо-белыйБлеск : блестящийПластичность :
- 7. Химические свойстваВзаимодействие с простыми веществами-неметаллами 2) С
- 8. Химические свойстваВзаимодействие со сложными веществамиСодержание1) С водой2) С солями 3) С кислотами
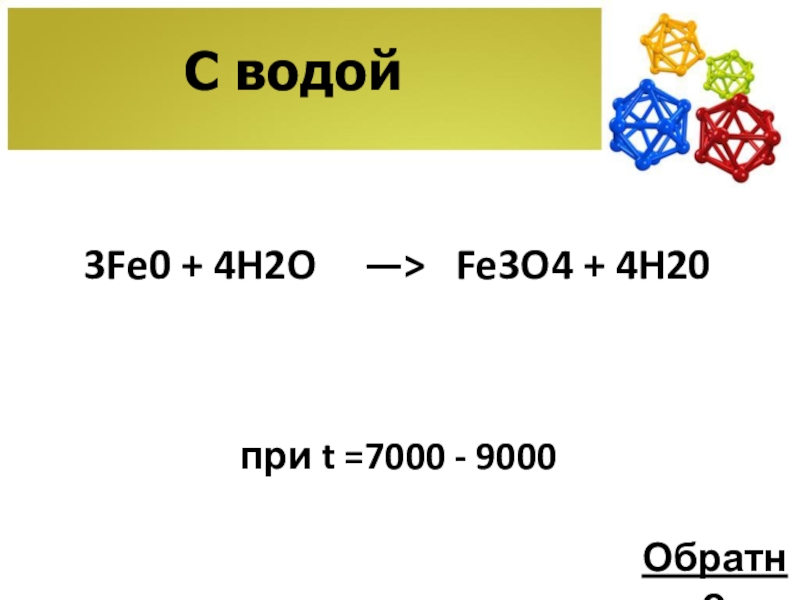
- 9. С водой3Fe0 + 4H2Oпри t =7000 - 9000—> Fe3O4 + 4H20 Обратно
- 10. С солямиОПЫТ: осуществите реакцию между порошком железа
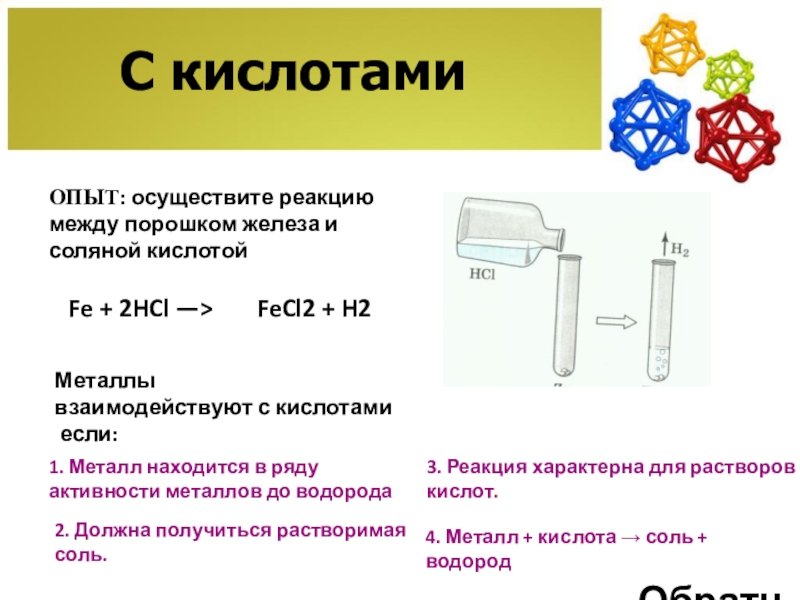
- 11. С кислотамиОПЫТ: осуществите реакцию между порошком железа
- 12. Интересные факты А количество
- 13. Нахождение в природе Железо является
- 14. Важнейшие источникиСодержание
- 15. Получение Чистое железо можно получить электролитическим
- 16. H3PO4 + Fe(OH)3 Fe(OH)3 + 3HCl FeO
- 17. Вывод Железо один из самых
- 18. Спасибо за внимание!
Слайд 1Железо
Над презентацией работали:
Терехина Регина,
Барышева Алена,
учитель химии
Быкова Светлана Витальевна
Слайд 2Содержание
Цель
Первые понятия о железе
Значение
Физические свойства
Химические свойства(с простыми веществами)
Химические свойства(со сложными
Интересные факты
Нахождение в природе
Важнейшие источники железа
Получение
Химические реакции
Вывод
Слайд 3Цели
Содержание
Формирование понятий
о железе:
Изучение химических и
физических
Решение практических задач
и уравнений реакций;
Значение в природе;
Рассмотрение
интересных фактов;
Получения железа
в природе;
Вывод.
Слайд 4Ковкий, вязкий металл серебристо-белого цвета.
Гидротермальный источник с железистой водой. Оксиды железа
Fe
Содержание
В земной коре 5,1% железа,
2 место после алюминия.
Слайд 5Значение
Железо — один из самых используемых металлов, на него приходится до
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется в черно-белых лазерных принтерах в качестве тонера.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Содержание
Слайд 6Физические свойства
Цвет : серебристо-белый
Блеск : блестящий
Пластичность : очень пластичный, легко куется,
Магнитные свойства : намагничивается и размагничивается
Температура плавления : 15390С
Твердость : твердый
Содержание
Слайд 7Химические свойства
Взаимодействие с простыми веществами-неметаллами
2) С кислородом
3Fe + 2O2
—>Fe3O4
Содержание
1)
Fe + S
—>FeS
электронный баланс
Fe0 – 2e- —> Fe2+
S0 + 2e- —> S2-
2Fe0 + 3Cl20
—> 2FeCl3
электронный баланс
Fe0 – 3e- —> Fe3+
Cl20 +2e- —> 2Cl1-
Слайд 8Химические свойства
Взаимодействие со сложными веществами
Содержание
1) С водой
2) С солями
Слайд 10С солями
ОПЫТ: осуществите реакцию между порошком железа и раствором хлорида
меди (II).
Fe + CuCl2 —>
Металлы
взаимодействуют с растворами солей
если:
1. Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений.
2. Обе соли (и реагирующая, и образующая в результате реакции) должны быть растворимыми.
Обратно
FeCl2 + Cu
Слайд 11С кислотами
ОПЫТ: осуществите реакцию между порошком железа и соляной кислотой
Fe +
Металлы
взаимодействуют с кислотами
если:
1. Металл находится в ряду активности металлов до водорода
2. Должна получиться растворимая соль.
3. Реакция характерна для растворов кислот.
4. Металл + кислота → соль + водород
Обратно
FeCl2 + H2
Слайд 12Интересные факты
А количество железа, равное всему добытому
При комнатной температуре железо легко намагничивается. Однако его трудно намагнитить в нагретом виде. Магнитные свойства железа исчезают при температуре около +800 °С.
В чистом природном состоянии железо встречается лишь в немногих местах на Земле, например на западе Гренландии. Беспримесное железо иногда находят в метеоритах. Гораздо чаще железо встречается в виде химических соединений. Железо извлекают из руд, содержащих такие минералы, как гематит, гетит, магнетит, сидерит и пирит. Ржавое железо весит больше.
В организм животных и человека железо поступает с пищей, наиболее богаты им печень, мясо, яйца, бобовые, хлеб, крупы, свекла.
Содержание
Слайд 13Нахождение в природе
Железо является также одним из наиболее
Содержание
Железо играет важную роль в образовании хлорофилла, являясь составной частью ферментов, участвующих в синтезе зеленого пигмента;
Слайд 15Получение
Чистое железо можно получить электролитическим восстановлением солей железа.
Содержание
FeCl2 =
Fe2+ + 2Cl-
Восстановление оксидов железа Fe2O3 и Fe3O4 при алюминотермии:
8Al + 3Fe3O4 =
9Fe + 4Al2O3
Основная масса железа используется не в чистом виде, а виде сплавов с углеродом (чугуна и стали) и другими элементами. Основная масса железа вырабатывается в доменных печах. Процесс, протекающий в доменной печи при получении сплавов железа, основан на восстановлении оксидов железа при нагревании:
3Fe2O3 + CO =
2Fe3O4 + CO2
Fe3O4 + CO =
3FeO + CO2
FeO + CO
= Fe + CO2
FeO + C
= Fe + CO
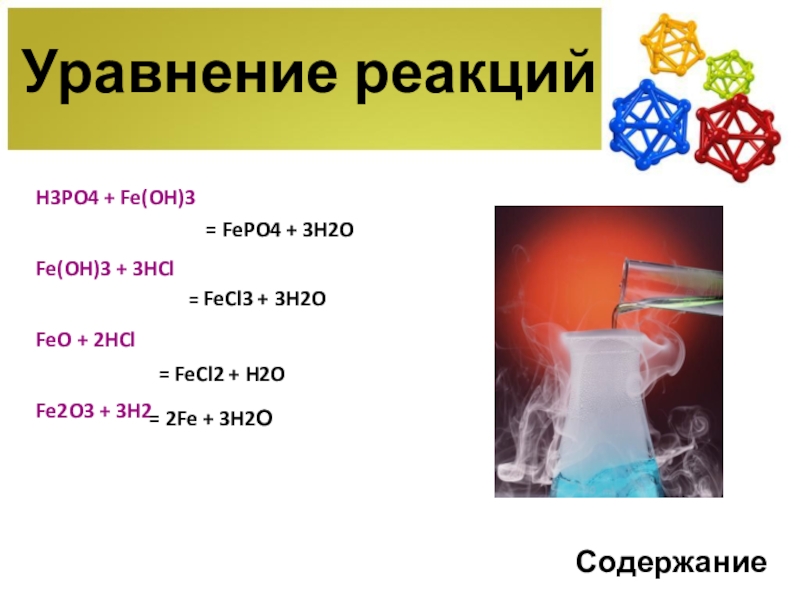
Слайд 16H3PO4 + Fe(OH)3
Fe(OH)3 + 3HCl
FeO + 2HCl
Fe2O3 +
Уравнение реакций
= FePO4 + 3H2O
= FeCl3 + 3H2O
= FeCl2 + H2O
= 2Fe + 3H2О
Содержание
Слайд 17Вывод
Железо один из самых значимых и известных металлов.
Содержание