- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему 5. Химические реакции. Скорость химической реакции
Содержание
- 1. 5. Химические реакции. Скорость химической реакции
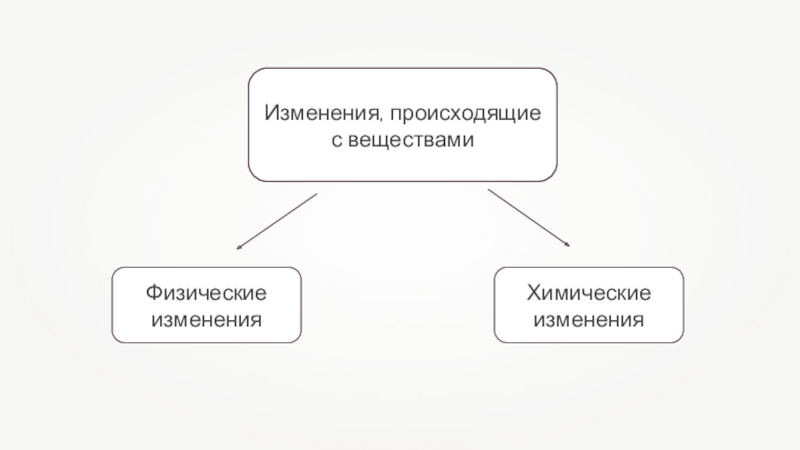
- 2. Изменения, происходящие с веществами
- 3. Физические изменения — это изменения, происходящие с
- 4. Химические изменения — это изменения, при которых
- 5. Слайд 5
- 6. Классификация реакции на основании различных признаков1. Число
- 7. Изменение степени окисления0+1-1+3-10
- 8. Классификация реакции на основании различных признаков1. Число
- 9. Катализатор — вещество, изменяющее скорость химической реакции.
- 10. Слайд 10
- 11. Быстрое протекание реакции
- 12. Скорость химической реакции — это изменение концентрации реагирующих веществ в единицу времени.
- 13. Формула концентрации химических веществ
- 14. Формула скорости химической реакции
- 15. Слайд 15
- 16. 1. Природа реагирующих веществ. Скорость химической реакции зависит от того, какие вещества вступают в реакцию. ZnPbH2SO4
- 17. 1. Природа реагирующих веществ. Pb + H2SO4
- 18. 2. Концентрация реагирующих веществ.Чем выше концентрация реагирующих веществ, тем выше и скорость взаимодействия между ними. ZnHCl10%HCl20%HCl30%
- 19. 2. Концентрация реагирующих веществ.Zn + 2HCl =
- 20. Слайд 20
- 21. Слайд 21
- 22. 3. Площадь соприкосновения реагирующих веществЧем больше площадь соприкосновения реагирующих веществ, тем выше скорость реакции.AlH2SO4
- 23. 3. Площадь соприкосновения реагирующих веществЧем выше температура,
- 24. Слайд 24
- 25. 4. ТемператураCuOH2SO4Чем выше температура, тем больше скорость реакции.
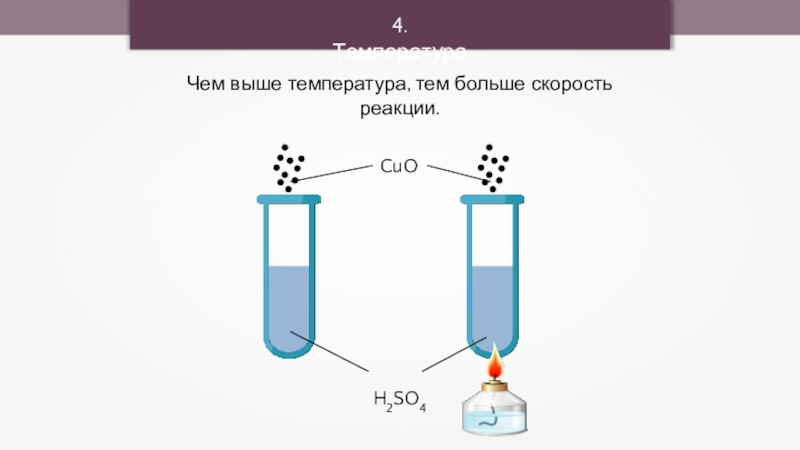
- 26. 4. ТемператураЧем выше температура, тем больше скорость реакции.CuO + H2SO4 = CuSO4 + H2O
- 27. Якоб Хендрик Вант-Гофф1852–1911 гг. Голландский учёный. Сформулировал
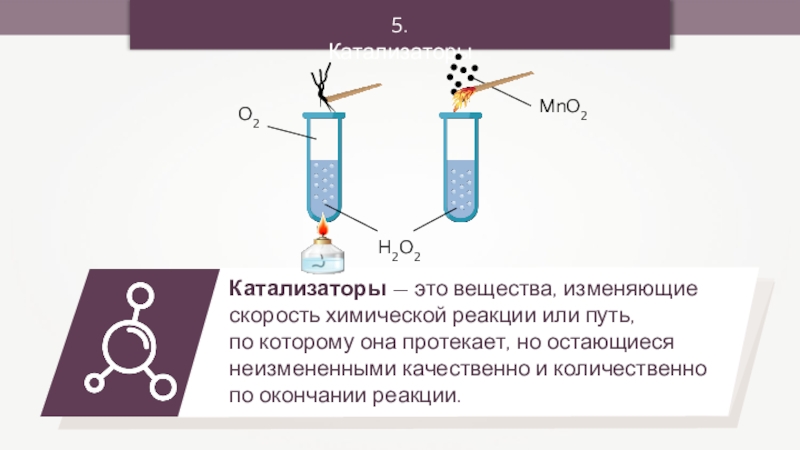
- 28. 5. КатализаторыH2O2O2
- 29. 5. Катализаторы2Н2О2 = 2Н2О + О2↑
- 30. В производстве серной кислоты достаточные скорости окисления
- 31. Факторы, влияющие на скорость химической реакции1. Природа
Изменения, происходящие с веществами
Слайд 3
Физические изменения — это изменения, происходящие с веществами под воздействием различных
факторов (температуры, давления),
при которых не происходит образования новых веществ.
при которых не происходит образования новых веществ.
Слайд 4
Химические изменения — это изменения, при которых из исходных веществ образуются
новые вещества.
Они также носят название химических реакций.
Они также носят название химических реакций.
Слайд 6
Классификация реакции на основании различных признаков
1. Число и состав исходных веществ
и продуктов реакции.
2. Обратимость реакции.
3. Тепловой эффект.
4. Изменение степеней окисления элементов, образующих вещества, участвующие в реакции.
2. Обратимость реакции.
3. Тепловой эффект.
4. Изменение степеней окисления элементов, образующих вещества, участвующие в реакции.
Слайд 8
Классификация реакции на основании различных признаков
1. Число и состав исходных веществ
и продуктов реакции.
2. Обратимость реакции.
3. Тепловой эффект.
4. Изменение степеней окисления элементов, образующих вещества, участвующие в реакции.
5. Агрегатное состояние реагирующих веществ.
6. Участие катализатора.
2. Обратимость реакции.
3. Тепловой эффект.
4. Изменение степеней окисления элементов, образующих вещества, участвующие в реакции.
5. Агрегатное состояние реагирующих веществ.
6. Участие катализатора.
Слайд 12
Скорость химической реакции — это изменение концентрации реагирующих веществ в единицу
времени.
Слайд 16
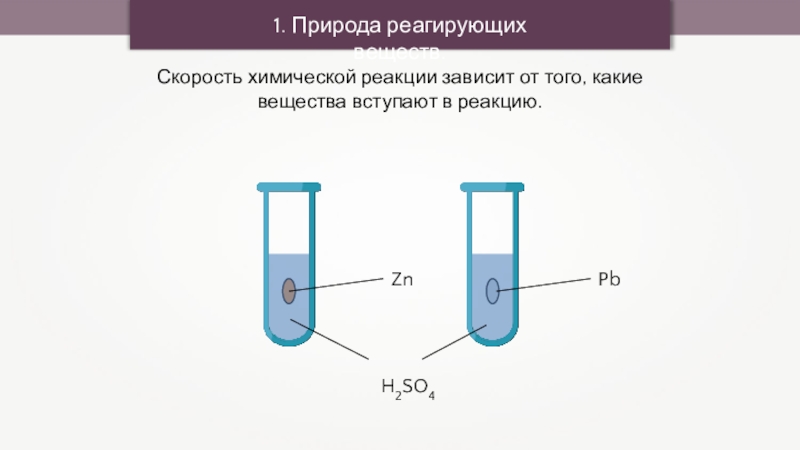
1. Природа реагирующих веществ.
Скорость химической реакции зависит от того, какие
вещества вступают в реакцию.
Zn
Pb
H2SO4
Слайд 17
1. Природа реагирующих веществ.
Pb + H2SO4 = PbSO4 + H2↑
Скорость химической реакции зависит от того, какие вещества вступают в реакцию.
Слайд 18
2. Концентрация реагирующих веществ.
Чем выше концентрация реагирующих веществ,
тем выше и
скорость взаимодействия между ними.
Zn
HCl
10%
HCl
20%
HCl
30%
Слайд 19
2. Концентрация реагирующих веществ.
Zn + 2HCl = ZnCl2 + H2↑
Чем больше
площадь соприкосновения реагирующих веществ, тем выше скорость реакции.
Слайд 22
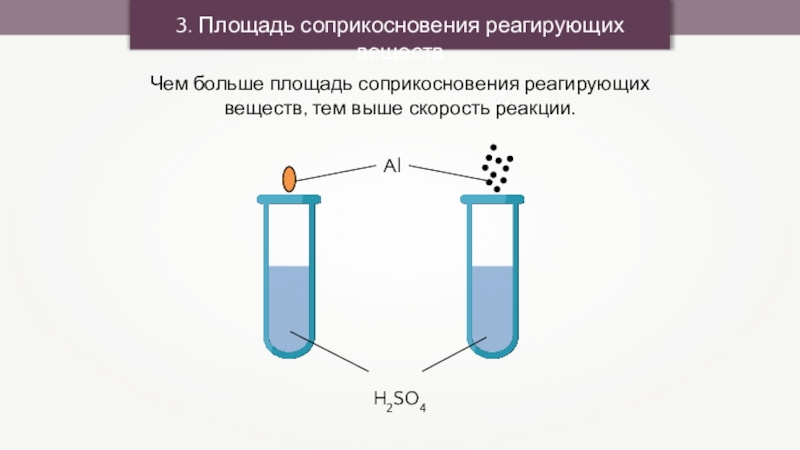
3. Площадь соприкосновения реагирующих веществ
Чем больше площадь соприкосновения реагирующих веществ, тем
выше скорость реакции.
Al
H2SO4
Слайд 23
3. Площадь соприкосновения реагирующих веществ
Чем выше температура, тем больше скорость
реакции.
Проведем следующий опыт.
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
Слайд 27
Якоб Хендрик Вант-Гофф
1852–1911 гг.
Голландский учёный. Сформулировал основное правило возрастания скорости
реакции при повышении температуры.
При повышении температуры на каждые 10 ̊ С скорость химической реакции возрастает в 2 – 4 раза.
При повышении температуры на каждые 10 ̊ С скорость химической реакции возрастает в 2 – 4 раза.
Слайд 30В производстве серной кислоты достаточные скорости окисления диоксида серы SO2 в
триоксид SO3 достигаются только в присутствии катализатора — платины или оксида ванадия.
Слайд 31
Факторы, влияющие на скорость химической реакции
1. Природа реагирующих веществ.
2. Концентрация реагирующих
веществ.
3. Площадь соприкосновения реагирующих веществ.
4. Температура.
5. Катализаторы.
3. Площадь соприкосновения реагирующих веществ.
4. Температура.
5. Катализаторы.